白酒中鄰苯二甲酸二乙酯的化學發光酶聯免疫分析方法
黃少文,羿利華,孫遠明,2,3,雷紅濤,2,3,柳春紅,2,3*,沈玉棟,2,3*
1(華南農業大學 食品學院,廣東 廣州,510642) 2(廣東省食品質量安全重點實驗室,廣東 廣州,510642) 3(農業部農產品貯藏保鮮質量安全風險評估實驗室,廣東 廣州,510642)
?
白酒中鄰苯二甲酸二乙酯的化學發光酶聯免疫分析方法
黃少文1,羿利華1,孫遠明1,2,3,雷紅濤1,2,3,柳春紅1,2,3*,沈玉棟1,2,3*
1(華南農業大學 食品學院,廣東廣州,510642)2(廣東省食品質量安全重點實驗室,廣東 廣州,510642)3(農業部農產品貯藏保鮮質量安全風險評估實驗室,廣東 廣州,510642)
以鄰苯二甲酸二乙酯(diethylphthalate,DEP)為研究目標,以4-氨基鄰苯二甲酸二乙酯為半抗原,通過重氮法偶聯載體蛋白并免疫動物,制備針對DEP的特異性兔多克隆抗體。通過棋盤滴定法和單因素實驗確定最佳的實驗參數,即包被抗原濃度為50ng/mL,4 ℃環境下包被12h;抗體用T液稀釋;藥物緩沖液選用pH5.4、0.005mol/L的PBS緩沖液;酶標二抗用P液稀釋,稀釋度為1/3000;反應時間是:一抗∶二抗=30min:40min。基于此建立了間接競爭化學發光酶聯免疫法檢測DEP。該方法對DEP的最低檢測限(LOD)為3.09ng/mL,檢測范圍(IC20~IC80)為5.93~42.03ng/mL,半抑制濃度(IC50)值為16.57ng/mL,與14種結構類似物及功能類似物交叉反應均遠低于0.5%,通過對白酒樣品添加回收率的測定,證明了該方法的準確性,適用于白酒中DEP的快速檢測。
鄰苯二甲酸二乙酯;化學發光酶聯免疫;間接競爭
鄰苯二甲酸二乙酯(diethylphthalate,DEP)屬于鄰苯二甲酸酯類化合物中(phthalicacidesters,PAEs)的一種,主要用于塑料增塑劑、潤滑劑、樹脂溶劑、印刷油墨、膠黏劑、化妝品、農藥載體等領域[1],在生產和加工過程中,作為增塑劑的DEP并未與PVC塑料基質或其他產品牢固結合,隨著這些產品的使用或廢棄,DEP就會不斷的釋放進入環境,成為普遍的環境污染物[2],并可通過食物鏈進入人體[3-4]。動物實驗已證實,DEP對生殖系統有損害作用[6-13]。為了減少DEP對人類健康的潛在危害,美國環保總局(EPA)將包括DEP在內的6種PAEs列為環境中重點控制的污染物[14],我國將包括DEP在內的3種PAEs類化合物列入優先污染物黑名單,世界自然基金會(WWF)公布的68種環境類激素污染物中也包括了DEP等8種PAEs類化合物[15],2011年臺灣地區多種飲料和果汁中先后檢測出高劑量的DEP等PAEs類化合物,同年衛生部發布緊急通告,將包括DEP在內的17種鄰苯二甲酸酯類物質列入“食品中可能違法添加的非食用物質和易濫用的食品添加劑名單”[16]。
目前,檢測鄰苯二甲酸二乙酯的方法主要是儀器分析法,包括氣相色譜法[17-18]、氣相色譜-質譜法[19-21]和高效液相色譜法[22-25]高效液相色譜-質譜法[26],但這類分析方法儀器昂貴、樣品處理復雜、分析時間長,很難滿足現場大規模及快速檢測。而免疫分析法具有靈敏度高、特異性強、能適應大量樣品的快速檢測等特點。此前,已有對鄰苯二甲酸二乙酯酶聯免疫吸附方法的報道,ZHANG等[27]報道了純牛奶、酸奶中DEP含量的間接競爭ELISA方法,檢測限為0.004 9ng/mL。
化學發光酶免疫分析法是一種新型的免疫分析方法,該方法在進行檢測時不需要外界光源,減少了背景干擾,可以進一步提高檢測的靈敏度,具有簡便、靈敏、無污染等特點[28]。目前尚無化學發光酶免疫法檢測DEP的報道。而白酒在生產過程中由于沒有完全杜絕塑料制品作為輸送管道或以塑料制品來進行酒的存儲,致使添加到塑料中的DEP有可能遷移到白酒中對白酒造成污染。因此,有必要加強對白酒中的DEP進行監測。本研究在合成DEP半抗原及多克隆抗體的基礎上,建立了DEP化學發光酶免疫分析方法。該方法對于大規模快速篩查白酒類食品中的DEP具有實用價值。
1 材料與方法
1.1材料與儀器
MS1漩渦振蕩儀,廣州儀科實驗室技術有限公司;星海旋轉蒸發器,無錫市星海王生化設備有限公司;WellwashMK2洗板機,美國Thermo公司;MultiskanMK3酶標儀,美國Thermo公司;96孔可拆卸發光板,深圳金燦華實業有限公司;TGL-16G高速臺式離心機,上海安亭科學儀器廠生產;移液槍,德國Eppendorf公司;DK-8D電熱恒溫水槽,上海醫用恒溫設備廠;其他玻璃器皿均為國產。
鄰苯二甲酸二乙酯(Sigma公司);HRP標記的羊抗兔IgG抗體(武漢博士德生物工程有限公司);包被緩沖液(CB液,0.1mol/LpH9.6):稱取NaHCO31.475g,Na2CO30.845g, 再用去離子水定容至500mL;磷酸緩沖液PBS(pH7.4,0.01mol/L):稱取8.5gNaCl,2.9gNa2HPO4·12H2O,0.2gKCl,0.2gKH2PO4,再用去離子水定容至1L;PBST:上述PBS基礎上,每1L添加500μL吐溫20(Tween-20);洗滌液:稱取40gNaCl,15gNa2HPO4·12H2O,3mL吐溫-20,再用去離子水定容至5L;檸檬酸緩沖液(pH5.0, 0.05mol/L):稱取18.4gNa2HPO4·12H2O,5.11g檸檬酸,溶于1L去離子水;醋酸緩沖液(pH4.0):稱取29.25gNaCl,2.45gNaAC·3H2O,4.74mLHAC溶于1L去離子水;Tris-HCl緩沖液(0.01mol/LpH7.4):即T液,Tris1.21g,用800mL去離子水溶解;用1mol/L鹽酸溶液調節溶液到所需pH值;用去離子水定容至1L;CLEIA底物液A:Luminol-Na4mg溶于20mL0.1moL/L的T液中;CLEIA底物液B:2mg對碘酚溶于100μL二甲基亞砜(DMSO),加入4μL3%的雙氧水(H2O2)。
1.2實驗方法
1.2.1半抗原及抗原合成
取543.5mg4-氨基鄰苯二甲酸(4-APA)溶于14mL無水乙醇,室溫下逐滴加入4mL氯化亞砜,于70 ℃反應過夜。反應結束后旋蒸除去反應液,得到的粗產物用10mL飽和Na2CO3調堿,再加入飽和NaCl/乙酸乙酯體系萃取3次,收集有機相,加無水硫酸鈉粉末于有機相中除水,使用過濾的方法除去硫酸鈉,得到的有機相經旋蒸濃縮后過硅膠柱(石油醚∶乙酸乙酯=40∶17),得到黃色固體(半抗原4-氨基鄰苯二甲酸二乙酯即4-ADEP),產物經薄層層析鑒定純度后,進一步用質譜(MS)及核磁共振(NMR)進行結構鑒定。通過重氮化法[29]偶聯載體蛋白BSA和OVA,獲得免疫原4-ADEP-BSA和包被原4-ADEP-OVA,用紫外掃描法對偶聯物進行鑒定[30]。
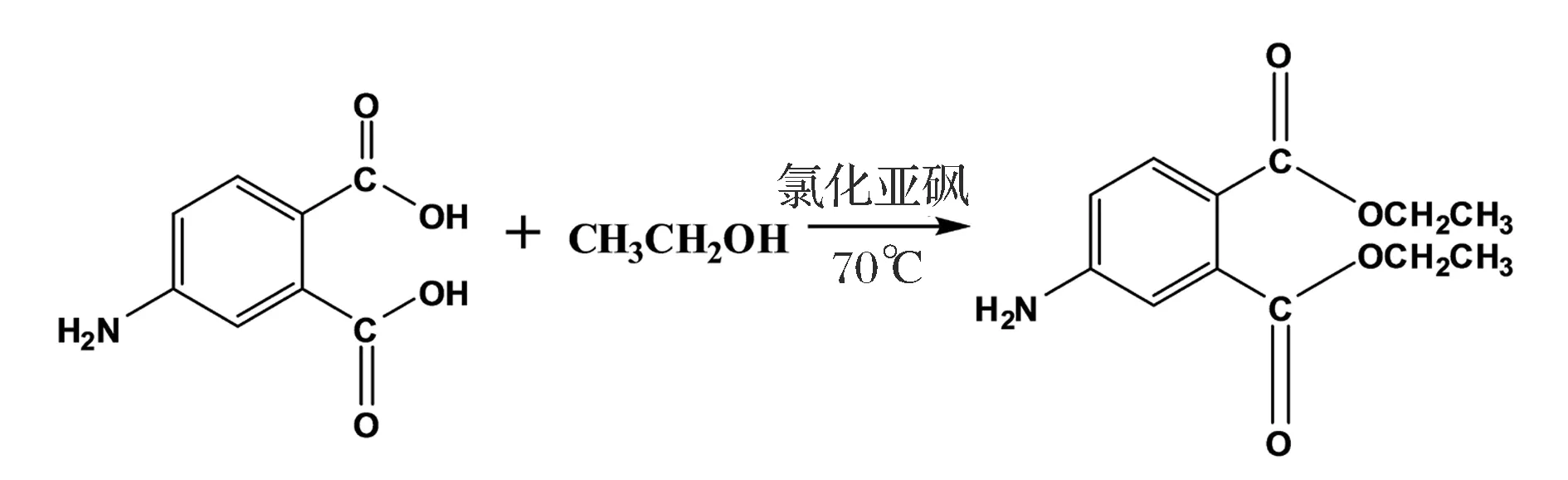
圖1 鄰苯二甲酸二乙酯半抗原合成設計Fig.1 The synthesis of 4-ADEP
1.2.2抗體的制備
合成的4-ADEP-BSA作免疫原免疫。將免疫原用生理鹽水稀釋至1mg/mL(以蛋白濃度計),分別免疫兩只SPF級1.8~2.2kg雌性新西蘭大白兔,實驗前取陰性血清作為對照。首次免疫用1mg免疫原與等體積的弗氏完全佐劑混合,乳化成油包水結構后使用皮下多點注射。4周后用同樣劑量的免疫原與弗氏不完全佐劑進行免疫,隨后每隔3周注射1次直至抗血清效價穩定。最后1次免疫后7天心臟動脈取血,采用室溫自然凝固分離抗血清,在4 ℃下放置過夜,12 000r/min離心15min,取上清液即得抗血清,加入等量甘油混勻分裝,于-20 ℃凍存。用間接ELISA法測定上述兔抗血清效價和抑制。
1.2.3icCLEIA檢測模式的建立
實驗步驟:用包被緩沖液將包被抗原稀釋到最佳使用濃度,加到酶標板孔中,100μL/孔,37 ℃(或4 ℃)包被過夜;傾去孔內液體,自動洗板機上洗滌2次,每孔加洗滌液300μL,甩干;分別加入封閉緩沖液120μL/孔,37 ℃培養箱中孵育3h;將封閉好的板取出,甩去各孔中的封閉液,再置37 ℃烘箱中0.5h,備用;平衡30min后加入梯度稀釋標準溶液(或樣品提取液)50μL/孔,同時加入抗體50μL/孔,輕搖混合,37 ℃培養箱中孵育40min;洗滌5次,甩干;加入100μL/孔羊抗兔IgG-HRP(1/5 000倍稀釋),37 ℃培養箱中孵育40min;洗滌5次,甩干;每孔加入化學發光顯色液100μL(A、B液等量混勻),立即用酶標儀讀取425nm處的相對發光值(Relativelightunit,RLU)。
實驗條件優化:為使CLEIA方法獲得最好的靈敏度和穩定性,本研究用方陣試驗法(棋盤滴定)確定包被抗原濃度和抗體稀釋倍數,以單因素實驗,考察藥物緩沖液、pH、二抗濃度、競爭反應時間等對icCLEIA的影響,并采用RLU0/IC50來對比不同CLEIA反應條件下方法靈敏度的差異,RLU0/IC50的值越高,說明方法的靈敏度也越高。在最優條件下,以鄰苯二甲酸二乙酯濃度的對數值IgC為橫坐標,相應的發光值RLU為縱坐標,使用Origin8.0軟件,按照RLU-IC50四參數對數擬合繪制鄰苯二甲酸二乙酯icCLEIA方法的標準曲線。根據標準曲線計算出該方法的IC50和線性(IC20~IC80)。
1.2.4icCLEIA特異性分析
采用所建立的方法測定抗鄰苯二甲酸二乙酯多克隆抗體與鄰苯二甲酸二乙酯結構類似物的競爭反應,分別計算鄰苯二甲酸二乙酯結構類似物的IC50,則交叉反應率為鄰苯二甲酸二乙酯與其結構類似物的IC50之百分比。交叉反應率越高,特異性越差。
1.2.5樣品前處理
稱取一定量白酒于玻璃試管中,40 ℃下氮吹至近干,加入2mL超純水洗1次,后加入6mL正己烷萃取,渦旋1min,靜置2min,收集正己烷層,正己烷重復萃取1次,合并正己烷層,40 ℃旋轉蒸發濃縮,1mL甲醇復溶,稀釋后用于icCLISA方法進行測定。
1.2.6實際樣品檢測
在白酒樣品中添加不同含量水平的標準品,另設1個空白樣本,按照樣品前處理方法對樣品進行處理,計算樣品添加回收率(Recovery,%)和變異系數(CV,%)。
2 結果與分析
2.1半抗原合成與鑒定
合成的半抗原4-氨基鄰苯二甲酸二乙酯(4-ADEP)(相對分子質量為237)經電噴霧質譜和核磁共振掃描鑒定圖譜分析結果(見圖2和圖3):合成產物的(+)ESI-MS質譜圖,出現m/z 238.0的分子離子峰,與鄰苯二甲酸二乙酯半抗原分子質量對應。1H-NMR(600MHz,CDCl3):7.72 (d, J = 8.44Hz, 1H,CH), 6.72 (d, J = 2.28Hz, 1H,CH), 6.68 (dd, J = 8.45, 2.30Hz, 1H,CH), 4.35 (q, J = 7.16Hz, 2H,CH2), 4.29 (q, J = 7.13Hz, 2H,CH2), 4.20 (s,br, 2H,NH2), 1.32~1.37 (m, 6H, 2CH3)。證明4-氨基鄰苯二甲酸二乙酯合成成功。

圖2 半抗原4-ADEP的ESI-MS圖譜( [M-H]+)Fig.2 The ESI-MS spectrum of 4-ADEP

圖3 半抗原4-ADEP的1H-NHR圖譜Fig.3 The 1H-NHR spectrum of 4-ADEP
2.2人工抗原鑒定
采用重氮化法合成人工抗原,紫外可見光譜掃描鑒定人工抗原。從圖4可以看出,相比半抗原(最大吸收275nm)和載體蛋白(最大吸收280nm),人工抗原的特征吸收(最大吸收339nm)已經發生明顯的偏移。這是因為在載體蛋白上成功偶聯半抗原后,半抗原最大吸收相互疊加,所以紫外光譜中峰形發生了改變,同時具備載體蛋白和半抗原的吸收特征。這說明在載體蛋白BSA和OVA上分別連接了半抗原,人工免疫抗原和包被抗原偶聯成功。

圖4 4-ADEP、蛋白及偶聯物紫外掃描圖譜Fig.4 The UV-scanning of 4-ADEP,protein and conjugates
2.3抗體的鑒定
采用間接競爭ELISA法測定抗血清效價為1∶32 000,抗DEP兔多抗具有很高的效價,對抗血清作效價抑制曲線,結果見圖5。從圖5可以看出,抗血清的效價為32K,抑制率為82.93%,對鄰苯二甲酸二乙酯的特異性較好,因此,說明人工抗原成功誘導兔子體內產生免疫應答,其體內產生了相應的抗體,進一步證明全抗原合成非常成功,而且純度較高。

圖5 兔抗血清效價抑制曲線Fig.5 The titer and inhibition curve of rabbit antiserum
2.4鄰苯二甲酸二乙酯icCLEIA方法建立
對影響icCLEIA的實驗參數進行了優化,通過比較RLU0/IC50值大小(值越大方法的檢測效果越好)[31],得到最佳反應條件,即包被抗原濃度為50ng/mL,4 ℃環境下包被12h;抗體用T液稀釋;藥物緩沖液選用pH5.4、0.005mol/L的PBS緩沖液;酶標二抗用P液稀釋,稀釋度為1/3 000;反應時間是:一抗∶二抗=30min∶40min。基于此構建了鄰苯二甲酸二乙酯的icCLEIA標準曲線,結果如圖6,擬合得到icCLEIA的檢測限為3.09ng/mL,檢測范圍為5.93~42.03ng/mL,半抑制濃度為16.57ng/mL。

圖6 鄰苯二甲酸二乙酯icCLEIA標準曲線Fig.6 Sdandard curve of DEP
2.5抗體的特異性研究
對方法的特異性進行評價,其靈敏度(IC50)、交叉反應率(CR),如表1所示。可以看出,14種類似物中,除了與鄰苯二甲酸二異丁酯和鄰苯二甲酸二丁酯有一點交叉外,但交叉反應率均小于0.5%,與其他藥物均沒有交叉反應,表明以鄰苯二甲酸二乙酯抗體建立的icCLEIA方法特異性良好,靈敏度高。
2.6實際樣品檢測
向陰性樣品中添加0.3、1.0和2.0μg/g的DEP,采用所建立的icCLEIA方法對樣品進行檢測,同時上述樣品同樣采用HPLC進行檢測比較, 結果表明(表2),icCLEIA方法的樣品回收率在77.3%~94.2%之間,變異系數均小于12%,HPLC方法的樣品回收率在83.33%~93.12%之間,變異系數均小于10%,說明所建立的icCLEIA方法的準確度和精密度好。

表1 鄰苯二甲酸二乙酯結構類似物及功能類似物交叉反應率結果
3 結論
本文通過優化學發光酶免疫的各種條件,建立了鄰苯二甲酸二乙酯間接競爭化學發光酶聯免疫分析方法,該方法的IC50值為16.57ng/mL;樣品回收率在78.9%~93.5%之間,與其他結構類似物未見明顯交叉,檢測范圍為5.93~42.03ng/mL,最低檢測限(LOD)為3.09ng/mL。采用icCLEIA和HPLC兩種方法測定相同添加濃度的樣品,結果與HPLC法的結果相符。該方法具有靈敏度高,操作時間短、操作簡便等特點,適用于白酒樣品中的DEP的大規模篩查。

表2 實際樣品添加回收率(n=3)
[1]SCHETTLERTED.Humanexposuretophthalatesviaconsumerproducts[J].InternationalJournalofAndrology,2006,29(1):134-139.
[2]BLISSTV,GARDNER-MEDWINAR.Long-lastingpotentiationofsynaptictransmissioninthedentateareaoftheanaesthetizedrabbitfollowingstimulationoftheperforantpath[J].TheJournalofPhysiology,1973,232:331-356.
[3]劉冊家,向蘭,楊美華.我國環境中鄰苯二甲酸酯分布狀況研究進展[J].中國現代中藥,2008(3):37-40.
[4]張蘊暉,林玲,闞海東,等.鄰苯二甲酸二丁酯的人群綜合暴露評估[J].中國環境科學,2007(5):651-656.
[5]EMAM,HARAZONOA,MIYAWAKIE,etal.Embryolethalityfollowingmaternalexposuretodibutylphthalateduringearlypregnancyinrats[J].BulletinofEnvironmentalContaminationandToxicology,1997,58(4):636-643.
[6]LEHMANNKP,PHILLIPSS,SARM,etal.Dose-Dependentalterationsingeneexpressionandtestosteronesynthesisinthefetaltestesofmaleratsexposedtodi(n-butyl)phthalate[J].ToxicologicalSciences,2004,81(1):60-68.
[7]SINGHAR,LAWRENCEWH,AUTIANJ.Teratogenicityofphthalateestersinrats[J].JournalofPharmaceuticalSciences,1972,61(1):51-55.
[8]常兵,劉德瑜,梁玉香,等.鄰苯二甲酸二丁酯對青春期雄性大鼠的生殖毒性研究[J].中國自然醫學雜志,2007, 9(3):164-168.
[9]李玲,田曉梅,宋琦如,等.鄰苯二甲酸二丁酯和鄰苯二甲酸二 (2-乙基己基) 酯聯合染毒對雌性大鼠的生殖毒性[J].環境與健康雜志,2010,27(10):857-860.
[10] 林玲,王玉柱,丁訓誠,等.鄰苯二甲酸二丁酯對斑馬魚胚胎發育毒性的研究[J].衛生研究,2008,37(3):278-280.
[11]張蘊暉,陳秉衡,丁訓誠,等.鄰苯二甲酸二丁酯宮內和哺乳期染毒對F1 代雄性大鼠的生殖發育毒性[J].衛生研究,2004,33(1):9-14.
[12]WHO/IPCS.Globalassessmentofthestate-of-the-scienceofendocrinedisruptors[M].Geneva:WorldHealthOrganization,2002.
[13]王連生.環境污染化學[M].北京:化學工業出版社,1995:316-318.
[14]EPA.Supplementaryguidanceforconductinghealthriskassessmentofchemicalmixtures(EPA/630/R-00/002)[M].OfficeofResearch&Development,NationalCenterforEnvironmentalAssessment,EnvironmentalProtectionAgency,2000.
[15]林興桃,王小逸,呂文濤,沈婷.鄰苯二甲酸酯代謝研究進展[J]. 環境與健康雜志,2009(2):182-184.
[16]中華人民共和國衛生部.關于公布食品中可能違法添加的非食用物質和易濫用的食品添加劑名單(第六批)的公告(衛生部公告2011年第16號)[EB/OL].2011-06-01.
[17]CINELLIG,AVINOP,NOTARDONATOI,etal.StudyofXAD-2adsorbentfortheenrichmentoftracelevelsofphthalateestersinhydroalcoholicfoodbeveragesandanalysisbygaschromatographycoupledwithflameionizationandion-trapmassspectrometrydetectors[J].FoodChemistry,2014,146(3):181-187.
[18]SUNMeng,DAIJin-na,WANGXiao-fang,etal.DeterminationofphthalateestersinpolyvinylchlorideinfusionbagbystirbarsorptiveextractioncombinedwithGC[J].JournalofSeparationScience,2012,35(24):3 486-3 491.
[19]國家食品質量安全監督檢驗中心北京市海淀區產品質量監督檢驗所.GB/T21911—2008食品中鄰苯二甲酸酯的測定[S].北京:中國標準出版社,2008.
[20]施雅梅,徐敦明,周昱,等.QuEChERS/高效液相色譜測定食品中17種鄰苯二甲酸酯[J]. 分析測試學報,2011(12):1 372-1 376.
[21]YEQing,LIULin-hai,CHENZhong-bao,etal.Analysisofphthalateacidestersinenvironmentalwaterbymagneticgraphenesolidphaseextractioncoupledwithgaschromatography-massspectrometry[J].JournalofChromatographyA,2014,1 329(3):24-29.
[22]佟曉波,李瑩,矯筱曼,等.HPLC法測定化妝品中十六種鄰苯二甲酸酯類化合物[J].香料香精化妝品,2012(3):33-35.
[23]徐振東,金尉,顧娟紅,等.快速液相分析法測定化妝品中鄰苯二甲酸酯類化合物[J].香料香精化妝品,2012(2):33-36.
[24]FANYing-ying,LIUShu-hui,XIEQi-long.Rapiddeterminationofphthalateestersinalcoholicbeveragesbyconventionalionicliquiddispersiveliquid-liquidmicroextractioncoupledwithhighperformanceliquidchromatography[J].Talanta,2014,119(119):291-298.
[25]LIANYuan-pei,QIUXiao-yan,YANGYa-ling.Vortex-assistedliquid-liquidmicroextractioncombinedwithHPLCforthesimultaneousdeterminationoffivephthalateestersinliquorsamples[J].FoodAnalyticalMethods,2014,7(3):636-644.
[26]國家食品質量安全監督檢驗中心北京市海淀區產品質量監督檢驗所.GB/T21928—2008食品塑料包裝材料中鄰苯二甲酸酯的測定[S].北京:中國標準出版社,2008.
[27]ZHANGMing-cui,YUXiao-na,WANGYue,etal.Ahighlysensitiveindirectcompetitiveenzyme-linkedimmunosorbentassay(ic-ELISA)byantigencoatingfordiethylphthalateanalysisinfoods[J].FoodAnalyticalMethods,2013,6(4):1 223-1 228
[28]金茂俊,邵華,金芬,王靜.化學發光免疫分析方法的研究及應用[J].農產品質量與安全,2012(2):42-46.
[29]ZHANGMing-cui,LIUBo-lin,CONGYing,etal.Developmentofhighlyspecificfluorescenceimmunoassayandenzyme-linkedimmunosorbentassayfordetectionofdimethylphthalateinwatersamples[J].FoodandAgriculturalImmunology,2011,22( 4):297-309
[30]LUOLin,SHENYu-dong,WANGHong,etal.Productionofpolyclonalantibodyanddevelopmentofacompetitiveenzyme-linkedimmunosorbentassayforbenzoicacidinfoods[J].FoodAnalyticalMethods,2015,8( 5):1 101-1 111
[31]孫文佳,沈玉棟,孫遠明,等.化學發光酶免疫法檢測豬肉中氯丙嗪殘留[J].分析化學,2012(9):1 397-1 402.
Developmentofanindirectcompetitivechmiluminescenceenzymeimmunoassayfordiethylphthalateinliquor
HUANGShao-wen1,YILihua1,SUNYuan-ming1,2,3,LEIHong-tao1,2,3,LIUChun-hong1,2,3*,SHENYu-dong1,2,3*
1(FoodCollege,SouthChinaAgriculturalUniversity,Guangzhou510624,China)2(GuangdongProvincialKeyLaboratoryofFoodQualityandSafety,Guangzhou510642,China)3(LaboratoryofQualityandSafetyRiskAssessmentforAgro-productsonStorageandPreservation(Guangzhou),MinistryofAgriculture,Guangzhou510642,China)
4-Aminodiethylphthalate(4-ADEP)asthehaptenwascoupledtobovineserumalbumin(BSA)orovalbumin(OVA)andthenusedtoimmunizeNewZealandwhiterabbits.Polyclonalantibodywhichshowedspecificbindingtodiethylphthalate(DEP)wasthusobtained,andonthebasisofthis,anindirectcompetitivechemiluminescentenzyme-linkedimmunoassay(icCLEIA)wasdevelopedasfollows.Theoptimalconcentrationofcoatingantigenwas50ng/mLat4 ℃.TsolutionwasusingastheantibodybufferandPBSasthestandardbufferwiththepH5.4.TheIgG-HRPdilutionwas1∶3 000.Theincubationtimefortheprimaryantibodywas30minsandtheIgG-HRPreactiontimewas40mins.Underthebestconditions,theicCLEIAexhibitedalinearworkingrangefrom5.93to42.03ng/mL(IC20-IC80)withthelimitofdetectionof3.09ng/mLandthesensitivityIC50of16.57ng/mL.Thecrossreactivityrateswerelessthan0.5%.Theaveragedrecoveriesofliquorwere77.3%~94.2%.Thecoefficientofvariationofintra-assayandinter-assaywaslessthan12%.Inaddition,theaccuracyoftheassaywasvalidatedbydeterminationoftherecoveryinliquor.ThismethodhasagoodcorrelationwiththeHPLCmethod,whichindicateditshighsensitivityandspecificity.
DEP;chmiluminescence;icCLEIA
10.13995/j.cnki.11-1802/ts.201608031
碩士研究生(柳春紅,沈玉棟為通訊作者,E-mail:liuch@scau.edu.cn,syd_tyx@163.com)。
農業部農產品質量安全風險評估專項
(GJFP201501202);廣東省科技計劃項目(2013B020204001)
2016-01-29,改回日期:2016-04-03

