蒜素與大豆蛋白源巰基肽的二硫鍵結合物的制備及其表征
陳海橋,張彩猛,華欲飛,孔祥珍
(江南大學 食品學院,江蘇 無錫,214122)
?
蒜素與大豆蛋白源巰基肽的二硫鍵結合物的制備及其表征
陳海橋,張彩猛,華欲飛,孔祥珍*
(江南大學 食品學院,江蘇 無錫,214122)
蒜素與谷胱甘肽等多肽中的半胱氨酸殘基以二硫鍵形式結合被認為是蔥屬植物發揮其體內生理活性的第一步。蒜素和巰基肽體外均不穩定,制備蒜素與巰基的結合物有利于穩定發揮二者的生理活性。在制備還原或未還原大豆球蛋白、酶解物及其富集的巰基肽基礎上,研究了蒜素與大豆蛋白源巰基肽的二硫鍵結合物的制備條件。結果表明:反應溫度在24 ℃,反應pH 7.0,蒜素∶巰基摩爾濃度比=5∶4,反應時間1h條件下最佳,巰基反應完成度均達到95%以上。相同條件,還原后的蛋白比未還原的蛋白反應完成度更大。在最佳條件下,制得相應的產物,并對反應前后結合HPLC、MS-MS進行了一定表征,證明了結合物的結構。
蒜素;巰基肽;制備;表征
流行病學研究證明長期食用蔥屬植物(AlliumsativumL.)能降低許多人類疾病的風險[1],這主要歸功于其體內的有機硫化物,即大蒜素(二烯丙基硫代亞磺酸酯)及其他硫代亞磺酸酯類[2]。大蒜素是由大蒜破碎后,由體內蒜氨酸裂解酶(Alliinase, EC 4.4.1.4)催化蒜氨酸裂解形成[3]。蒜素具有諸多生理功效,如抑菌、抗真菌;抑制胃癌、腸癌、前列腺癌[4]。然而,蒜素在體外極不穩定,在20 ℃經20 h后幾乎完全分解為各種硫化物[5],這極大地限制了其利用價值。
生物活性實驗表明,蒜素的生理功效源于其巰基修飾反應,在體內易和谷胱甘肽、蛋白質在內的半胱氨酸殘基反應生成二硫鍵結合物。蒜素這些可能的代謝產物與蔥屬植物的生理活性相關[7]。ZHANG等證明蒜素的巰基二硫鍵結合物GSSA、CySSA 具有誘導細胞QR酶表達,抑制NO釋放的功效[8]。JOSPEDRAZA-CHAVERR發現,CySSA能改善小鼠體內因慶大霉素所致的腎中毒及氧化和亞硝基化應激[9]。
巰基肽主要有谷胱甘肽、植物螯合肽、金屬硫蛋白、抗菌肽,以及從蛋白酶解物中分離得到的肽。大豆球蛋白經水解制備的大豆多肽營養價值高,易消化,富含半胱氨酸殘基,具有顯著的抗氧化性、自由基清除、解毒作用[6]。富集的巰基肽段半胱氨酸殘基不穩定、需保存在酸性低溫環境,不利于生產與長期保存。
蒜素與小分子游離巰基如GSH反應迅速,受pH影響較大,RABINKOV報道[10]反應米氏常數K= 3.0 M-1s-1。目前尚無對蒜素和蛋白及多肽反應條件的報道,而這對于相應二硫鍵結合物的制備,以及后續通過產物活性證明蒜素可能發揮活性的機制有重要作用。本研究制備了大豆蛋白源的球蛋白,并通過還原、酶解、富集等方法制備了一系列巰基肽。其中以11S蛋白、以11S源富集的巰基肽為代表研究了蒜素和蛋白質及多肽的反應條件,并以巰基轉化率對反應完成率進行了表征。
1 材料與方法
1.1材料
1.1.1原料與試劑
低脫脂豆粕,山東禹王集團;半胱氨酸(Cys),谷胱甘肽(GSH),4,4-二硫二吡啶(DPS),烯丙基溴,胃蛋白酶(4 000 U/mg),均購自Sigma公司;乙腈為色譜純,購自J&K;C18填料購自Merck;巰丙基-瓊脂糖 6B填料,購自GE Healthcare;其余試劑均為國產分析純。
1.1.2儀器與設備
高效液相色譜儀1260系列帶紫外檢測器(variable wavelength detector,VWD)、ZORBAX SB C18色譜柱,美國Agilent科技有限公司;高速冷凍離心機,日本 Hitachi 公司;UV-Vis-2450型紫外可見分光光度計;DELTA320 pH計,METTLER TOLEDO(上海)。
1.2實驗方法
1.2.1蒜素的制備
蒜氨酸參照CORBI[11]氧化脫氧蒜氨酸制得,脫氧蒜氨酸參照YU[12]通過半胱氨酸與烯丙基溴反應制得。蒜素通過蒜酶催化分離而得。
1.2.2大豆球蛋白(11S)的提取
采用堿溶酸沉法制備大豆球蛋白。將脫脂豆粕分散在含10 mmol/L 2-巰基乙醇的30 mmol/L pH 8.0的Tris-HCl緩沖液中,豆粕和緩沖液比例1∶10(g∶mL)。攪拌1.5 h后3層紗布過濾,取上清液,于9 500 r/min,4 ℃離心30 min。將上清液pH值調至6.2,在9 500 r/min,4 ℃離心30 min。得到的沉淀分散在水中,調節pH 6.2,5 000 r/min,4 ℃離心20 min,重復2~3次。將得到的沉淀分散于水中,調節pH 8.0,冷凍干燥即為11S。
1.2.3巰基肽的制備
用8 mol/L尿素溶液溶解5% 11S,加入30 mmol/L DTT,40 ℃還原1~2 h,還原完后調節pH 2.0,用pH 2.0的水進行透析2~3 d,期間換水8~10次,即得還原11S。
以還原/未還原的11S為原料,經循環水浴調節溫度至37 ℃后預熱攪拌15 min,調pH至2.0。分別加入胃蛋白酶(E/S=2%)進行恒溫酶解,酶解過程中不斷攪拌,用標準鹽酸維持pH值恒定。酶解6 h,然后95 ℃水浴滅酶5 min,離心取上清,凍干即得水解物RHP/HP。
參考DING[13]取還原后的水解物RHP,經巰丙基-瓊脂糖 6B富集巰基肽,經C18柱純化分離出含巰基的肽段EP。
1.2.4蒜素和巰基肽結合物的制備
配制一定濃度的含大豆蛋白源巰基肽的水溶液,調節pH為2.0、3.0、4.0、7.0、8.0,固定反應溫度4、15、24、40 ℃,控制巰基肽的巰基含量恒定,添加不同量的蒜素水溶液,使最終反應蒜素和巰基濃度摩爾比為0、0.125、0.5、0.75、1、1.25、1.5,控制反應時間0、5、15、30、60、120 min,測定反應過程巰基含量的變化。同時設置空白對照,即不加蒜素溶液,以扣除巰基氧化對巰基含量的損失。制備過程如圖1。反應完成率按式(1)計算。

(1)
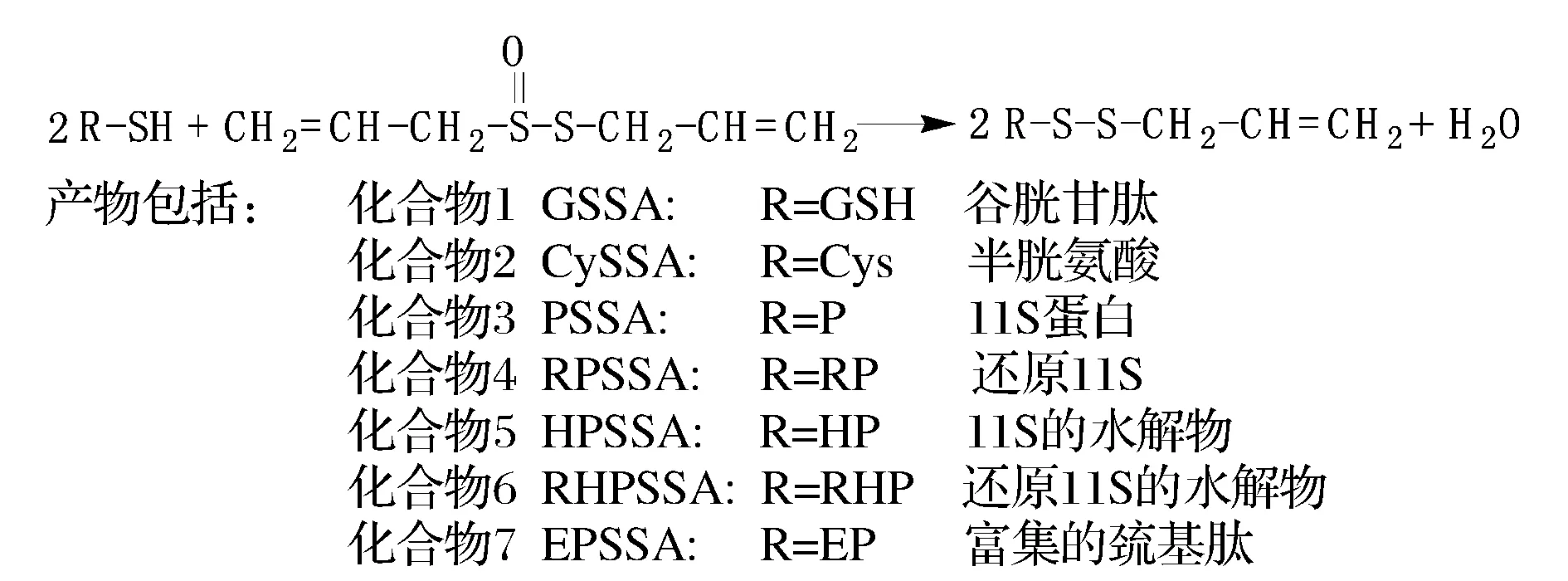
圖1 蒜素與巰基的制備Fig.1 Preparation of conjugates between allicin and thiols
1.2.5巰基含量的測定
參照RIENER等[14]的方法采用DPS法測定酶解物巰基含量,配制一定濃度的樣品,取0.2 mL,加入2.8 mL含有6 mol/L GuHCl,1 mmol/L EDTA的100 mmol/L pH 4.5 醋酸-醋酸鈉緩沖液,加入125 μL的4 mmol/L DPS,室溫反應30 min,測定A324。
1.2.6液相色譜條件
色譜柱:Agilent ZORBAX SB-C18(150 mm×4.6 mm,5 μm);柱溫:35 ℃;紫外檢測器檢測波長:214 nm;流動相A:超純水(含TFA體積分數為0.1%),流動相B:純乙腈(含TFA體積分數為0.1%)。流速設為1 mL/min,采用梯度洗脫:初始95% A;0~60 min,線性變換為40% A;60~65 min,線性變換為0%A;65~70 min,線性變換為95% A;70~75 min,維持95% A。流速:1 mL/min;進樣量:20 μL。
1.2.7質譜分析
電噴霧離子化源,離子方式 ES+,毛細管電壓 3.50 kV,錐孔電壓20 V,離子源溫度 110 ℃,脫溶劑氣溫度 400 ℃,碰撞能量 20 eV,質量范圍 50~1 000 m/z,脫溶劑氣流速 500 L/h。
1.2.8核磁共振(NMR)分析
取蒜素純樣品溶于氘代三氯甲烷,30 ℃ 下進行1H-NMR、13C-NMR 結構鑒定。實驗儀器采用 Varian INOVA-600(600 MHz and 150 MHz,美國 Varian 公司)和AV-300(300 MHz和 75 MHz,瑞士 Bruker 公司)核磁儀。
1.3數據統計分析
研究中,所有實驗均重復3 次以上,實驗數據用(均數±標準差)表示,采用Excel 2007 作圖。
2 結果與討論
2.1TS(蒜素)的表征
分別采取HPLC、ESI-MS-MS、1H-NMR、13C-NMR驗證了所制得蒜素的結構與純度。其中,電噴霧離子化質譜離子碎片結果見圖2。
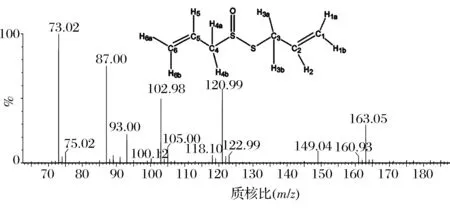
圖2 蒜素的離子碎片Fig.2 Ion fragments of allicin
蒜素的分子式為C6H10OS2,分子質量為162,它在質譜圖中它的基準峰是m/z 163.05 [M+H]+,與此同時還有一系列的特征離子碎片產生。主要特征離子碎片有m/z 120.99 [M-C3H5]+,102.98 [M-C3H7O]+,87.00 [M-C2H3OS]-,73 [M-C3H5OS]+。
HPLC結果如圖3,峰面積結果表明蒜素純度大于97%。
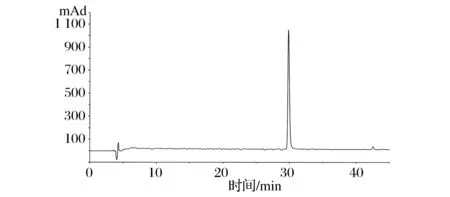
圖3 蒜素的HPLC譜圖Fig.3 The HPLC spectrum of allicin
此外,對TS進行了1H-NMR、13C-NMR表征,結果如下:
1H-NMR (400MHz, CDCl3, δ/ppm):δ3.7~3.9(4H, m,H4a、H4b、H3a、H3b);δ5.2~5.5(4H, m, H1a、H1b、H6a、H6b); δ5.85~6.65(2H, m,H2&H5)。
13C-NMR (100 MHz, CDCl3, δ/ppm):35.02 (C3, SCH2CH), 59.84 (C4, CHCH2SO), 119.05 (C1, CHCH2), 124.02 (C6, CH2CH), 125.82 (C2, CH2CHCH2), 132.90 (C5, CH2CHCH2)。
2.2反應溫度對巰基與TS反應的影響
配制一定濃度11S、RP、EP水溶液,固定反應pH 7.0,分別控制溫度在4、15、24、40 ℃下反應,反應比例為TS和巰基濃度比為理論摩爾比1∶2,反應一定時間,測定反應體系中剩余的巰基含量,同時設置空白對照,即不加TS,以扣除巰基氧化對巰基含量的損失。測定反應前后巰基含量變化。
如圖4-A、圖4-C、圖4-D分別為不同溫度下11S、RP、EP與蒜素反應的完成率,可以看出,1h內,24 ℃和40 ℃下反應基本完成,而4 ℃和15 ℃仍在進行,反應隨著溫度的上升,進行的速度和程度均增大。相比40 ℃,24 ℃反應比其慢,但是反應60min,二者反應程度相當。考慮到40 ℃溫度過高,對巰基和TS 的穩定性均不利,因此,最佳反應溫度為常溫24 ℃。
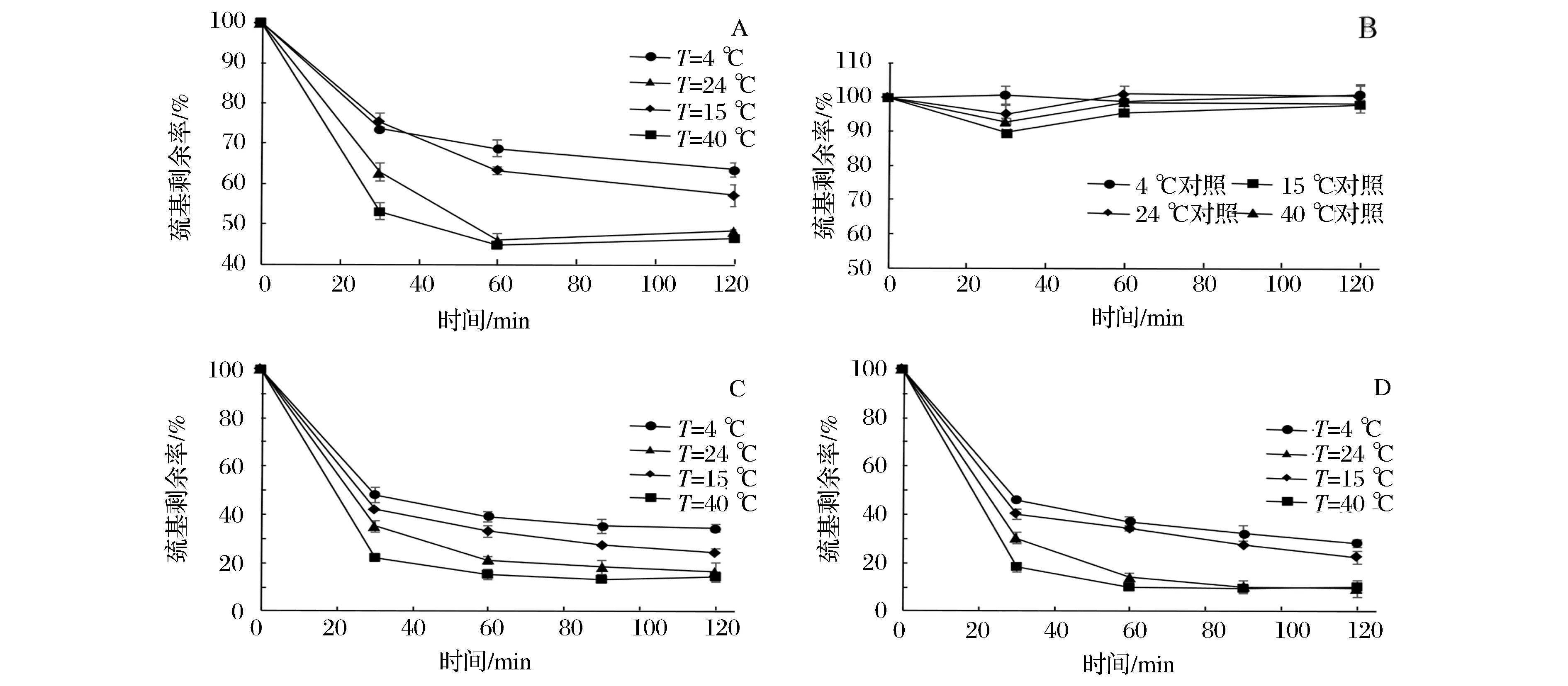
圖4 溫度對巰基與蒜素反應的影響Fig.4 Effect of different temperatures on reaction between 11S and allicin
其次,經過還原處理的RP和EP在相同條件下,反應完成率比11S大得多。如圖圖4-B為不同溫度下11S與蒜素反應的空白對照,即不添加TS反應時11S自身氧化產生的巰基損失。圖4中可以看出,在反應時間范圍內,各溫度條件下巰基損失很小。
2.3pH值和反應時間對巰基與TS反應的影響
大豆球蛋白(11S)富含半胱氨酸殘基,來源廣泛,后續巰基肽均由其還原/水解制備得到,因此選用11S作為巰基來源代表,與TS進行反應以研究不同因素的影響。11S等電點在5~6之間,因此選取pH范圍為2.0、3.0、4.0、7.0、8.0,固定反應溫度24 ℃,反應TS和巰基濃度比為理論摩爾比1∶2,分別反應0、5、15、30、60、120 min,測定反應體系中剩余的巰基含量,同時設置空白對照,即不加TS,以扣除巰基氧化對巰基含量的損失。
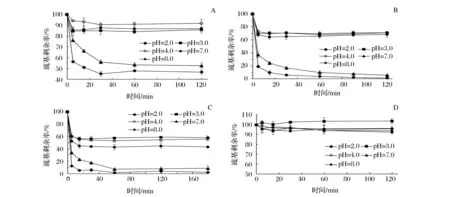
圖5 pH值對不同巰基與蒜素反應的影響Fig.5 Effect of different pH on reaction between thiols and allicin
圖5-A、圖5-B、圖5-C分別為不同pH值對大豆球蛋白11S、巰基肽EP、還原球蛋白RP與蒜素反應的影響。圖5-D為11S與蒜素反應的空白對照,即不加蒜素時巰基損失。以11S為例,從圖5-A中可以看出,相同條件下,酸性條件反應進行的速度和程度均小于堿性條件,反應完成度由小到大分別為pH 4.0<2.0<3.0<7.0<8.0。可能是因為更接近等電點,蛋白質聚集程度大,不利于反應的進行。
而堿性條件下巰基-二硫鍵交換反應更易進行,因此反應速度和完成率均大于酸性條件。這是因為蒜素與巰基化合物反應的過程中,巰基鍵能較弱,容易失去 H,同時大蒜素中的亞砜基又極易捕捉 H,因此大蒜素中的-S(O)S-鍵極易與巰基中的 H 結合,生成新物質。而堿性條件下,-S(O)S-鍵更易發生斷裂,同時巰基中S2-的pka值更大,濃度更高,更易攻擊硫代亞磺酸基團。
其次,理論上pH 8.0條件下巰基更容易氧化和交換,7.0下反應速度和完成率已經接近pH 8.0,且7.0更符合水解物的貯藏pH。因此,選取pH 7.0作為反應pH。
另外,圖5-A、圖5-B、圖5-C對比可以看出,在相同條件下,未經還原的11S比經過還原的RP及EP反應完成率要小,這是因為蒜素更容易接觸到還原后蛋白的游離巰基的結果。
2.4反應時間對巰基與TS反應的影響
反應時間在60 min,反應完成率基本恒定,巰基損失很小,有利于巰基全部與TS以二硫鍵形式結合(見圖5-D)。
2.5蒜素與巰基物質摩爾濃度比對巰基與TS反應的影響
分別選取5種不同的巰基來源:11S、還原11S(RP)、11S水解物(HP)、還原11S水解物(RHP)、富集的巰基肽(EP),調節pH 7.0。控制巰基濃度相同,改變TS的添加量以控制不同的蒜素與巰基物質摩爾濃度比([TS]/[R-SH])0、0.125、0.5、0.75、1、1.25、1.5,在24 ℃下進行反應60 min;測定反應體系中剩余的巰基含量。
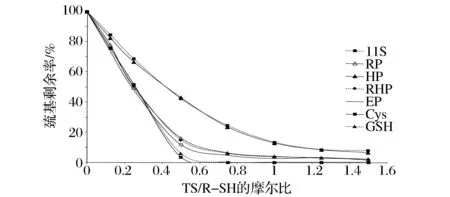
圖6 不同蒜素和巰基比例下對不同巰基來源與蒜素反應的影響Fig.6 Effect of different ratios of TS/R-SH on reaction of different sourcing of peptides
圖6可以看出,隨著[TS]/[R-SH]摩爾比增加,反應完成率逐漸增加,其中Cys和GSH作為最簡單的巰基來源之一,與蒜素反應呈直線形式,嚴格按照摩爾濃度比[TS]/[R-SH]=1∶2進行。其余巰基來源主要區分為還原和未還原,未還原的11S及其水解物HP在[TS]/[R-SH]摩爾比=5∶4時,各種巰基均能很完全地與TS 反應,因此[TS]/[R-SH]=5∶4是最佳比例;還原的11S即RP及其水解產物RHP和巰基肽EP基本在[TS]/[R-SH]摩爾比=1∶1時能達到最大完成度。顯然,增加蒜素的比例,有助于蒜素攻擊巰基,從而在相同條件達到更大的完成率。
2.6不同巰基來源對巰基與TS反應的影響
經過還原后的蛋白RP因為其疏水結構被打開,巰基暴露出來,相比未還原的11S,相同比例的TS,在pH 7.0下,反應1h,明顯RP反應完成度更大(見圖6)。原因是因為還原后,TS更容易接觸到游離巰基。
而相比RP,被水解后的RP即RHP,因其肽段更小,理論上在相同的[TS]/[R-SH]下,巰基過量時,其反應完成度可能會大些,從圖6可以看出,RHP與TS反應的完成率在各個比例下比RP大,卻并不顯著。可能是因為實驗本身是固定相同巰基濃度,而水解后對于巰基與TS的反應影響不大,因為還原后巰基很容易與TS反應,5 min后,在pH 7.0時反應的完成度已經很接近最終完成度(見圖5)。
其次,在低TS濃度下,大致表現出[TS]/[R-SH]摩爾比接近于1∶2,說明在最佳條件下,就還原的巰基來源,包括RP、RHP、EP,其反應完成率差異不大。
綜上,得出蒜素與巰基反應的最佳條件為:反應溫度24 ℃,反應pH 7.0,反應比例蒜素∶巰基(摩爾濃度比)=5∶4,反應時間1 h。
2.7蒜素與巰基二硫鍵結合物的表征
2.7.1半胱氨酸與蒜素反應的表征
如上述結果,配制一定濃度的Cys水溶液和TS水溶液,在最佳條件下反應1 h,反應結束用二氯甲烷洗滌殘余未反應TS兩遍,用氮氣吹去殘余二氯甲烷,進液相,結果見圖7。
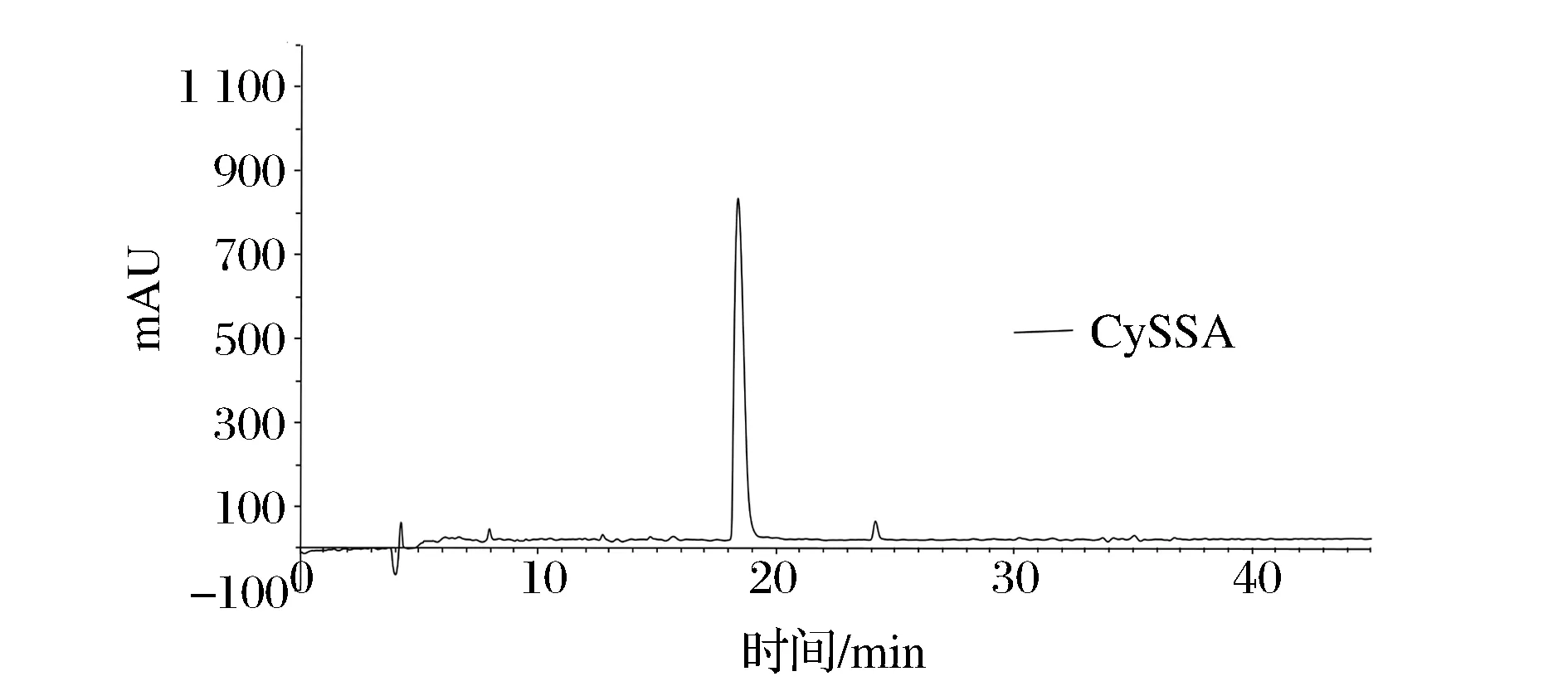
圖7 CySSA的HPLC譜圖Fig.7 The HPLC spectrum of CySSA
如圖8所示,所制得CySSA純度>97%,理論分子質量為193,對應的質譜結果基準峰為m/z=194.06 [M+H]+,與文獻一致[8]。即所得產物為CySSA。

圖8 CySSA的離子碎片Fig.8 Ion fragments of CySSA
2.7.2巰基肽(EP)與蒜素反應的表征
按最佳反應條件使EP與TS反應,制備EPSSA,并用二氯甲烷洗滌兩遍除去殘余TS,得到無TS的EPSSA-D,進液相,圖9為EP反應前后的液相色譜圖。
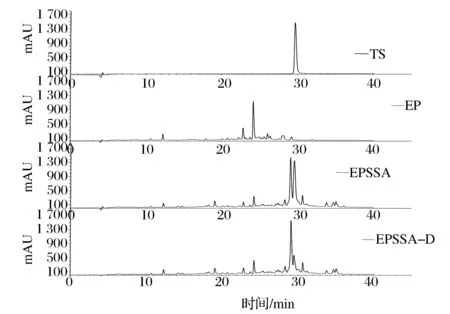
圖9 巰基肽與蒜素反應前后的HPLC譜圖Fig.9 The HPLC spectrum of reaction between EP and allicin
巰基肽EP實質上是許多含有巰基的多肽片段,所以C18分離出許多極性不同的肽段,與TS反應后,由于烯丙基基團與多肽以二硫鍵形式結合,疏水性增大,表現為峰形整體右移,如圖9所示。經二氯甲烷處理后,殘余TS消失,而峰形整體無變化,說明EPSSA的疏水分布并未受二氯甲烷影響。
3 結論
制備大豆11S蛋白及其還原和水解產物,得到了一系列含巰基的多肽,制備了蒜素,研究了反應pH、反應時間、反應溫度、反應蒜素和巰基比例、不同巰基來源對巰基與蒜素反應的影響。結果表明,在反應pH 7.0,反應溫度24 ℃,蒜素∶巰基摩爾濃度比=5∶4,反應時間1 h條件下最佳,巰基反應完成度均達到95%以上。此外,對反應前后的巰基及其二硫鍵結合產物進行了一定表征,結果顯示,結合后疏水性增加,液相峰形整體右移。
[1]GALEONE C, PELUCCHI C, LEVI F, et al. Onion and garlic use and human cancer [J]. The American Journal of Clinical Nutrition, 2006, 84(5):1 027-1 032.
[2]ROSE P, WHITEMAN M, MOORE P K, et al. Bioactive S-alk (en) yl cysteine sulfoxide metabolites in the genus Allium:the chemistry of potential therapeutic agents [J]. Natural Product Reports, 2005, 22(3):351-68.
[3]STOLL A, SEEBECK E. Chemical investigations on alliin, the specific principle of garlic [J]. Advances in Enzymology and Related Areas of Molecular Biology, 2006,11:377-400.
[4]CHEN C, PUNG D, LEONG V, et al. Induction of detoxifying enzymes by garlic organosulfur compounds through transcription factor Nrf2:effect of chemical structure and stress signals [J]. Free Radical Biology and Medicine, 2004, 37(10):1 578-1 590.
[5]BRODNITZ M H, PASCALE J V, VAN DERSLICE L. Flavor components of garlic extract [J]. Journal of Agricultural and Food Chemistry, 1971, 19(2):273-275.
[6]王金艷. 大豆球蛋白酶解物的抗氧化性及巰基肽的制備 [D].無錫:江南大學, 2014.
[7]MIRON T, LISTOWSKY I, WILCHEK M. Reaction mechanisms of allicin and allyl-mixed disulfides with proteins and small thiol molecules [J]. European Journal of Medicinal Chemistry, 2010, 45(5):1 912-1 918.
[8]ZHANG G, PARKIN K L. A tissue homogenate method to prepare gram-scale Allium thiosulfinates and their disulfide conjugates with cysteine and glutathione [J]. Journal of Agricultural and Food Chemistry, 2013, 61(12):3 030-3 038.
[9]PEDRAZA-CHAVERRJ, BARRERA D, MALDONADO P D, et al. S-allylmercaptocysteine scavenges hydroxyl radical and singlet oxygeninvitroand attenuates gentamicin-induced oxidative and nitrosative stress and renal damageinvivo[J]. BMC Pharmacology and Toxicology, 2004, 4(1):5.
[10]RABINKOV A, MIRON T, MIRELMAN D, et al. S-Allylmercaptoglutathione:the reaction product of allicin with glutathione possesses SH-modifying and antioxidant properties [J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2000, 1 499(1):144-53.
[11]CORBI P P, MASSABNI A C, MOREIRA A G, et al. Synthesis, characterization, and biological activity of a new palladium (II) complex with deoxyalliin [J]. Canadian Journal of Chemistry, 2005, 83(2):104-109.
[12]YU T H, WU C M, ROSEN R T, et al. Volatile compounds generated from thermal degradation of alliin and deoxyalliin in an aqueous solution [J]. Annals of the New York Academy of Sciences, 1994,1 187(1):370-402.
[13]DING X, HUA Y, CHEN Y, et al. Heavy metal complexation of thiol-containing peptides from soy glycinin hydrolysates [J]. Int J Mol Sci, 2015, 16(4):8 040-8 058.
[14]RIENER C K, KADA G, GRUBER H J. Quick measurement of protein sulfhydryls with Ellman's reagent and with 4,4'-dithiodipyridine [J]. Analytical and Bioanalytical Chemistry, 2002, 373(4/5):266-276.
Preparation and characterization of conjugates of allicin and thiol-containing peptides from soy protein
CHEN Hai-qiao, ZHANG Cai-meng, HUA Yu-fei, KONG Xiang-zhen*
(School of Food Science, Jiangnan University, Wuxi 214122, China)
The disulfide-bonded conjugation between allicin and cysteine residues from glutathione, peptides and proteins is considered as the first step to play allicin’s physiological activitiesinvivo. Allicin and thiol-containing peptides in vitro are unstable, thus conjugating allicin with thiols is beneficial to exert both of their physiological activities. This paper studies the influence of reaction conditions on the conjugation of allicin and thiol-containing peptides. The results showed that pH 7.0, 24 ℃, the reaction ratio of allicin∶thiols = 5∶4 and reaction time of 1h were the optimal conditions, with a completion rate being more than 95%. Besides, compared with the unreduced protein, the reduced protein or peptides gained a greater degree of completion. Under these conditions, several corresponding products were prepared, and characterized by HPLC and MS-MS, which proves the structure of the conjugates.
garlic; thiol containing peptides; preparation; characterization
10.13995/j.cnki.11-1802/ts.201608014
碩士研究生(孔祥珍副教授為通訊作者,E-mail:xzkong@jiangnan.edu.cn)。
國家自然科學基金(31201380)
2015-12-,10改回日期:2016-01-15

