鈦酸納米管形成過程中不同水熱反應階段產物表征及其對Cd(Ⅱ)吸附的特性研究
蔡斌 王婷
?
鈦酸納米管形成過程中不同水熱反應階段產物表征及其對Cd(Ⅱ)吸附的特性研究
蔡斌1,2王婷2,?
1. 北京大學深圳研究生院環境與能源學院, 深圳 518055; 2. 北京大學環境工程系, 水沙教育部重點實驗室, 北京 100871; ? 通信作者, E-mail: wang_ting@pku.edu.cn
在以 P25 二氧化鈦為鈦源, 水熱反應時間為1, 2, 3, 4天條件下, 合成鈦酸納米管(TNTs)形成過程中的4種產物, 采用XRD, SAXS和N2吸附/脫附等溫線等手段進行表征。以Cd(Ⅱ)為代表污染物, 研究4種產物對Cd(Ⅱ)的吸附, 并著重分析4種產物的結構對其吸附能力的影響。粉末XRD結果表明, TNTs的4種產物均為單斜晶胞結構。SAXS 和 N2吸附/脫附表征證實, 水熱法制備 TNTs 經歷二氧化鈦源結構解體→鈦酸納米管形成→管狀結構解體的過程, TNTs-3d 具有最為規整的管狀形貌。吸附等溫線結果表明, Langmuir-Freundlich模型能夠更好地擬合吸附等溫結果, 且 Cd(Ⅱ)的吸附量大小順序為 TNTs-3d ≈ TNTs-1d > TNTs-4d > TNTs-2d。進一步的分析表明, 樣品的回轉半徑、孔體積對吸附量影響較小, 而比表面積和平均孔徑可能會顯著影響吸附容量。
鈦酸納米管; SAXS; 吸附; Langmuir-Freundlich模型
鈦酸納米管作為一種新型的納米材料, 具有制備方法簡單、管徑均一、比表面積和孔體積較大、表面帶電性、離子交換能力強等優點, 在重金屬吸附領域有較大的研究價值與應用潛力[1]。
Kasuga等[2–3]以銳鈦礦(TiO2)為鈦源, 首次通過水熱反應制備出鈦酸納米管。在 110oC條件下, 水熱反應 20 小時, 得到的鈦酸納米管外徑為 8 nm, 長 100 nm, 比表面積高達 400 m2/g。Chen 等[4]在此基礎上進行更加深入的研究, 發現在 130oC、72小時條件下, 水熱反應得到的鈦酸納米管為多壁結構, 層間距為 0.78 nm, 外徑為 9 nm, 管長為 100 nm 至數百納米不等。對其進行成分分析發現, 鈦酸納米管化學組成為(H, Na)2Ti3O7·xH2O, 組成納米管的最小單元是H2Ti3O7的單斜晶形, 晶胞參數為=1.603 nm,= 0.375 nm,=0.919 nm,= 101.45o。Wang 等[5]用 P25 與 10 mol/L 的 NaOH溶液也制得吸附性能良好的鈦酸納米管。Yao等[6]采用TEM表征, 發現水熱法合成的鈦酸納米管是末端開口的多壁結構, 與多壁碳納米管不同, 鈦酸納米管的管壁不是無縫結構。TiO2原料在高濃度堿液中以單層 TiO2薄片的形式剝離下來, 進一步卷曲形成鈦酸納米管。
鈦酸納米管表面具有大量可交換的羥基基團, 并且其零電荷點(point of zero charge, PZC)較低, pH>pHPZC時, 其表面帶負電, 可通過離子交換和靜電引力有效地吸附溶液中的陽離子。由于其較大的吸附速度與較強的吸附能力, 鈦酸納米管越來越多地用作吸附劑, 以去除廢水中的 Pb2+, Cd2+, Cu2+, Cr3+等離子。但是, 已有的研究大多關注金屬離子的單一[5, 7–11]或者競爭吸附[10]以及吸附機理的闡述, 少有研究從鈦酸納米管形貌結構上揭示影響吸附能力的關鍵因素。
本文以 P25 二氧化鈦為原料, 在鈦酸納米管(titanate nanotubes, TNTs)水熱反應過程中制備一系列過程產物, 并對其進行 XRD, SAXS 和 N2吸附/脫附等表征。以 Cd(Ⅱ)為代表污染物, 研究其吸附行為。研究結果對于深入揭示影響TNTs吸附能力的關鍵因素, 優化TNTs的合成條件有重要意義。
1 材料與方法
1.1 不同水熱時間TNTs的制備及表征
將1.20 g P25 TiO2和29.04 g NaOH固體加入66 mL去離子水中, 室溫下磁力攪拌24小時后, 轉移到 100 mL 聚四氟乙烯內襯的反應釜中, 在130oC條件下進行水熱反應。生成的白色固體用去離子水洗滌至上清液為中性, 無水乙醇分散, 烘干, 研細待用。改變水熱反應時間分別為1, 2, 3, 4 天, 以制備 TNTs 不同形成階段的產物, 分別標記為TNTs-1d, TNTs-2d, TNTs-3d, TNTs-4d。
TNTs不同階段產物的晶型結構采用常規粉末X 射線衍射(XRD, Rigaku, 日本)與 X 射線小角散射(SAXS)進行表征。XRD掃描范圍(2)為 10°~70°,掃描速度為 4°/min, 狹縫寬 0.3 mm。SAXS掃描范圍(2)為 0.6°~20°, 掃描速度為 2°/min, 狹縫寬0.15 mm。TNTs的比表面積和孔徑分布采用比表面積及孔隙度分析儀(ASAP 2010, Micromeritics, 美國)進行檢測。
1.2 靜態吸附實驗
以 Cd(Ⅱ)為代表污染物, 研究不同水熱時間下制備的TNTs的吸附能力及影響因素。配制濃度為1000 mg/L的Cd(Ⅱ)儲備液, 稀釋, 待用。
在一系列100 mL的錐形瓶中, 加入50 mL初始濃度分別為 10, 20, 30, 40, 60, 80, 100 mg/L 的Cd(Ⅱ)溶液。用0.01 mol/L的HCl或NaOH溶液, 調節初始pH值在5~6之間。向每個錐形瓶中分別投加10.0 mg (0.2 g/L) TNTs, 在25 °C, 200 rpm下充分振蕩 3 小時以達到吸附平衡, 進行吸附等溫實驗。取初始樣和平衡樣, 用0.45 μm水系濾膜過濾, 稀釋, 用電感耦合等離子體–原子發射光譜儀(Leeman, Prodigy, 美國)測定Cd(Ⅱ)的濃度。
Cd(Ⅱ)在樣品上的吸附量由下式計算得到:
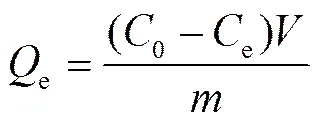
式中,e為平衡吸附量(mg/g),0和e為吸附初始和平衡時溶液中Cd(Ⅱ)的濃度(mg/L) ,為溶液體積(L),為吸附劑的質量(g)。
2 結果與討論
2.1 XRD表征
圖 1 為樣品的 XRD 結果。可以明顯看出, 在2= 9.5°處, 除P25二氧化鈦以外, 所有樣品均出現明顯的衍射峰, 該峰為 TNTs 的層間距峰[12–13]。圖1中, 位于 2= 24.32°, 28.36° 和48.36°(表1)處的峰為鈦酸鈉的特征峰。這表明, 參與合成反應的Na+起到穩定納米管結構的作用[14–15]。這4個衍射峰是一種單斜晶形鈦酸鹽晶體的特征峰, 化學組成為(Na, H)2Ti3O7nH2O[4]。與之相比, 二氧化鈦(P25)在 2= 25.4°, 37°~39°處出現銳鈦型衍射峰, 在 2= 27.5°處出現金紅石型衍射峰, 這些峰在合成的樣品中并沒有出現, 說明在合成的 TNTs 階段產物中, 無殘留的二氧化鈦存在。
圖 1 中的衍射峰均與 H2Ti3O7單斜晶形的特征峰相近或相同。已有報道也證實 TiO2粉末與NaOH 溶液水熱反應后得到的產物為單斜晶形[16]。基于此, 表1列出依據X射線衍射特征峰的分析結果。晶胞參數為= 1.603 nm,= 0.375 nm,= 0.919 nm,= 101.45°[4]。具體而言, 它的結構是由共用棱的TiO6八面體以類似波紋絲帶的方式銜接而成。銜接時, 每 3 個八面體為一組[4], 每一組八面體間以頂點相互連接, 形成臺階狀的分子層, 層與層之間被填充著的 Na+和 H+分隔開。因此, 其分子式可以簡單地認為是(Na, H)2Ti3O7。
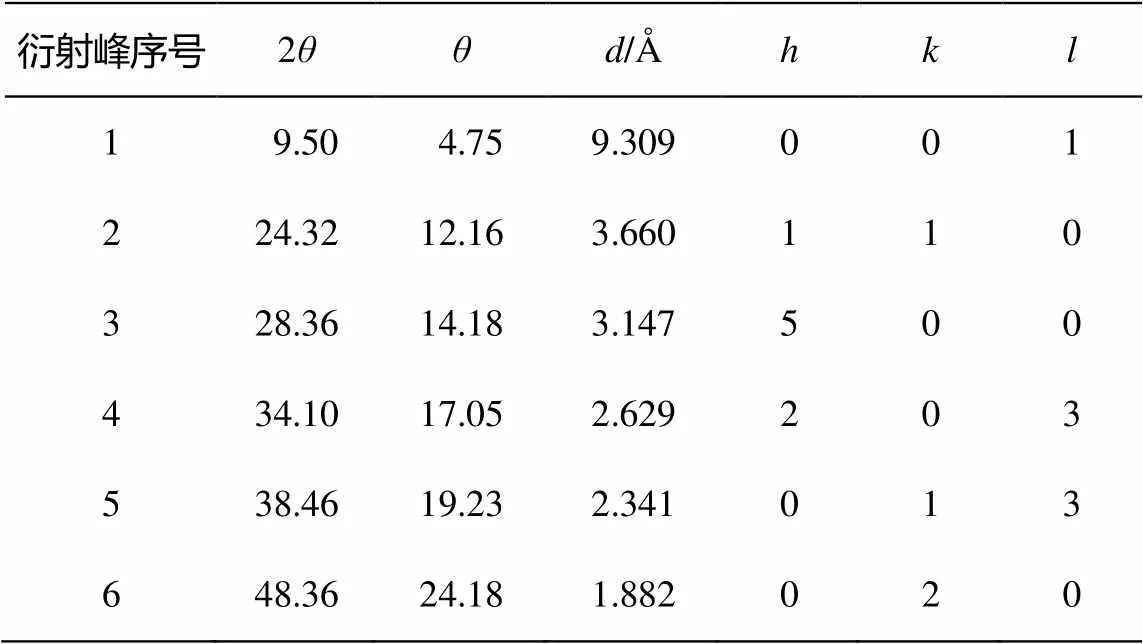
表1 TNTs系列樣品的X射線衍射分析結果
2.2 SAXS表征研究
圖 2 為樣品的 SAXS 結果。SAXS 的結果是基于被測材料各原子中的電子對 X 射線的衍射和散射的疊加。被測材料中的電子密度和 X 射線散射測試結果中的峰值幅度之間的關系[17]如下:
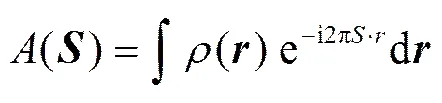
X射線散射結果中的強度用材料中電子衍射和散射后的電磁波的振幅與它的共軛復數的乘積來計算。在形狀和大小相近或相同的分散顆粒(或孔)體系中, SAXS的強度表達式[17]可簡化為
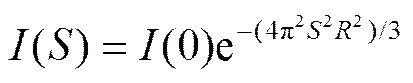
式(3)被稱為 Guinier 公式。其中為顆粒的回轉半徑,(0)為= 0 時的衍射強度。考慮到在 2角度較小時(25°),2, 式(3)可轉換為下式[17]:
。 (4)
取對數, 得到下式[17]:
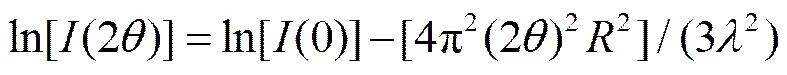
式(5)表明, 若體系嚴格遵循 Guinier 法則, 那么ln[(2)]與(2)2之間將線性相關。SAXS 計算結果見表 2。ln[(2q)]與2相關系數均大于 0.95, 說明體系嚴格遵循Guinier法則。同時, P25和TNTs階段產物的回轉半徑的平方均為幾百?2, 回轉半徑值大多在 15 ?左右, 這表明樣品的介觀結構可能沒有任何變化。另一方面, TNTs系列樣品的平均回轉半徑是 15.85 ?, 略小于 P25 的 16.81 ?。據此可以認為, 在水熱合成反應的過程中, 發生了一些結構上的轉變。
從表2還可以看出, TNTs-1d的回轉半徑(16.92 ?)與P25(16.81 ?)十分接近, 而與TNTs-2d的回轉半徑(13.35 ?)差距較大, 據此推斷TNTs-1d 與 P25的介觀結構較相近。即, TNTs-1d 中包含一部分尚未開始解體的P25結構和少量解體后形成的納米級碎片, TNTs-2d 中 P25 則接近完全解體, 并開始重組為鈦酸納米管。TNTs-3d的回轉半徑(15.85 ?)較之TNTs-2d又有所上升, 且與TNTs-4d接近, 表明兩者鈦酸納米管含量進一步增加。
2.3 比表面積與孔徑分布分析
TNTs-1d, TNTs-2d, TNTs-3d和TNTs-4d這 4種階段產物以及二氧化鈦(P25)的比表面積、孔徑分布和孔體積等由 N2吸附/脫附等溫線獲得。各種材料的比表面積等性能數據如表3所示。
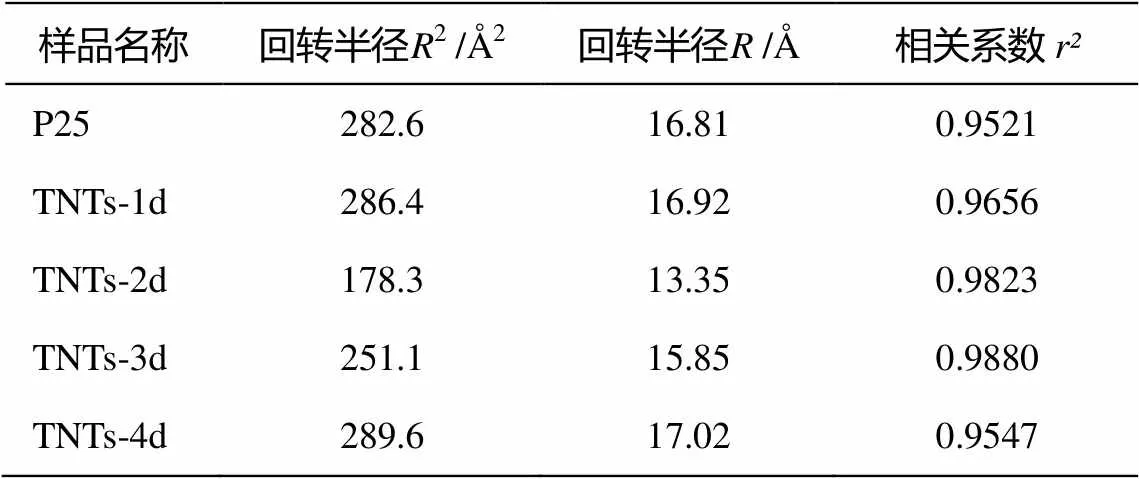
表2 TNTs系列樣品的小角X射線散射分析結果
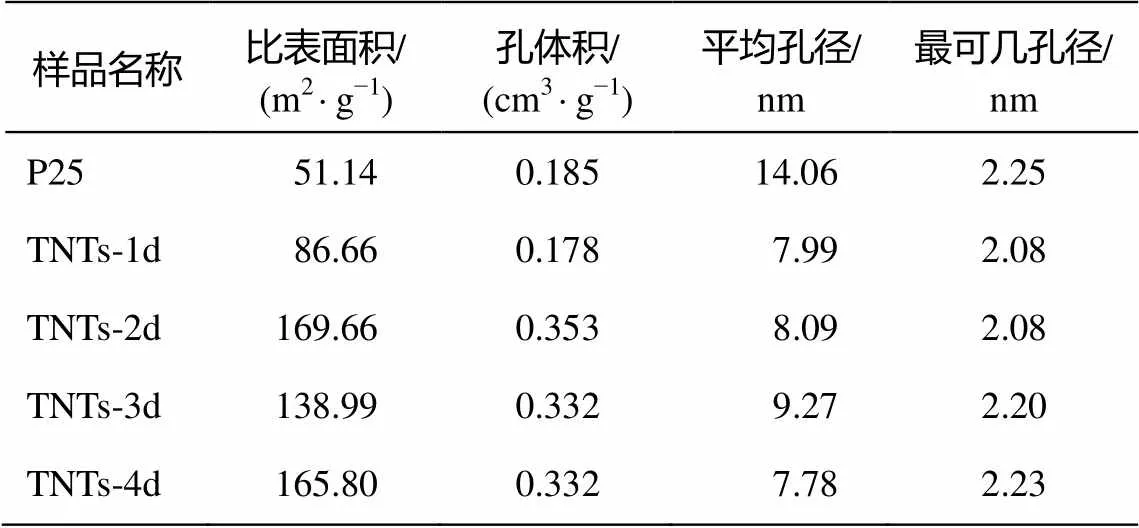
表3 幾種TNTs階段產物的比表面積與孔徑分布
從表 3 可以看出, TNTs-2d, TNTs-3d和 TNTs-4d 的比表面積及孔體積比較接近, 而與 TNTs-1d和 P25 差距較大。P25 的比表面積為 51.14 m2/g, TNTs- 1d較P25有明顯的增加, 為86.66 m2/g, 而TNTs-2d, TNTs-3d和TNTs-4d的比表面積均在100 m2/g以上。孔體積方面, P25與TNTs-1d比較接近, 約為0.18 cm/g左右; TNTs-2d, TNTs-3d和TNTs-4d的孔體積為 0.33~0.35 cm3/g。P25 的平均孔徑為14.06 nm, 而 TNTs 系列樣品相比之下, 平均孔徑都明顯縮小, 為8~9 nm。4種TNTs階段產物中, TNTs-2d和TNTs-4d的比表面積最大, TNTs-3d的平均孔徑最大。
圖 3 為 P25 和 TNTs 系列樣品的孔徑分布。對比吸附支孔徑分布(圖 3(b))可以發現, 脫附支(圖3(a))TNTs系列樣品在 3~4 nm 處有一個孔徑分布峰, 是由抗拉強度效應(tensile strength effect, TSE)引起的假峰[18–19]。因此, 對于 TNTs 系列樣品, 吸附支得到的孔徑分布更準確。從圖 3(b)可知, TNTs系列樣品的最可幾孔徑均在 2~2.2 nm 范圍內。根據國際純粹與應用化學協會(IUPAC)的定義, 孔徑小于 2 nm 的稱為微孔。因此, 所有樣品的最可幾孔徑均已接近微孔范圍。同時, TNTs 系列樣品的最可幾孔徑均在 2~2.2 nm 范圍內, 且不隨水熱反應時間的增加而變化。說明在水熱反應過程中, [TiO6]八面體這一基本機構并沒有遭到破壞, 樣品結構的改變只發生在不同[TiO6]八面體的連接方式上。
從表3還可以發現, P25最可幾孔徑雖然在2.2 nm左右, 但是其平均孔徑顯著大于 TNTs 系列樣品, 說明原料P25本身并不具有太多的孔狀結構。隨著水熱反應的開始, 樣品內部發生改變, 產生大量直徑在 20 nm 以下的孔狀結構, 進而驗證了 P25樣品在水熱反應過程中發生結構解體。水熱反應48 小時的時候孔體積最大, 生成的孔狀結構最多, 此時 P25 解體最徹底。水熱反應 72 小時的時候孔體積略有減小, 這是由于此時生成一種規整有序的結構。當水熱反應達到 96 小時, 孔體積不變, 平均孔徑減小, 說明此時孔狀結構再次增加, 樣品結構再次趨向無序化, 即管狀結構開始部分解體。
2.4 Cd(Ⅱ)吸附等溫線
為深入闡述TNTs系列樣品的形貌結構對金屬離子吸附行為的影響, 圖 4 描述 TNTs 系列樣品對Cd(Ⅱ)的吸附等溫線。隨著平衡濃度的增大, Cd(Ⅱ)的吸附量逐漸增大, 最后趨于平衡。且Cd(Ⅱ)的飽和吸附量大小順序為 TNTs-1d > TNTs-3d > TNTs-4d > TNTs-2d。與多壁碳納米管(10.86 mg/g)、貝得石(42.01 mg/g)、黃土(9.37 mg/g)和活性炭(19.50 mg/g)相比, 吸附容量高出很多[9]。為了描述TNTs系列樣品對 Cd(Ⅱ)的吸附等溫線, 分別采用Langmuir模型, Freundlich模型, Langmuir-Freundlich模型進行擬合。
Langmuir吸附模型假設: 吸附劑表面均勻; 吸附質之間沒有相互作用力; 吸附為單層吸附; 吸附平衡后是動態平衡, 吸附速率與解析速率相同。公式如下:
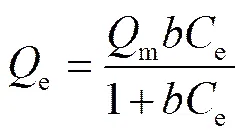
其中,e(mg/g)和e(mg/L)分別為平衡吸附量和吸附平衡時溶液中 Cd(Ⅱ)的濃度,m(mg/g)為最大單分子層吸附量,為與吸附自由能相關的常數。
Freundlich模型為經驗模型, 它假設吸附劑表面非均勻且不局限于單層吸附。公式如下:
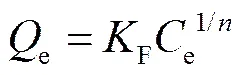
式中,F為與吸附量有關的Freundlich 常數(mg/g),為與吸附劑強度相關的異質性因子。
Langmuir-Freundlich 模型為修正模型, 公式如下:
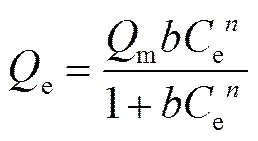
吸附等溫式對實驗數據的擬合結果如表 4 所示。三參數 Langmuir-Freundlich 模型擬合結果r>0.9, 與實驗結果更接近。從 TNTs-1d 至 TNTs-4d, 平衡吸附量分別為189.26, 154.62, 182.50和164.83 mg/g。TNTs-1d 與 TNTs-3d 具有近似相等的平衡吸附容量, 且明顯高于 TNTs-2d 和 TNTs-4d。已有研究表明, TNTs 表面存在均勻的表面活性位點, 且 Cd(Ⅱ)在 TNTs 表面的吸附為單分子層吸附[14]。本研究結果表明, 吸附到 TNTs 系列樣品上的Cd(Ⅱ)與材料之間可能存在相互作用。
從材料表征結果可知, 水熱法制備鈦酸納米管的過程經歷了二氧化鈦源結構解體→鈦酸納米管形成→鈦酸納米管解體的過程。TNTs-3d 樣品代表其中形成鈦酸納米管這一階段的樣品, 具有最為規整的形貌, 因而其平衡吸附容量最大。
2.5 吸附量與材料孔徑的關系
表 5 列出不同水熱反應時間合成的TNTs系列樣品的結構參數及對 Cd(Ⅱ)的平衡吸附量。吸附時間為Cd(Ⅱ)吸附量達到平衡吸附量 95%時所用的時間。TNTs-2d, TNTs-3d 和 TNTs-4d 在結構方面與 TNTs-1d 有比較大的差別, 因此對吸附的研究主要集中在 TNTs-2d, TNTs-3d 和 TNTs-4d 三者的相互對比上。
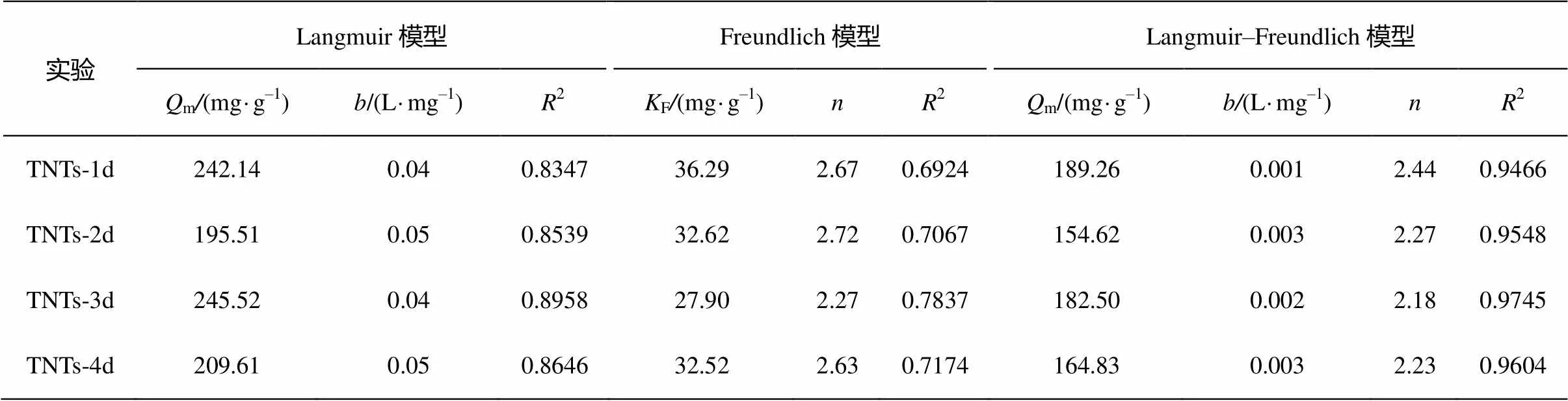
表4 TNTs系列樣品對Cd(Ⅱ)的吸附等溫線參數
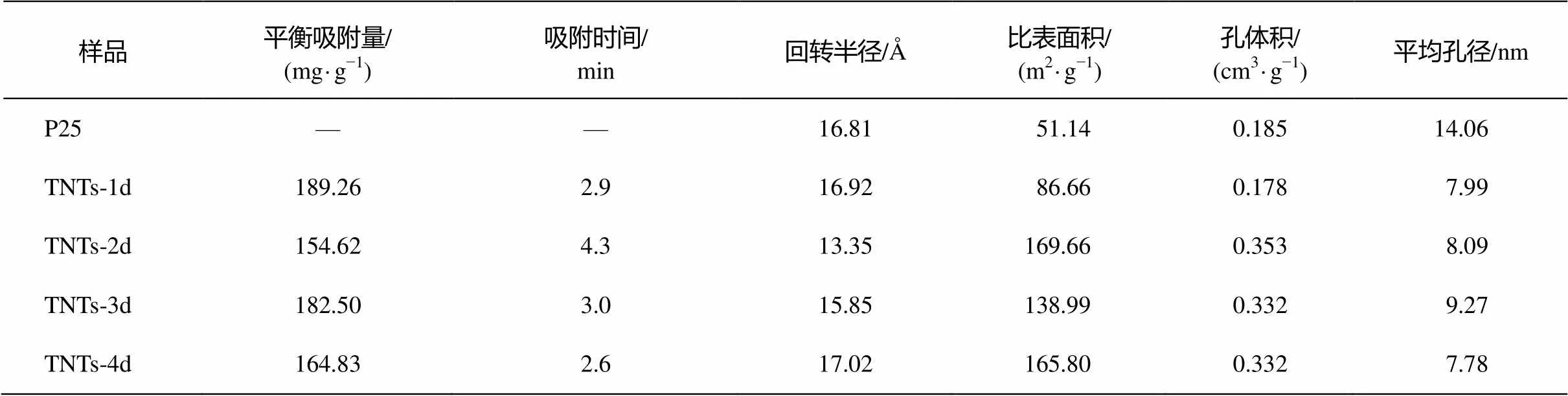
表5 TNTs系列樣品的結構參數及吸附容量
說明: 吸附時間為達到平衡吸附量95%時的時間。
從表 5 可以看出, TNTs-1d 和 TNTs-3d 對Cd(Ⅱ)的吸附量最高, TNTs-2d 與 TNTs-4d 有顯著的差別。隨著水熱反應時間的延長, TNTs系列樣品的回轉半徑逐漸增加, 吸附平衡時間逐漸縮短, 這與吸附量的變化規律不一致。因此, 樣品的回轉半徑與平衡吸附量無直接關系, 可能與平衡時間有關。
TNTs-2d, TNTs-3d 和 TNTs-4d 的孔體積均在0.33~0.35 cm3/g范圍內, 差異較小, 因此, 樣品的孔容量也與平衡吸附量無直接關系。相比之下, TNTs-3d的比表面積和平均孔徑顯著大于TNTs-2d和TNTs-4d, 這可能與樣品的吸附容量有關。
3 結論
1) 水熱時間分別為1, 2, 3, 4天, 合成了4種鈦酸納米管不同形成階段的系列產物, 粉末 XRD 表征證實均為單斜晶胞結構。
2) SAXS 和 N2吸附/脫附表征證實, 水熱法制備鈦酸納米管經歷了二氧化鈦源結構解體→鈦酸納米管形成→管狀結構解體的過程, TNTs-3d鈦酸納米管具有最為規整的管狀形貌。
3) 吸附等溫線結果表明, Langmuir-Freundlich模型能夠更好地擬合吸附等溫結果, 并且 Cd(Ⅱ)的吸附量大小順序為: TNTs-3d > TNTs-1d > TNTs-4d > TNTs-2d。
4) 樣品的回轉半徑、孔體積對吸附量影響較小, 而比表面積和平均孔徑可能會影響吸附容量。
參考文獻
[1]Chen Q, Peng L M. Structure and applications of titanate and related nanostructures. International Journal of Nanotechnology, 2007, 4(1/2): 44–63
[2]Kasuga T, Hiramatsu M, Hoson A, et al. Formation of titanium oxide nanotube. Langmuir, 1998, 14(12): 3160–3163
[3]Kasuga T, Hiramatsu M, Hoson A, et al. Titania nanotubes prepared by chemical processing. Advan-ced Materials, 1999, 11(15): 1307–1311
[4]Chen Q, Zhou W Z, Du G H, et al. Trititanate nanotubes made via a single Alkali treatment. Advanced Materials, 2002, 14(17): 1208–1211
[5]Wang T, Liu W, Xu N, et al. Adsorption and desorption of Cd(Ⅱ) onto titanate nanotubes and efficient regeneration of tubular structures // 36th International Convention on Information & Communi- cation Technology Electronics & Microelectronics (MIPRO). Opatija, 2013: 379– 386
[6]Yao B D, Chan Y F, Zhang X Y, et al. Formation mechanism of TiO2nanotubes. Applied Physics Letters, 2003, 82(2): 281–283
[7]Chen Y C, Lo S L, Kuo J. Pb(Ⅱ) adsorption capacity and behavior of titanate nanotubes made by micro-wave hydrothermal method. Colloids and Surfaces A, 2010, 361: 126–131
[8]Du A J, Sun D D, Leckie J O. Sequestration of cadmium ions using titanate nanotube.Journal of Hazardous Materials, 2011, 187: 401–406
[9]Xiong L, Chen C, Chen Q, et al. Adsorption of Pb(Ⅱ) and Cd(Ⅱ) from aqueous solutions using titanate nanotubes prepared via hydrothermal method. Journal of Hazardous Materials, 2011, 189(3): 741–748
[10]Liu W, Wang T, Alistair G L, et al. Adsorption of Pb2+, Cd2+, Cu2+and Cr3+onto titanate nanotubes: competition and effect of inorganic ions. Science of the Total Environment, 2013, 456/457: 171–180
[11]Yang D J, Sarina S, Zhu H Y, et al. Capture of radioactive cesium and iodide ions from water by using titanate nanofibers and nanotubes. Angewandte Chemie International Edition, 2011, 50(45): 10594 –10598
[12]盛國棟, 楊世通, 趙東林, 等. 靜態法和EXAFS技術研究Eu(Ⅲ)在鈦酸納米管上的吸附行為和微觀機制. 中國科學B輯: 化學, 2012, 42(1): 60–73
[13]Suetake J, Nosaka A Y, Hodouchi K, et al. Charac-teristics of titanate nanotube and the states of the confined so dium ions. Journal of Physical Chemistry C, 2008, 112(47): 18474–18482
[14]Lin K S, Cheng H W, Chen W R, et al. Synthesis, characterization, and adsorption kinetics of titania nanotubes for basic dye wastewater treatment. Adsor-ption, 2010, 16(1): 47–56
[15]Liu J L, Luo M B, Yuan Z Z, et al. Synthesis, characterization, and application of titanate nanotubes for Th(Ⅳ) adsorption.Journal of Radioanalytical and Nuclear Chemistry, 2013, 298(2): 1427–1434
[16]張月, 陳清, 龔巍巍, 等. 鈦酸鈉納米線的合成和結構. 北京大學學報: 自然科學版, 2007, 43(1): 125–131
[17]朱育平. 小角X射線散射理論、測試、計算及應用. 北京: 化學出版社, 2008
[18]Gregg S J, Sing K S W. Adsorption, surface area, and porosity. 2nd ed. London: Academic Press, 1982
[19]Groen J C, Peffer L A A, Perez-Ramirez J. Pore size determination in modified micro- and mesoporous materials, Pitfalls and limitations in gas adsorption data analysis. Microporous and Mesoporous Materials, 2003, 60: 1–17
Characterization of Titanate Products with Different Formation Stages and Adsorption Characteristics of Cd(Ⅱ)
CAI Bin1, 2, WANG Ting2,?
1. School of Environment and Energy, Peking University Shenzhen Graduate School, Shenzhen 518055; 2. Department of Environmental Engineering, Peking University, The Key Laboratory of Water and Sediment Sciences, Ministry of Education, Beijing 100871; ? Corresponding author, E-mail: wang_ting@pku.edu.cn
Series of products with different formation stages of titanate nanotubes (TNTs) are synthesized, with the hydrothermal reaction time of 1, 2, 3, 4 days. XRD, SAXS and N2adsorption/desorption have been chosen to detect the morphology and structure of various products. Afterwards, the adsorption behavior of Cd(Ⅱ) onto various products are also compared, and possible mechanism for the different adsorption capacities are detected based on their structures. XRD detection depictes that all products are monoclinic system. Results from SAXS and N2adsorption/desorption suggeste that the formation processes of TNTs are the disintegration of TiO2→the formation of titanate nanotubes→the destruction of tubular structures. Among all products, TNTs-3d displayes the best defined structure. As for Cd(Ⅱ) adsorption, Langmuir-Freundlich model can better describe the adsorption isotherm, and the adsorption capacities rank as: TNTs-3d ≈ TNTs-1d > TNTs-4d > TNTs-2d. Further detection proves that gyration radius and pore volume play little role, while BET surface area and the average pore diameter possibly affect the adsorption capacity.
titanate nanotubes; SAXS; adsorption; Langmuir-Freundlich model
10.13209/j.0479-8023.2016.108
O614; X131
2015-05-26;
2015-06-02;
網絡出版日期: 2016-11-05
深圳市科技研發資金(CXY201106290063A)資助

