丹參飲片、標準水煎劑、配方顆粒HPLC特征圖譜相關性研究
周維,胡昌江,戴德榮,張秀環,馮健
(四川新綠色藥業科技發展股份有限公司,四川 彭州 611930 )
丹參飲片、標準水煎劑、配方顆粒HPLC特征圖譜相關性研究
周維,胡昌江*,戴德榮,張秀環,馮健
(四川新綠色藥業科技發展股份有限公司,四川 彭州611930)
目的:采用高效液相色譜法對丹參飲片、標準水煎劑、配方顆粒的特征圖譜進行相關性研究,考察不同的存在形式對丹參化學成分的影響。方法:采用菲羅門luna5uC18柱(250mm×4.6mm,5μm)色譜柱,以乙腈-0.4%磷酸水溶液為流動相進行梯度洗脫;檢測波長為286nm;流速為10mL·min-1;進樣量為10μL。分別建立10批丹參飲片、10批丹參標準水煎劑、10批丹參配方顆粒的特征圖譜。結果:丹參配方顆粒HPLC特征圖譜的7個特征峰均可在飲片、標準水煎劑中得到追蹤,并從7個共有峰中指認出迷迭香酸、丹酚酸B、丹參素鈉、原兒茶醛4個成分。結論:丹參飲片、標準水煎劑、配方顆粒的主要化學成分組成基本相同。
丹參飲片;丹參標準水煎劑;丹參配方顆粒;特征圖譜
丹參為唇形科植物丹參SalviamiltiorrhizaBge.的干燥根和根莖,具有活血祛瘀、通經止痛、清心除煩、涼血消癰的功能[1],其中脂溶性成分為丹參酮類,水溶性成分為丹酚酸類[2]。丹參配方顆粒為丹參飲片經現代技術提取、濃縮、干燥、制粒等工藝制備而成,已經失去了飲片的外觀形態、顯微特性,難以直觀鑒別。如果僅用某成分的含量限度作為質量控制指標,則較難全面地判定配方顆粒的真偽與優劣。因此,需要制定出專屬性更強、重復性更強、有效可控的方法來控制丹參配方顆粒的質量。特征圖譜的研究能很好地給丹參配方顆粒的定性鑒別提供準確的依據,能夠在化學成分的層面上進行全面的鑒別[3]。丹參配方顆粒做為丹參顆粒性飲片,應與丹參飲片及其水煎液具有相同的化學成分,這三者的相關性目前尚未見報道。本研究采用HPLC法建立了丹參飲片、丹參標準水煎劑、丹參配方顆粒的特征圖譜,比較了三者化學成分的差異。
1 儀器與試藥
1.1儀器
安捷倫1200型高效液相色譜儀;電子天平BP211D(Sautoris,德國);超聲波清洗器(昆山市儀器有限公司,KQ5200DB型)。
1.2試藥
丹酚酸B、迷迭香酸(中國是食品藥品檢定研究院,批號分別為1152-200605,111871-201102);丹參素鈉(中國食品藥品檢定研究院,批號:110855-201210,含量91.2%);原兒茶醛(中國食品藥品檢定研究院,批號:110810-200506);甲醇為色譜純;水為純凈水;磷酸(HPLC級)。
10批不同來源的丹參飲片產地為山東,經成都中醫藥大學胡昌江教授鑒定為唇形科植物丹參SalviamiltiorrhizaBge.的干燥根及根莖;10批丹參標準水煎劑按照《醫療機構中藥煎藥室管理規范》中煎藥操作方法進行制備;10批丹參配方顆粒(四川新綠色藥業科技發展股份有限公司,批號分別為1312085,1312086,1312087,1304044,1405321,1404231,1411124,1501325,1504155,1507214)。
2 方法與結果
2.1色譜條件
菲羅門LunaC18(2)(250mm×4.6mm,5μm);以乙腈為流動相A,以0.4%磷酸溶液為流動相B,按表1的規定進行梯度洗脫;檢測波長為286nm;柱溫為25℃;流速為1.0mL·min-1[4-6]。

表1 梯度洗脫程序
2.2供試品溶液的制備
2.2.1丹參飲片溶液的制備 取丹參飲片50g,加水適量,煎煮1h,濾過,濾液用水定容至1000mL,即得。
2.2.2標準煎劑的制備 取丹參飲片50g,第一次加8倍水,浸泡30min,煎煮30min,濾過;第二次加6倍水,煎煮30min,濾過,合并水煎液,用水定容至1000mL,即得。
2.2.3丹參配方顆粒供試品的制備 取本品適量,研細,取約0.5g,精密稱定,置具塞錐形瓶中,精密加入水25mL,稱定重量,超聲處理(功率為250W,頻率為33kHz)30min,取出,放冷,再稱定重量,用水補足減失的重量,搖勻,濾過,取續濾液,即得。
2.3方法學考察
2.3.1精密度試驗 按照2.2.3項下方法制備丹參配方顆粒供試品溶液,連續進樣6次,每次10μL,結果7個特征峰相對保留時間的RSD為0~0.2%,相對峰面積的RSD為0~0.55%,表明儀器的精密度良好。
2.3.2穩定性試驗 按照2.2.3項下方法制備丹參配方顆粒供試品溶液,分別于0、4、8、12、24h測定,結果7個特征峰相對保留時間的RSD為0~0.53%,相對峰面積的RSD為0~0.46%,表明樣品溶液在24h內穩定。
2.3.3重復性試驗 按照2.2.3項下方法制備6份丹參配方顆粒供試品溶液,按照擬定方法測定,結果7個特征峰相對保留時間的RSD為0~0.2%,相對峰面積的RSD為0~0.83%,表明方法重復性良好。
2.4樣品的測定
精密取10批丹參飲片供試品溶液、標準水煎劑、丹參配方顆粒供試品溶液各10μL,按擬定方法測定。
2.5特征圖譜的建立
2.5.1參照峰的選擇與共有特征峰的確定 采用擬定的方法分別對10批丹參飲片、10批丹參標準水煎劑、10批丹參配方顆粒進行特征圖譜的測定,并建立了HPLC特征圖譜,見圖1~4。根據相對保留時間穩定及各批次樣品均能檢出,且峰相對較高的原則,采用中藥色譜指紋圖譜相似度評價系統(2012版)進行Mark峰匹配。共選擇了7個重復性較好的峰作為共有特征峰。通過與對照品色譜圖比較可得,7個共有特征峰當中,峰1為丹參素鈉,峰2為原兒茶醛,峰5為迷迭香酸,峰6為丹酚酸B。結果見圖5。同時選擇峰6(丹酚酸B)為參照峰。
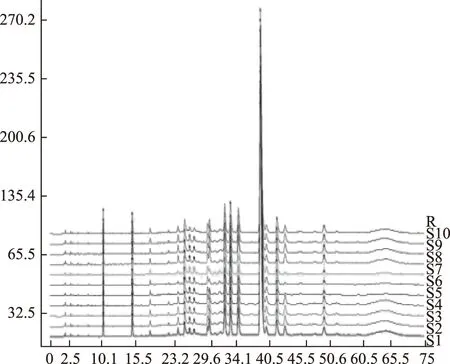
注:S1~S10為10批丹參飲片樣品;R為對照圖譜。圖1 10批丹參飲片HPLC特征圖譜
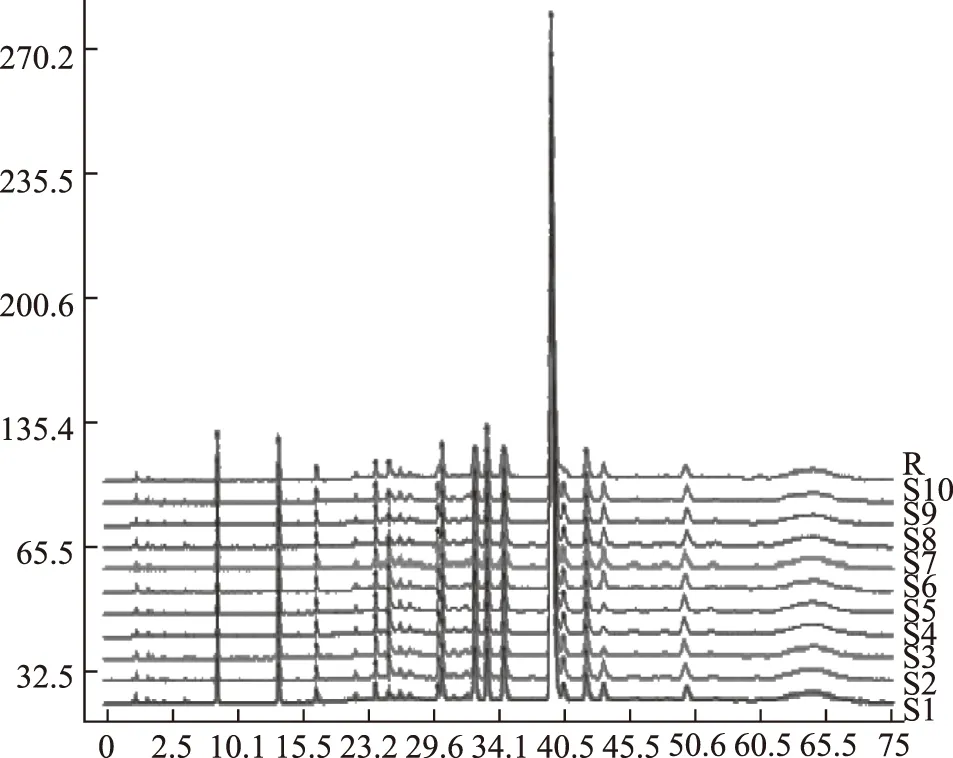
注:S1~S10為10批丹參標準水煎劑樣品;R為對照圖譜。圖2 10批丹參標準水煎液HPLC特征圖譜
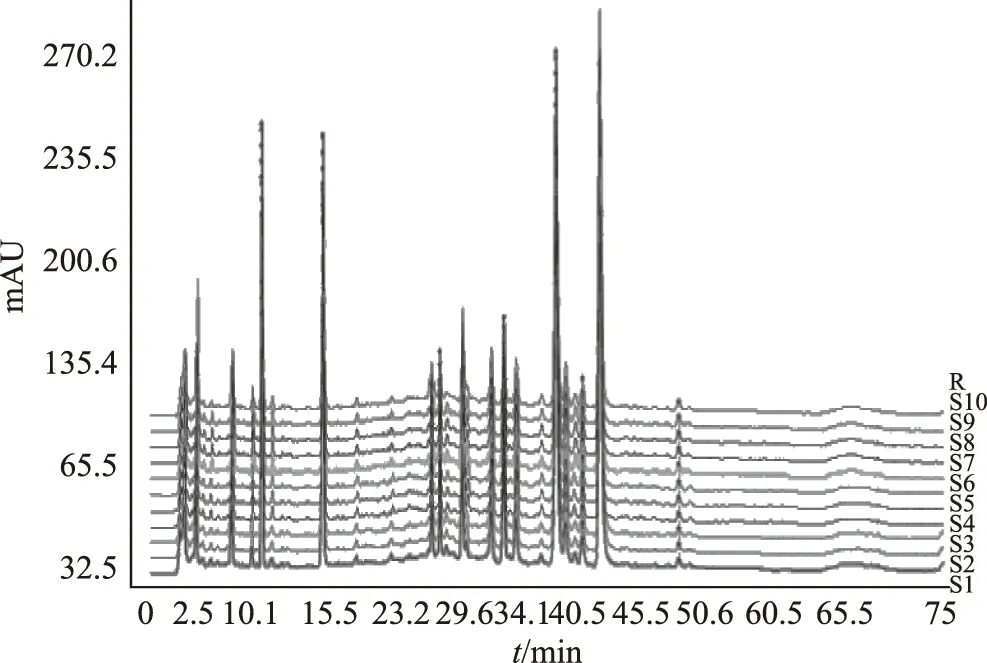
注:S1~S10為10批丹參配方顆粒樣品;R為對照圖譜。圖3 10批丹參配方顆粒HPLC特征圖譜
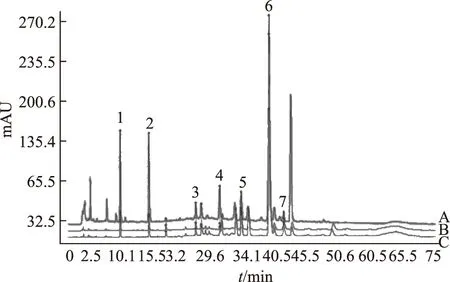
注:A.丹參配方顆粒;B.丹參標準水煎劑;C.丹參飲片。圖4 丹參飲片、標準水煎劑、配方顆粒HPLC特征圖譜比較
注:A.丹參飲片供試品溶液;B.對照品溶液;1.丹參素鈉;2.原兒茶醛;5.迷迭香酸;6.丹酚酸B。圖5 色譜峰的指認
2.5.2丹參飲片、標準水煎劑、配方顆粒相關性研究 由圖4可得,丹參配方顆粒和標準煎劑7個特征峰均能在藥材和飲片中檢出,說明這些成分都來源于藥材;同時丹參配方顆粒和標準煎劑中都能檢出7個特征峰,說明顆粒和標準煎劑的有效成分基本一致[7]。
3 討論
本方法考察了乙腈-0.4%磷酸、乙腈-0.4%冰乙酸、乙腈-0.05%磷酸3種流動性梯度洗脫的結果,其中乙腈-0.4%磷酸梯度洗脫分離條件下色譜峰多,且理論板數、分離度、對稱性均更好。同時分別比較了檢測波長為210、230、254、286、310、326nm下的色譜峰,而在286nm下的色譜峰數較多且各峰之間的分離度較好,信息量大。最終選擇乙腈-0.4%磷酸梯度洗脫作為流動性,以286nm作為檢測波長。
丹參配方顆粒的特征圖譜在10min之前的峰數多于丹參飲片和丹參標準煎劑,這部分成分還有待研究。
丹參飲片樣品、標準煎劑以及顆粒樣品都是水提制備樣品。其中丹參飲片樣品加適量水煎煮1 h是為了保證其中的水溶性成分能夠有效溶出。標準煎劑是按照國家中醫藥管理局關于印發醫療機構中藥煎藥室管理規范的通知(國中醫藥發〔2009〕3號)中第四章煎藥操作方法制備。丹參配方顆粒是以水為溶媒,經現代技術提取、濃縮、干燥、制粒等工藝制備而成。三者的制備方法有差異,但是本質上都是水溶液。
[1] 楊曉日,孫巍.中藥配方顆粒探討[J].中國藥業,2007,16(14):60.
[2] 國家藥典委員會.中華人民共和國藥典:一部[S].北京:中國醫藥科技出版社,2010.
[3] 楊小英,馬澤通,黨宏萬,等.丹參配方顆粒中有效成分的比較[J].中國醫院藥學雜志,2011,31(4):289-292.
[4] 賈曉斌,陳彥,施亞芳,等.HPLC法測定丹參配方顆粒中丹參素的含量[J].現代中藥研究與實踐,2003,17(3):43-44.
[5] 吳志軍,秦緒江,催嘉,等.丹參藥材HPLC指紋圖譜研究[J].黑龍江醫藥,2010,23(4):537-538。
[6] 宋敏,杭太俊,張正行.丹參水溶性成分HPLC指紋圖譜指紋對照品對照法的研究[J].中草藥,2005,36(3):360-364.
[7] 韋紅言,溫慶偉,陸東,等.虎杖飲片、水煎劑、配方顆粒高效液相色譜特征圖譜相關性研究[J].中國藥業,2014,23(18):37-40.
StudyonCorrelationofCharacteristicHPLCChromatogramofPieces,StandardDecoctionandFormulaGranuleofRadixSalviaeMiltiorrhizae
ZHOUWei,HUChangjiang*,DAIDerong,ZHANGXiuhuan,FengJian
(SichuanNeo-GreenPharmaceuticalTechnologyDevelopmentCo.Ltd,Sichuan,611930,China)
Objective:To study the correlation of characteristic HPLC chromatogram of Radix Salviae Miltiorrhizae pieces, standard decoction and formula granule, and investigate the effect of different existence forms on the chemical constituents.Methods:The Luna5u C18FLM column (250mm×4.6mm,5m) was used with acetonitrile and0.4% phosphoric acid aqueous solution as mobile phase. The detection wavelength was286nm. The flow rate was10mL/min, and the sampling rate was10μL. The characteristic HPLC chromatogram of10batch of Radix Salviae Miltiorrhizae pieces,10batch of standard decoction and10batch of formula granule were established.Results:7characteristic peaks in the HPLC characteristic chromatograms from10batches of formula granules could be tracked in the pieces and standard decoction, in the7characteristic peaks, three of them were rosemary acid,salvianolic acid B,sodium danshensu,protocatechuic aldehyde.Conclusion:The main chemical constituents of Radix Salviae Miltiorrhizae pieces,standard decoction and formula granule composition is basically identical.
Radix Salviae Miltiorrhizae pieces;standard decoction; formula granule; characteristic chromatogram
*
胡昌江,教授,博士研究生導師,研究方向:中藥炮制原理及飲片質量標準研究;E-mail:wind_61@163.com
10.13313/j.issn.1673-4890.2016.9.003
2015-09-15)
國家中醫藥管理局中醫藥科學技術研究專項課題(國中醫藥科2013X07);河北省科技計劃項目(14272504D)
*[通信作者] 高晗,助理工程師,研究方向:藥物工藝及質量標準研究;Tel:(0311)88030066,E-mail:gaohan24637447@126.com

