鹽酸地爾硫卓合成研究進展
戴會彬,王國超,何高楠,羅小冬
(浙江永太科技股份有限公司,浙江 臨海 317016)
鹽酸地爾硫卓合成研究進展
戴會彬,王國超,何高楠,羅小冬
(浙江永太科技股份有限公司,浙江 臨海 317016)
介紹了重要的心血管藥物鹽酸地爾硫卓的特性、用途,敘述了其化學拆分、不對稱合成和生物酶水解拆分的制備方法。中間體(2S,3S)-dl-trans-(4-甲氧基苯基)-2,3-環氧丙酸甲酯(MPGM)通過化學拆分雖然有效,但會有很多的原料被浪費;而通過脂肪酶催化拆分得到的對映體過量值>99.9%,減少了反應步驟,但已有的拆分用固定化脂肪酶的化學性質很不穩定,拆分產物的利用率也還不確定。因此應研究出一條收率高、成本低、反應條件溫和、操作簡單、綠色、符合工業化大規模生產的工藝路線。
鹽酸地爾硫卓;手性中間體;化學拆分;不對稱合成
心血管藥物地爾硫卓(Diltiazem)是苯并硫氮卓類鈣離子通道阻滯劑,鈣拮抗劑對擴張冠狀血管有非常明顯的作用,臨床中多用于心律失常、心絞痛、高血壓等心血管疾病的治療。鹽酸地爾硫卓(1)的化學名為順-(2S,3S)-(+)-5-[(2-二甲氨基)乙基]-2-(4-甲氧基苯基)-3-乙酰氧基-2,3-二氫-1,5-苯并硫氮雜卓-4(5氫)-酮,化學結構為[1-2]:
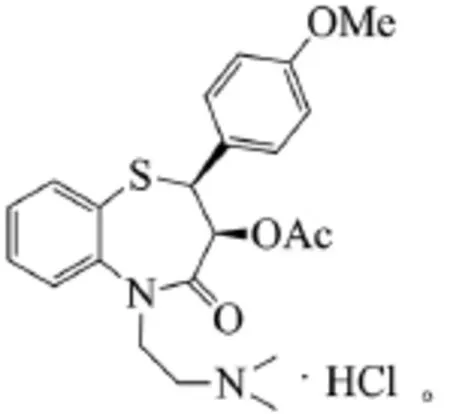
鹽酸地爾硫卓存在2個手性中心,其中只有(2S,3S)-異構體具有藥理活性。鹽酸地爾硫卓的合成目前主要有化學拆分、不對稱合成及運用生物酶拆分技術合成等方法,本文對這些方法及其研究進展進行了介紹和評述。
1 化學拆分
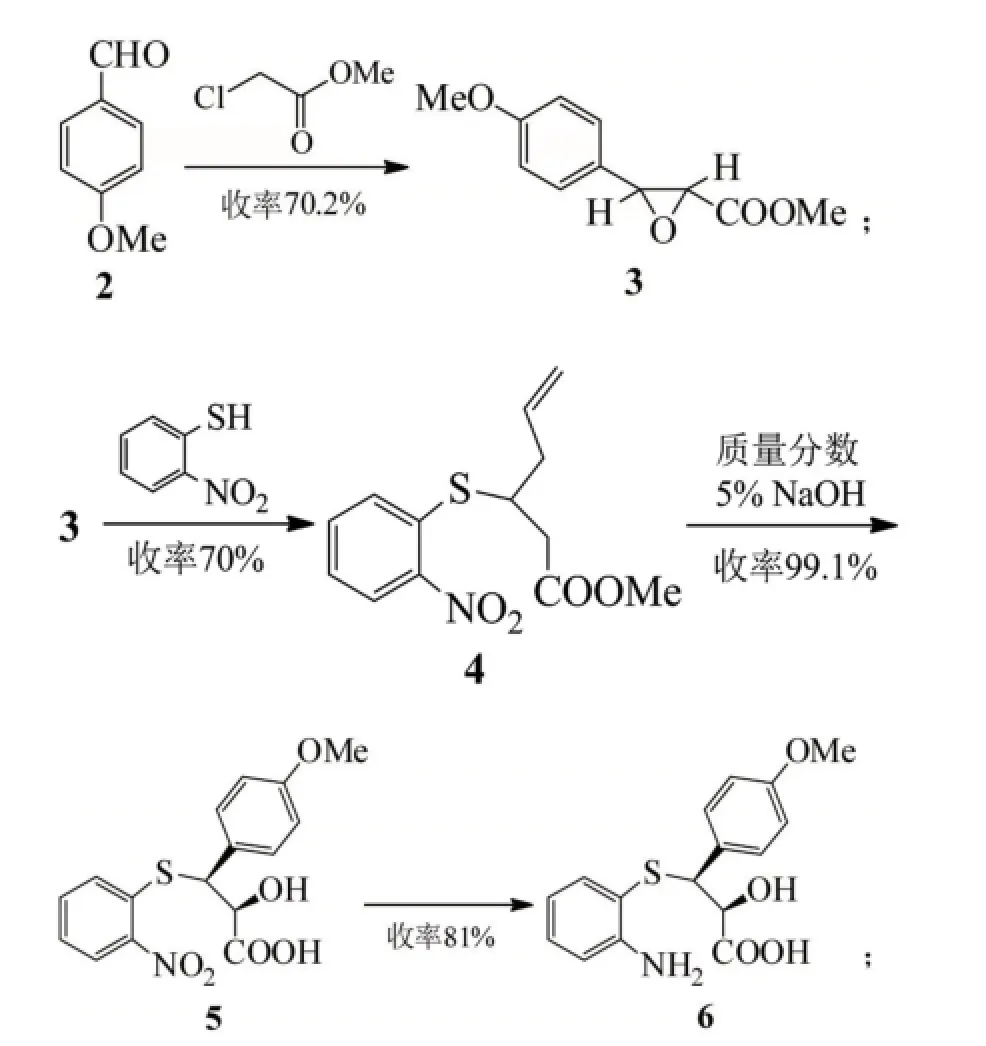
目前地爾硫卓的合成仍然以拆分法應用的最多,很多文獻都報道了它的化學合成路線及相對應的拆分方法,目前已經用于大生產的3條路線合成路線,都是以茴香醛為原料,經多步反應得到最終的產物(Me為甲基)[3]。
路線A:
路線B:
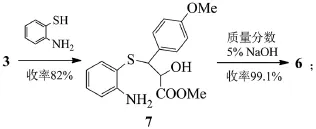
路線A和B:
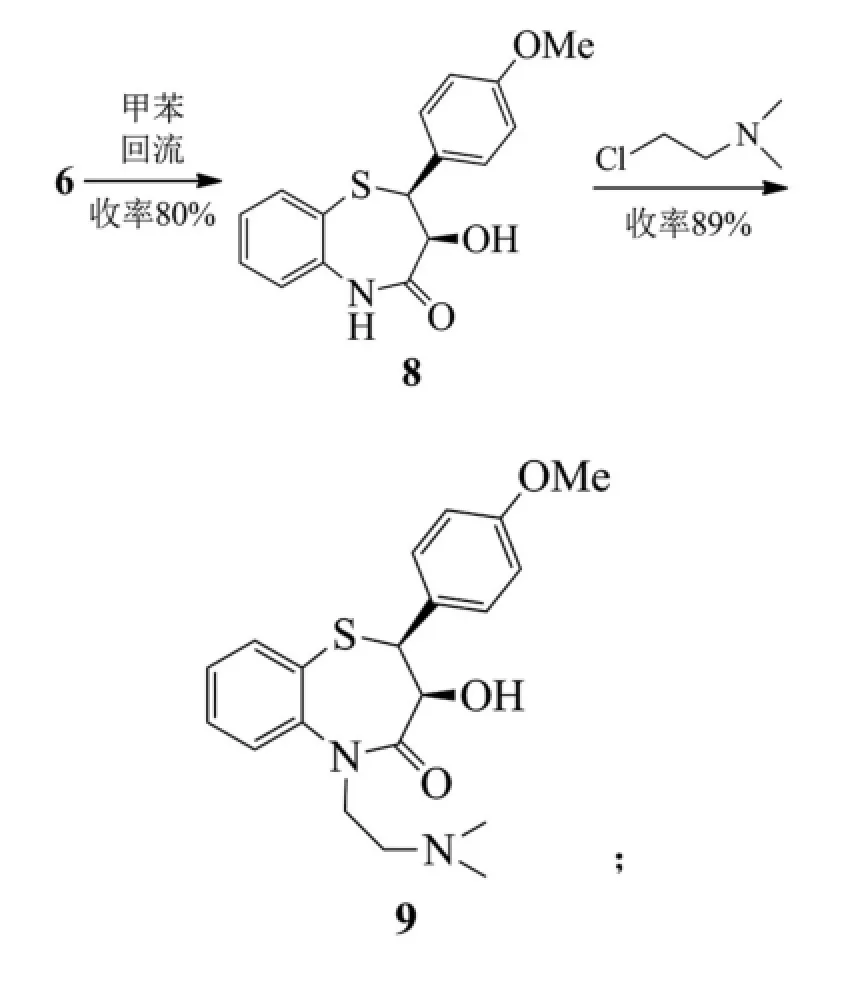
路線C:
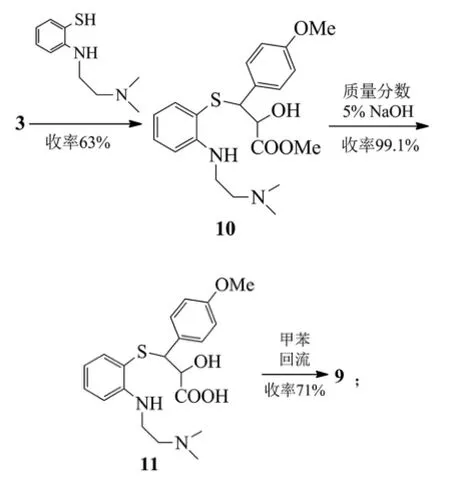
路線A、B和C:
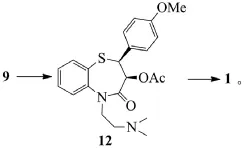
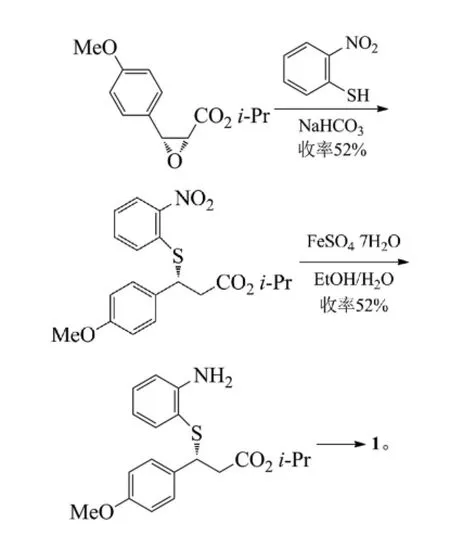
路線A和B都是以茴香醛和氯乙酸甲酯為起始反應物,經過達森縮合反應、硫代(路線B再經一步硝基還原)、堿性水解、手性拆分、成環反應得到目標化合物8,不同的地方是硫代反應的硫酚不同,路線A使用的是鄰硝基苯硫酚,路線B使用的是鄰氨基苯硫酚[4]。
鄰硝基苯硫酚不容易制備生產,更重要的是不穩定,并且還需多一步硝基的還原反應,從而降低了反應總收率。路線B中所采用的鄰氨基苯硫酚,價格低廉而且有充足的貨源供應,與中間體3 dl-trans-(4-甲氧基苯基)-2,3-環氧丙酸甲酯(MPGM)的反應收率高且操作簡便,更適合于工業化生。
關于鹽酸地爾硫卓的相應拆分試劑都得到過全面的研究[5]。文獻最早報道的是采用辛可尼定拆分地爾硫卓,化學拆分最終產物,資源損失浪費大,整條路線成本高。后改用l-賴氨酸或者l-麻黃堿拆分中間體7,賴氨酸比麻黃堿拆分的光學純度高且產率也高,加上l-賴氨酸價格便宜,所以使用l-賴氨酸拆分在工業上得到了廣泛應用。有些文獻中采用酒石酸拆分dl-3-(4-甲氧基苯基)-3-(2-氨基苯硫基)-2-經基丙酸甲酯。用(S)-α-苯乙胺拆分dl-(4-甲氧基苯基)-2,3-環氧丙酸甲酯,但由于拆分試劑太貴,所以應用與工業生產上可能性不大。
2 不對稱合成
采用化學拆分法合成目標化合物的產率理論最高為50%,這樣就會有大量資源的浪費,如果使用了不對稱合成法就可以避免這個問題。
2.1不對稱二羥化反應
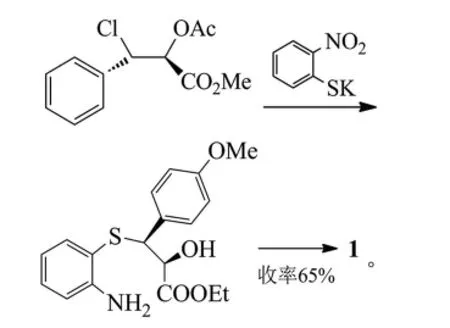
Bhushan等以反式4-甲氧基肉桂酸乙酯為起始原料,通過不對稱二羥化反應制得手性鄰二醇(2R,3S)-2,3-二羥基-3-(4-甲氧基苯基)丙酸乙酯,此步反應需要的鋨氧化劑和手性配體((DHQ-TP)-OsO4)只是催化量,而且手性配體適用的范圍很寬,操作方法簡單、成熟[6]。鄰二醇(2R,3S)-2,3-二羥基-3-(4-甲氧基苯基)丙酸乙酯再與氯化亞砜生成五元環狀的亞砜類似物,此亞砜類似物是一對非對映異構體混合物,甲氧基上氧原子存在孤對電子,與苯環形成了共軛體系,鄰氨基苯硫酚的硫原子親核進攻其中一面時的構型占優勢,然后再經過環合反應、N-烴化反應、O-酰化反應和成鹽酸鹽反應合成最終的鹽酸地爾硫卓(Et為乙基):

Choudary等采用相同的路線,不同的是使用了新的催化劑LDH-PdOsOW,此催化劑是在N-甲基嗎啉(NMM)-H2O2體系中制得,Fe3+-clay作為此步的酸催化劑,發生親核取代反應及環合反應(收率92%,對映體過量值ee為99%)[7]。2步可作為一鍋反應,使得經環狀亞硫酸酯中間體制備地爾硫卓的路線具有了更大的應用價值。反應式為:

Watson等先通過不對稱二羥化反應得到雙羥基化合物,然后與原酸酯合成地爾硫卓。其中,原乙酸三甲酯與雙羥基化合物進行酯交換反應,再和三甲基氯硅烷形成氯代中間體,以上2步反應可一鍋法完成,穩定性還是比較高的,并且構型比較穩定,最終產物的總產率提高至65%[8]。反應式為:

2.2不對稱催化環氧化
Shionogi等合成(2R,3S)-3-(4-甲氧基苯基)-2,3-環氧化丙酸甲酯,采用的是Sharpless不對稱催化環氧化法。此環氧化法用的催化劑為四異丙氧基鈦(Ti(i-PrO)4)和酒石酸二乙酯氧((+)-DET),供體為叔丁基過氧化氫(t-BuOH)[9]。Sharpless不對稱催化環氧化法現已成為經典的方法,反應中使用的催化劑都已經商品化,且選擇性特別廣,在不對稱環氧化反應中占有舉足輕重的地位。反應式為:

Jacobsen等采用Salen-Mn絡合物,此種絡合物是一種良好的手性環氧化催化劑,起始原料是cis-3-(4-甲氧基苯基)丙烯酸異丙酯,不對稱催化后得到光學活性純度很高的3-(4-甲氧基苯基)-2,3-環氧化丙酸異丙酯。假如將異丙基(i-Pr)換成甲基或乙基,最終得到的手性物質光學純度下降明顯[10]。反應式為:
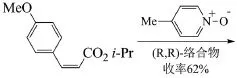
但此種方法在實際生產應用中存在很大的局限性。
Imashiro等以手性酮與Oxone(活性成分為過硫酸氫鉀)形成手性二氧雜環丙烷,起始原料是反式對甲氧基肉桂酸甲酯,經過不對稱環氧化反應得到手性中間體,ee只有78%;此步收率較高,可以達到89%[11]。反應式為:
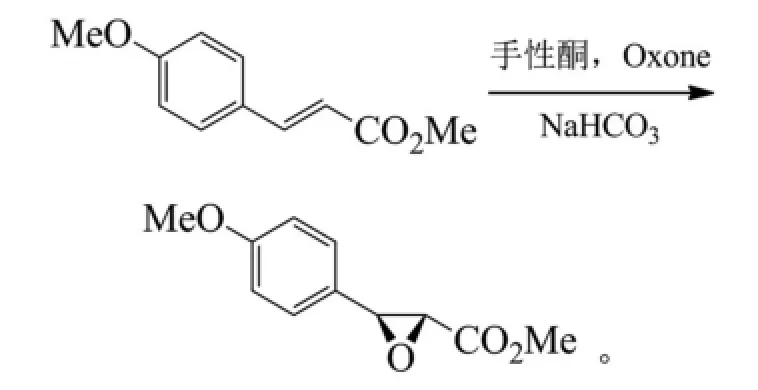
產物可以通過重結晶純化后將ee提高至99%以上,同時,配體的回收率也較高。
2.3手性誘導的Darzens反應
Schwartz等利用不對稱誘導的達森縮合反應合成了對映中間體(2R,3S)(1R,2S)-(4-甲氧基苯基)-2,3-環氧丙酸-2-苯基環己酯A[12]:
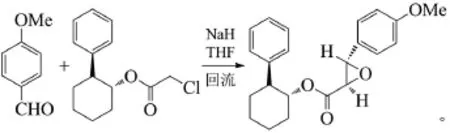
主產物A在四氫呋喃(THF)中的溶解度遠小于副產物對映體,所以兩對映體的分離、提純是非常快捷、方便的,由A再繼續反應制得最后的地爾硫卓,此步已經實現了大規模產業化生產。
3 生物酶水解拆分
光學純度高的酯類化合物通常都是通過脂肪酶催化的酯水解來合成的,合成方法路線簡單易操作,很多研究小組對3的酶促水解拆分進行了大量生物酶的篩分以及相對應的合成工藝研發。某制藥公司對生物酶進行了廣泛篩選,最后發現黏質沙雷氏菌脂肪酶對化合物3具有最好的拆分效果[13]:
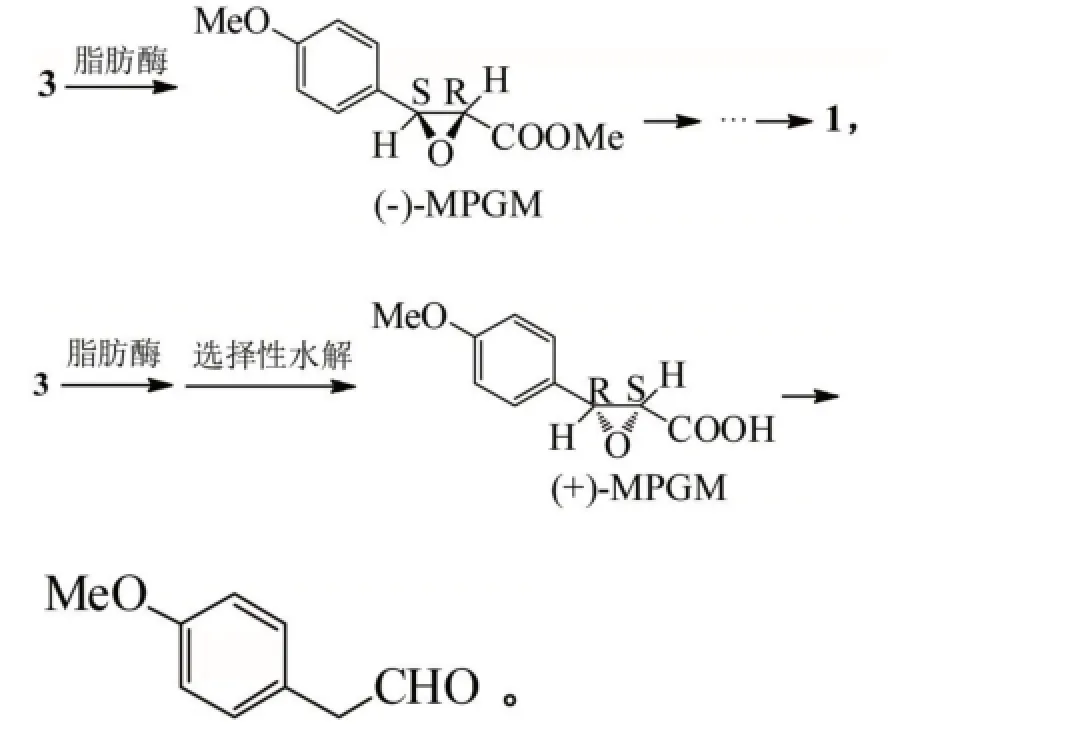
除選擇對3進行酶拆分實驗,專家們也積極研究著其他中間體被酶水解拆分的可能性,比如Desai等也成功地使用了脂肪酶催化水解化合物7,得到手性物質(2R,3S)-7及(2S,3R)-7,2種物質可以通過不同的合成方法分別轉化合成(2S,3S)-1[14]。
4 小結
綜上所述,化學拆分合成(2S,3S)-3方法是有效的,但因為是在整個合成路線中偏后部分才選擇開始拆分,所以有很多的原料被浪費。除了化學拆分,也可通過脂肪酶催化拆分,脂肪酶是一類常用的生物催化劑,最終可以得到ee>99.9%的中間體(2R,3S)-3,而且可以將地爾硫卓的合成路線由原來工業化常用的9步反應縮減為5步。但生物酶拆分也存在很多問題,比如說目前已有的拆分用固定化脂肪酶的化學性質還是很不穩定,而且拆分產物的利用率也還不確定,這些都是現實當中亟待解決的問題。
近年來鹽酸地爾硫卓的合成工藝受到了很大的關注,研究出一條收率高、成本低、反應條件溫和、操作簡單、綠色、符合工業化大規模生產的工藝路線,來滿足社會對該類藥物的需要,得到了有機化學界的普遍關注。
[1]王力心,王一兵.鈣拮抗劑對心血管系統的作用及臨床應用[J].黑龍江醫學,2002,26(8):579-580.
[2]鄭虎.藥物化學[M].4版.北京:人民衛生出版社,2003:137-138.
[3]Simonovitch Haim.Hoffmann Theodor,Sassoon Sabar. Benzothiazepinone derivatives:EP,1580303[P].2005-09-28.
[4]Nagao Susunu,Kurabagashi Katsuliko,Eutamura Nabuyuk,et al.1,5-Benzoderivatives:US,4416829[P].1983-11-22.
[5]徐克勛.精細有機化工原料及中間體手冊[M].北京:化學工業出版社,1998.
[6]Bhushan L B,Jayachandran B E,Bhushan L V,et al.Process for preparing diltiazem:US,5869697[P].1999-02-09.
[7]Choudary B M,Chowdari N S,Madhi S,et al.A trifunctional catalyst for one-pot synthesis of chiral diols via heck coupling-N-oxidation-asymmetric dihydroxylation:application for the synthesis of diltiazem and taxol side chain[J].J Org Chem,2003,68(5):1736-1746.
[8]Watson K G,Fung Y M,Gredley M,et al.Asymmetric synthesis of(+)-diltiazem hydrochloride[J].J Chem Soc,Chem Commun,1990:1018-1019.
[9]Schwartz A,Madan P B,Mohacsi E,et al.Enantioselective synthesis of calcium channel blockers of the diltiazem group[J].J Org Chem,1992,57(3):851-856.
[10]Imashiro R,Seki M.A catalytic asymmetric synthesis of chiral glycidic acid derivatives through chiral dioxirane-mediated catalytic asymmetric epoxidation of cinnamic acid derivatives[J]. J Org Chem,2004,69(12):4216-4226.
[11]Igarashi K,Honma T.Stereospecific production of diltiazem hydrochloride:DE,3415035[P].1984-10-25.
[12]張孝義.地爾硫卓的合成[J].中國醫藥工業雜志,1996,27(10):475-478.
[13]Matsumae H,Furui M.Shibatani T.Lipase-catalyzed asymmetric hydrolysis of 3-phenylglycidic acid ester the key intermediate in the synthesis of diltiazem hydrochloride[J].J Ferment Bioeng 1993,75(2):93-98.
[14]Desai S B,Argade N P.Ganesh K N.Remarkable chemo-,gio-,and enantioselectivity in lipase-catalyzed hydrolysis,efficient resolution of diltiazem[J].J Org Chem,1996,61(19): 6730-6732.
TQ463+.7
A
10.3969/j.issn.1006-6829.2016.02.007
2016-01-26;
2016-02-18

