耐硫Mo基催化劑硫化反應條件的熱力學研究
王真真,韓文鋒,劉化章
(浙江工業大學工業催化研究所,杭州 310014)
耐硫Mo基催化劑硫化反應條件的熱力學研究
王真真,韓文鋒*,劉化章
(浙江工業大學工業催化研究所,杭州 310014)
采用吉布斯自由能最小化法計算并研究了反應物組成和反應溫度對主催化劑MoO3和助催化劑CeO2硫化反應平衡組成的影響。結果表明,從熱力學角度,合適的硫化反應條件是n(H2S)/n(MoO3)為2、n(H2)/n(H2S)為0.5、硫化溫度為400℃,硫化溫度過高會生成MoS3、MoO2等副產物;同時,在MoO3的硫化過程中,不可避免地會有少部分CeO2被硫化生成Ce2O2S。
耐硫Mo基催化劑;熱力學;MoO3;CeO2;硫化
近年來,以石油和煤為主的不可再生化石能源的高效清潔利用越來越受到重視[1]。加氫技術是生產清潔油品的有效手段之一,而其中加氫催化劑是加氫技術的關鍵[8]。但反應體系中往往含有硫,容易造成催化劑硫中毒失活。硫化物催化劑由于其具有較好的耐硫性能,被廣泛應用在石油化工和煤化工工業中,如加氫脫硫和加氫脫氮反應、水蒸汽變換反應、F-T合成以及甲烷化等反應[3-7]。鉬基耐硫加氫催化劑催化活性組分為MoS2,具有硫化物催化劑的耐硫性能,并且展示出較好的活性和穩定性,得到廣泛研究[8]。
鉬基加氫催化劑的制備多采用浸漬法,即將(NH4)6Mo7O24溶液浸漬到Al2O3或CeO2-Al2O3載體中,然后經高溫焙燒分解為MoO3,通過硫化劑(工業上一般為H2S、H2氣體)對MoO3進行硫化生成MoS2。但在硫化過程中,當添加助催化劑CeO2時,CeO2可能會發生硫化反應生成Ce2O2S,對主催化劑MoO3的硫化產生影響,從而影響催化劑的性能。因此基于熱力學計算,研究反應物組成及反應溫度對MoO3和CeO2硫化反應體系中固相平衡組成的影響,以期確定適宜的硫化反應條件。
1 熱力學計算
1.1硫化體系中的化學反應
在MoO3的硫化反應體系中,可能發生以下幾個主要反應:
MoO3+H2(g)+2H2S(g)=MoS2+3H2O(g),(1)
MoO3+3H2S(g)=MoS3+3H2O(g),(2)
MoS3+H2(g)=MoS2+H2S(g),(3)
MoO3+H2(g)=MoO2+H2O(g),(4)
MoO2+2H2S(g)=MoS2+2H2O(g);(5)
在CeO2硫化反應體系中,主要發生如下反應:
2CeO2+H2(g)+H2S(g)=Ce2O2S+2H2O(g),(6)
CeO2+H2(g)+H2S(g)=CeS+2H2O(g),(7)
CeO2+2H2S(g)=CeS2+2H2O(g),(8)
2CeO2+H2(g)+3H2S(g)=Ce2S3+4H2O(g)。(9)
1.2吉布斯自由能法
吉布斯自由能法是目前國際上應用最廣的熱力學平衡分析法。吉布斯自由能法對反應過程的計量方程不作要求,僅需確定體系的反應溫度、反應壓力及反應物的元素構成,就可直接對反應過程進行優化計算。達到化學平衡時,體系的吉布斯自由能最小。
基于吉布斯自由能最小化原理,在不同溫度、壓力和原始組成狀態下,對上述整個反應體系的吉布斯自由能進行最小化求解,考察反應條件對平衡轉化率和平衡組成的影響[9]。
在恒溫恒壓狀態下,對整個體系的自由能進行最小化求解。達到化學平衡時,體系的吉布斯自由能最小。吉布斯自由能平衡方程見下式:
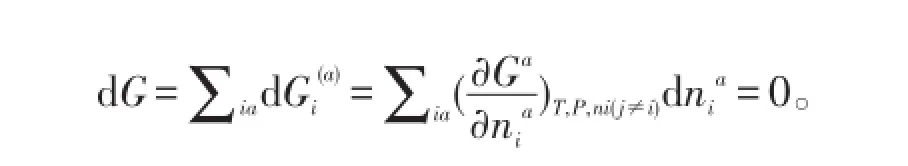
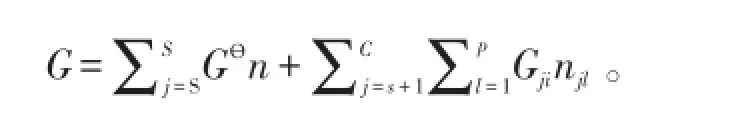
式中,S為單獨存在的相,Gj?為第j組分在標準狀態下吉布斯自由能,Gl為第j組分第l相在溫度為T時的吉布斯自由能,nj為第j組分的物質的量,nl為第j組分第l相的物質的量,C為組分數。
另外,系統還應滿足3個約束條件。
1)質量約束條件:
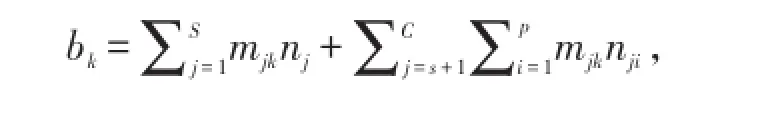
k=1、2、3、……E。
式中,bk為第k個元素的物質的量,mjk為第j組分k個原子矩陣元素,E為系統中的元素數量。
2)系統焓平衡的約束條件:
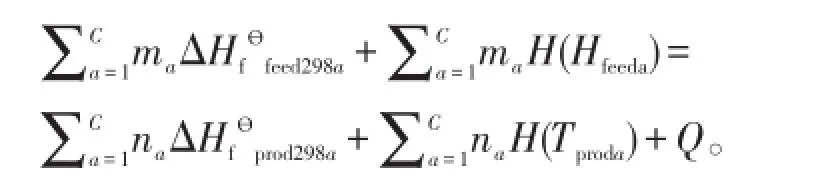
式中,ai為第i組分反應物化學計量系數,Q為熱損失,ΔHf?feed298a和H(Tfeeda)分別為反應物在標準狀態下的焓變和在溫度為T時的焓,ΔHf?prod298a和H(Tproda)分別為產物在標準狀態下焓變和在溫度為T時的焓。
3)非負約束條件:ni≥0。
以上非線性方程關系式的求解以Rand算法應用最為廣泛。首先通過Lagrange乘子法將有約束最優化問題轉化為無約束最優化問題,然后通過Newton-Raphson算法求解。
2 結果與討論
2.1反應條件對MoO3硫化反應固相平衡的影響
在MoO3硫化反應體系中,氣相物質有H2、H2S、H2O,固相物質除MoO3、MoS2外,還可能存在MoO2、MoS3。計算了不同n(H2S)/n(MoO3)、n(H2)/n(H2S)及反應溫度下,反應體系中固相混合物的組成。
2.1.1n(H2S)/n(MoO3)的影響
在反應壓力0.1 MPa、溫度400℃,n(H2)/n(H2S)為0.5的條件下,n(H2S)/n(MoO3)對MoO3硫化反應固相平衡組成(摩爾分數)的影響見表1。
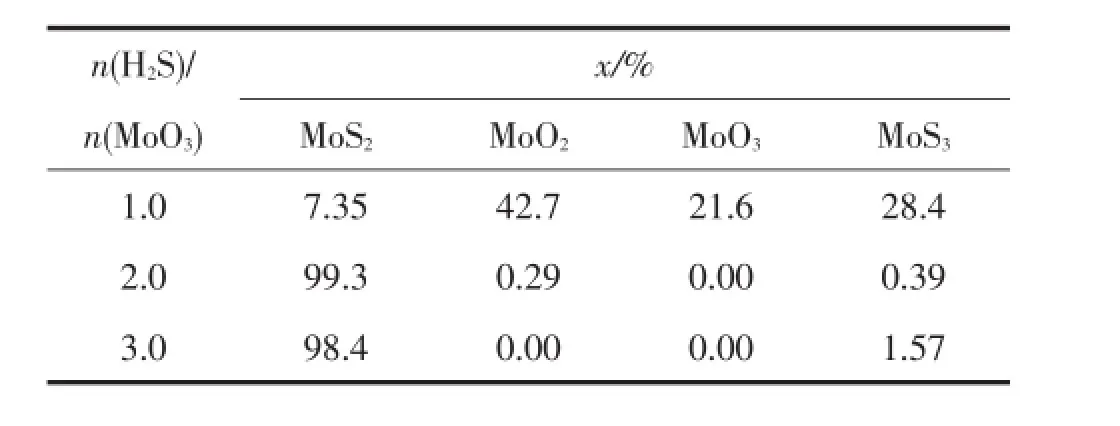
表1 n(H2S)/n(MoO3)對MoO3硫化反應固相平衡組成的影響Tab 1 Effect of molar ratio of H2S and MoO3on the solid phase equilibrium composition in the vulcanization reaction of MoO3
由表1可知,隨著n(H2S)/n(MoO3)的增加,MoS2含量先迅速增加后略有減少,MoO3、MoO2的含量迅速減少至0,MoS3的含量先減少至0后又略有增加。這說明,當n(H2S)/n(MoO3)<2時,H2S含量少于化學計量比(反應(1),致使MoO3不能被完全硫化;剩余的MoO3和H2反應生成MoO2,即發生反應(4)。當n(H2S)/n(MoO3)=2時,即MoO3和H2S、H2的含量恰好滿足反應(1)的化學計量比,此時,MoO3均完全轉化為MoS2。當n(H2S)/n(MoO3)>2時,即當H2S過量時,會有少量的MoO3與H2S反應生成MoS3,即發生反應(2)。因此適宜的n(H2S)/n(MoO3)應為2。
2.1.2n(H2)/n(H2S)對固相平衡組成的影響
在反應溫度為400℃、反應壓力為0.1 MPa、n(H2S)/n(MoO3)為2的條件下,n(H2)/n(H2S)對固相平衡組成的影響如圖1所示。
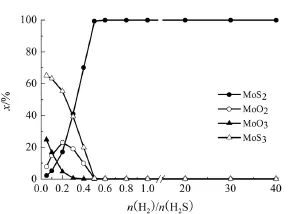
圖1 n(H2)/n(H2S)對MoO3硫化反應固相平衡組成的影響
由圖1可知,當n(H2)/n(H2S)<0.5時,隨著n(H2)/n(H2S)的增加,MoS2的含量迅速增加,MoS3和MoO3的含量迅速減少,MoO2先增加后減少。說明當n(H2)/n(H2S)<0.5時,MoO3不能被完全硫化;隨著n(H2)/n(H2S)
式中,G為吉布斯自由能,α為第α相,i為第i個組元,j為第j個組分;Gi(α)為第i個組元在α相中的吉布斯自由能,ni為第i組元物質的量,T為反應絕對溫度,p為反應壓力,?Gα/?niα為第i個組元在α相中的化學勢。
由此,建立的數學模型見下式:的增加,即H2含量增加時,反應(1)發生的程度加大,同時又發生MoS3和H2生成MoS2的反應(3)。當n(H2)/n(H2S)≥0.5時,MoO3被完全硫化而生成MoS2,MoS3、MoO3、MoO2的含量降為0。這說明,當H2和H2S滿足反應(1)的化學計量比或H2過量時,MoO3均能夠完全轉化為MoS2。因此反應氣體中n(H2)/n(H2S)應≥0.5。
2.1.3反應溫度對固相平衡組成的影響
反應壓力為0.1 MPa、n(H2)/n(H2S)為0.5、n(H2S)/ n(MoO3)為2時,反應溫度對固相平衡組成的影響如圖2所示。
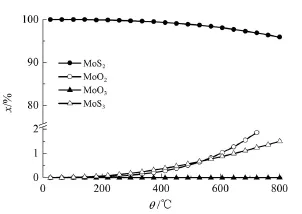
圖2 反應溫度對MoO3硫化反應固相平衡組成的影響
由圖2可知,隨著溫度提高,MoS2含量逐漸下降,而MoS3、MoO2的含量逐漸增加,尤其當反應溫度超過300℃時,變化明顯。說明溫度過高不利于MoO3轉化為MoS2。但是,工業上采用的硫化溫度一般為400~500℃。由圖2可知,當溫度為500℃時,MoS2的平衡摩爾分數達到99%以上,MoO2和MoS3的總摩爾分數小于1%。另外,提高溫度能提高反應速率,因此,合適的反應溫度應為400~500℃。
2.2反應條件對CeO2硫化反應固相平衡的影響
2.2.1n(CeO2)/n(H2S)對固相平衡組成的影響
當n(H2)/n(H2S)=1、壓力0.1 MPa、溫度400℃時,n(CeO2)/n(H2S)對固相平衡組成的影響如表2所示。
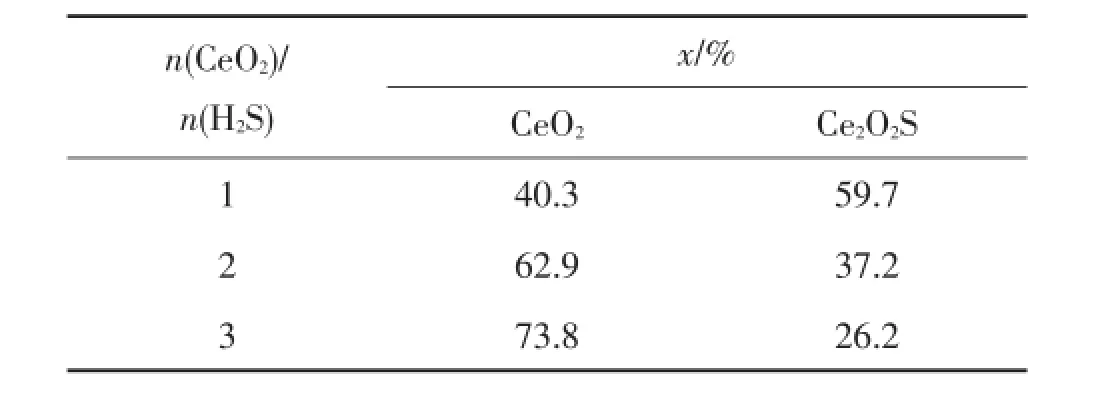
表2 n(CeO2)/n(H2S)對CeO2硫化反應固相平衡組成的影響Tab 2 Effect of molar ratio of CeO2and H2S on the solid phase equilibrium composition in the vulcanization reaction of CeO2
由表2可知,隨著n(CeO2)/n(H2S)的增加,即H2S減少時,未反應的CeO2增多,生成的Ce2O2S逐漸減少。說明當n(CeO2)/n(H2S)較大時,不利于CeO2的硫化,這是反應中期望的結果。
2.2.2n(H2)/n(H2S)對固相平衡組成的影響
當n(CeO2)/n(H2S)為2、反應壓力0.1 MPa、反應溫度400℃時,n(H2)/n(H2S)對各固相平衡組成的影響如圖3所示。
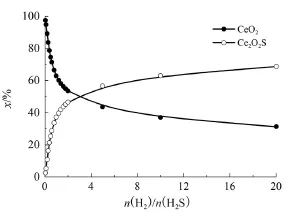
圖3 n(H2)/n(H2S)對CeO2硫化反應固相平衡組成的影響
由圖3可知,隨著n(H2)/n(H2S)的增加,CeO2的含量逐漸減少,而Ce2O2S的含量逐漸增加。原因是當H2含量增加時,能促進CeO2和H2S的轉化,這不是期望的結果。因此,為了避免CeO2的硫化,H2含量不宜太高。
2.2.3反應溫度對固相平衡組成的影響
當n(H2)/n(H2S)=1、n(CeO2)/n(H2S)=2、反應壓力0.1 MPa,反應溫度對各固相平衡組成的影響如圖4所示。
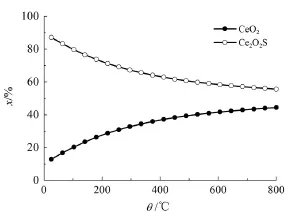
圖4 反應溫度對CeO2硫化反應固相平衡組成的影響
由圖4可知,隨著反應溫度的升高,CeO2的含量逐漸減少,而Ce2O2S的含量逐漸增加。說明溫度升高有利于CeO2的轉化,這不是期望的結果。因此,為了盡量避免CeO2的硫化,但又不影響主催化劑MoO3的硫化,反應溫度應降低。但MoO3的硫化溫度通常在400℃以上,因此,在MoO3的硫化過程中,不可避免地會有部分CeO2被硫化生成Ce2O2S。適宜反應溫度應為400℃。
3 結論
為了使MoO3能夠完全轉化為MoS2,同時又能抑制CeO2的硫化,通過熱力學計算得到以下結論:
1)當n(H2S)/n(MoO3)為2、n(H2)/n(H2S)為0.5時,MoO3能完全轉化為MoS2,溫度過高影響MoO3的硫化,但綜合考慮溫度對反應速率的影響,合適的硫化溫度為400℃。
2)在MoO3的硫化過程中,不可避免地會有少部分CeO2被硫化生成Ce2O2S,但是適當減少H2含量,降低反應溫度,均能抑制CeO2被硫化。
[1]A L Kustov,A M Frey,K E Larsen,et al.CO methanation over supported bimetallic Ni-Fe catalysts:From computational studies towards catalyst optimization[J].Appl Catal A:Gen,2007,320:98-104.
[2]R G Leliveld,S E Eijsbouts.How a 70-year-old catalytic refinery process is still ever dependent on innovation[J]. Catalysis Today,2008,130:183-189.
[3]NRinaldi,T Kubota,Y Okamoto.Effect of citric acid addition on the hydrodesulfurization activity of MoO3/Al2O3catalysts[J]. Applied Catalysis A:General,2010,374:228-236.
[4]T Mochizuki,H Itou,M Toba.Effects of acidic properties on thecatalytic performance of como sulfide catalysts in selective hydrodesulfurization of gasoline fractions[J].Energy&Fuels,2008,22:1456-1462.
[5]H Ge,X-K.Li,Z-F.Qin.Highly active Mo/Al2O3hydrodesulfurization catalyst presulfided with ammonium thiosulfate[J]. Catalysis Communications,2008,9:2578-2582.
[6]Afanasiev P.The influence of reducing and sulfiding conditions on the properties of unsupported MoS2-based catalysts[J]. ournal of Catalysis,2010,269(2):269-280.
[7]J-J Gao,Q Liu,F-N Gu.Recent advances in methanation catalysts for the production of synthetic natural gas[J].SC Adv,2015,5:22759-22776.
[8]Nino Rinaldi Usman,Khalida Al-Dalama,Takeshi Kubota,etal.Preparation of Co-Mo/B2O3/Al2O3catalysts for hydrodesulfurization:Effect of citric acid addition[J]. Applied Catalysis A:General,2009,360:130-136.
[9]Mehrdokht N,Nader M.Simulation of biomass gasification in fludized bed reactor using aspen plus[J].Biomass Bioenergy,2008,32(12):1245-1254.
[10]王曉佳,金保昇,張勇等.基于鐵基載氧體的甲烷化學鏈燃燒數值模擬[J].東南大學學報(自然科學版),2011,4(7):584-590.
氟化工供給側改革要找準定位
從氟化工的產業鏈特征來看,從螢石開始,隨著產品加工深度的增加,產品的附加值成幾何倍數增長,氟化工行業的價值重心在中下游。但是,目前中國企業在靠近原材料的低端產品方面具有一定的競爭力。而附加值高、加工深度以及技術要求高的產品領域,基本上被國外企業占據。我國氟化工行業的供給側改革要找準定位,明確改革方向。
氟化工低端產業鏈產能嚴重過剩。我國HFCs的生產量和消費量均居全球前列,已建成的生產能力占全球的一半左右,但行業平均開工率僅為六成左右。產品同質化競爭激烈,國內大部分企業HFCs裝置大部分時間停產,只有少數龍頭骨干企業勉強運行。因此,行業應當對HFCs類制冷劑進行產能發展的限制,鼓勵收購兼并,行業整合,提高競爭力。
一是建立產業政策引導控制線。要清理僵尸企業,淘汰落后產能,將發展方向鎖定新興領域、創新領域,創造新的經濟增長點。通過國家政策引導鼓勵產業高端化、差異化發展,但要研究控制線,避免過度引導造成的產能過剩。
二是建立產能預警機制。對氟化工產業進行高端化引導的同時,通過行業協會等組織進行行業調查,對產能相對于需求超過預警線的要進行公告,避免行業企業盲目擴能和行業外企業盲目進入。
三是建立產能控制機制。對于資源型初級產品和生命周期尾部階段產品,超過產能過剩線,國家應亮紅燈進行干預。除非屬于循環經濟、技術升級的項目建設,其他一般的擴能、新增產能項目可以通過環境容量、能耗等加以產能發展的限制,騰出發展空間。
四是產品出口稅收政策區分初級和高端,以鼓勵產品深加工、發展高新技術,限制資源消耗型初級產品出口。工業氫氟酸屬于初級原料性產品,當前產能過剩,導致我國高品位、易開采螢石礦處于極為嚴重的過度開采狀態;而高純氫氟酸技術要求高、總量小、附加值高,對于發展我國電子產業具有重要意義。對于工業級氫氟酸應實行出口高關稅,而關系信息安全的電子級氫氟酸則應降低出口關稅。
五是在制定全球HFCs逐步削減協議時,要考慮行業、行業協會、企業利益。
六是制定HFCs逐步淘汰削減國際方案,先削減使用高GWP的HFCs產品的新設施,國內凍結HFCs產能,禁止審批。
(本刊編輯部)
研究與開發
TQ032.41
ADOI
10.3969/j.issn.1006-6829.2016.01.004
*通訊聯系人。電子郵件:hanwf@zjut.edu.cn
2015-12-25

