死亡相關蛋白激酶在急性白血病細胞中的表達及臨床意義
應裴裴,楊明珍
(安徽醫科大學第一附屬醫院血液科,合肥 230032)
?
死亡相關蛋白激酶在急性白血病細胞中的表達及臨床意義
應裴裴,楊明珍△
(安徽醫科大學第一附屬醫院血液科,合肥 230032)
目的探討死亡相關蛋白激酶(DAPK)表達與急性白血病(AL)患者臨床特征之間的關系。方法應用半定量逆轉錄-聚合酶鏈反應(RT-PCR)法檢測DAPK mRNA在54例AL患者(AL組)及18例骨髓移植供者和健康體檢者(對照組)骨髓細胞或外周血中的相對表達量。結果AL組DAPK mRNA表達量(0.104 8±0.094 1)明顯低于對照組(0.356 7±0.106 1),差異有統計學意義(P<0.01)。急性淋巴細胞白血病(ALL)患者DAPK mRNA表達(0.057 7±0.099 5)低于急性髓系白血病(AML)患者(0.119 80±0.088 42),差異有統計學意義(P=0.003 7)。DAPK mRNA表達改變與患者WBC計數、纖維蛋白原呈正相關(P<0.05);與患者的性別、年齡、AML亞型、初診AL第一次誘導緩解治療療效等結果均無相關性(P>0.05)。結論DAPK mRNA表達在白血病細胞中顯著降低。
骨髓細胞;急性白血病;死亡相關蛋白激酶;逆轉錄-聚合酶鏈反應
近年研究表明,急性白血病(AL)發生是遺傳和表觀遺傳改變及環境因素相互作用的結果,特別是啟動子區甲基化,導致腫瘤抑制基因及腫瘤相關基因表達沉默,在其發生、發展中發揮了重要作用。死亡相關蛋白激酶(DAPK)是一種與腫瘤凋亡、轉移等密切相關的絲氨酸/蘇氨酸激酶,可激活經典的p53-半胱氨酸蛋白酶(caspase)途徑及不依賴于caspase凋亡途徑的多條腫瘤細胞凋亡通路,同時DAPK可被Fas、γ-干擾素(INF-γ)、腫瘤壞死因子β(TNF-β)、c-myc等因子激活,很可能是多種信號誘導腫瘤細胞凋亡的匯合點[1]。本研究采用半定量逆轉錄-聚合酶鏈反應(RT-PCR)法,對AL患者細胞中DAPK mRNA的表達水平進行了檢測,觀察其與AL各臨床指標及該病發生、發展的關系。
1 資料與方法
1.1一般資料收集2015年2~10月安徽醫科大學第一附屬醫院血液科的54例AL患者骨髓或外周血標本。其中初治AL 38例,復發6例,慢性粒細胞白血病急變3例,骨髓增生異常綜合征急變2例,第一次誘導未緩解5例。初診AL 38例,第一次誘導緩解時,放棄治療9例,未緩解9例,緩解18例,死亡2例(1例死于重癥感染,1例死于腦出血)。所有病例均經臨床、形態學、免疫學及組化染色確診。對照組取自18例骨髓移植供者和健康體檢者的骨髓或外周血單個核細胞。
1.2試劑與儀器淋巴細胞分離液,Trizol試劑(美國Invotrigen公司),引物(上海生工生物工程有限公司),PCR儀(德國Biometra公司),Tanon凝膠成像系統(上海Tanon公司),分光光度儀,低溫冷凍離心機。Takara Code No.RR055A PrimeScriptTMOne Step RT-PCR Kit Ver.2購自日本TaKaRa公司。
1.3方法
1.3.1引物選擇PCR引物序列參照文獻[2]。DAPK上游引物:5′-GCC TGG AGA CGG AGA AGA T-3′,下游引物:5′-AAC TCC CGT GGC TGG TAG A-3′,擴增產物長度為170 bp;β-actin上游引物:AGC GAG CAT CCC CCA AAG TT,下游引物:GGG CAC GAA GGC TCA TCA TT,擴增片段長度為285 bp。由上海生工生物工程技術有限公司合成、純化,用無RNA酶滅菌雙蒸水溶解為20 μmol/L,-20 ℃保存以備用。
1.3.2細胞總RNA提取抽取對照組及AL組患者骨髓或外周血各3 mL,肝素抗凝,經淋巴細胞Ficoll分離液分離單個核細胞,取界面層單個核細胞100 μL移入1.5 mL EP管內,加入1 mL Trizol保護液中充分混勻。按TRizoL法提取RNA,所提取總RNA用DEPC處理,雙蒸水溶解后用紫外分光光度計測定純度(OD260/OD280>1.8),同時進行RNA定量。
1.3.3半定量RT-PCR總反應體系25 μL,內含prime script 1 step Enzyme Mix 1 μL,2×1 step Buffer 12.5 μL,上游、下游引物Primer(20 μm/μL)各0.5 μL。Template RNA/內參RNA 0.5 μL(<0.5 μL),RNase Free dH2O up to 25 μL。優化后最佳反應條件:50 ℃ 30 min,94 ℃預變性2 min,94 ℃變性30 s,55 ℃ 退火30 s,72 ℃延伸1 min,28個循環。對照:(1)直接用每個樣本總RNA進行RT-PCR反應;(2)不加引物進行反應;(3)不加RNA進行RT-PCR反應。
1.3.4PCR產物電泳結果判定取擴增產物10 μL,在2%瓊脂糖凝膠(每50 μL加5 μL GOLDview)上進行電泳,80 V,40 min。紫外線投射儀下觀察并照相。根據特異性條帶的有無,分別記為陽性和陰性。以目的基因DNA擴增帶密度與β-actin擴增片段密度比值為其mRNA表達水平的定量指標。

2 結 果
2.1DAPK mRNA的表達DAPK mRNA在部分AL患者骨髓單個核細胞中的表達電泳圖見圖1。AL組DAPK mRNA表達水平明顯低于對照組(0.104 8±0.094 1 vs.0.356 7±0.106 1,P<0.01)。

1:對照組;2、3、4、6、7、8、9、10:AL組;5:空白對照組;11:DNA mark 500。
圖1DAPK mRNA的表達電泳圖
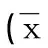
表1 初診AL患者骨髓單個核細胞中DAPK mRNA表達與臨床特征WBC相關性±s)
2.2DAPK mRNA表達與AL臨床表現的關系初診AL患者中,WBC≥20×109/L組DAPK mRNA表達高于WBC<20×109/L組(P=0.016);初診急性髓系白血病(AML)患者,WBC≥20×109/L組DAPK mRNA表達高于WBC<20×109/L組(P<0.01);初診急性淋巴細胞白血病(ALL)患者,WBC≥20×109/L組與WBC<20×109/L組比較,差異無統計學意義(P>0.05),見表1。AML患者DAPK mRNA表達高于ALL患者(P=0.037),纖維蛋白原(Fib)大于或等于4 g/L組高于小于4 g/L組(P=0.031),初診AL患者中WBC≥100×109/L組高于WBC<100×109L組(P=0.019);與患者的性別、年齡、初診誘導治療療效均無相關性(P>0.05),見表2。對初診AML 25例患者進行白血病分型,其中M1 3例,M2 13例,M4 1例,M5 8例,DAPK mRNA表達與AML亞型無相關性(P>0.05),因M1、M4例數過少未進行比較分析,見表3。
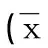
表2 AL患者骨髓單個核細胞中DAPK mRNA表達與臨床特征的相關性±s)

表3 初診AML患者DAPK mRNA表達與其亞型的相關性
3 討 論
凋亡受阻是人類腫瘤的重要特征之一,白血病是起源于造血干細胞的惡性克隆性疾病,其發生、發展與白血病細胞增殖失控、分化障礙、凋亡受阻密切相關。DAPK是一種重要的凋亡前基因,定位于人類染色體9q34.1,全長4 293 bp,是一種鈣離子調節的絲氨酸/蘇氨酸蛋白激酶,通過去磷酸化激活來調控細胞凋亡;其家族至少有5個成員,在各種組織中廣泛表達,參與外源性和內源性凋亡通路,啟動誘導凋亡途徑,是凋亡的正性調節因子之一[3]。DAPK的結構包括一個核心的激酶區、鈣離子/鈣調蛋白結合區、錨蛋白重復序列區、P-環、細胞骨架結合區、死亡區和富含絲氨酸的尾部7個部分。核心激酶區位于鈣離子/鈣調蛋白結合區與N-端之間,由11個絲/蘇氨酸結構組成,還含有一個保守的賴氨酸殘基,該殘基與腺嘌呤核苷三磷酸(ATP)的結合有關,若發生突變(K42W或K42A)會引起凋亡作用的消失[4-6]。
研究結果表明,DAPK基因在正常組織中均有表達,而在一些人類腫瘤細胞株和原發性惡性腫瘤如B細胞、T細胞來源的惡性腫瘤、鼻咽癌、卵巢癌/子宮癌、鱗狀細胞癌、肺癌、結直腸癌等組織中DAPK的表達異常低下或缺失[6-13],而且其表達缺失也與其CpG島的甲基化改變密切相關,提示與癌癥的發生、發展有著密切的聯系。本研究顯示,DAPK基因在白血病細胞中的表達明顯低于健康人單個核細胞,差異有統計學意義(P<0.01),與上述結論一致,進一步證實DAPK基因是潛在的白血病抑制基因。
通過分析DAPK表達與AL臨床特征之間的關系發現,ALL組DAPK mRNA表達量低于AML組,差異有統計學意義(P<0.05),提示DAPK表達缺失在ALL中可能較AML有更高潛在促進白血病細胞發生、發展的風險,其具體作用機制尚有待進一步研究。相關分析顯示,DAPK表達與初診AL WBC計數呈正相關,但均明顯低于對照組。AL的發生與白血病細胞增殖失控、分化障礙、凋亡受阻密切相關,可能在WBC≥20×109/L患者發病過程中白血病細胞增殖失控起主要作用。進一步研究發現,初診ALL中DAPK表達與WBC計數無相關性,而初診AML中DAPK表達與WBC計數依然呈正相關性,有研究報道DAPK主要表達在較成熟細胞[14],可能髓系WBC≥20×109/L患者較髓系WBC<20×109/L患者白血病細胞發育成熟些,細胞越原始,DAPK相對表達越低。DAPK導致AML發生是否存在其他機制,尚需大量研究證實。因時間原因僅對初診AL患者第一次誘導治療療效進行分析,未進行長期動態隨訪,生存率與DAPK mRNA表達是否相關,尚需大量研究證實。腫瘤的轉移過程與黏附緊密相關。血漿Fib 是一種糖蛋白,由肝細胞合成和分泌,其主要生理功能是作為凝血因子Ⅰ直接參與體內凝血過程,同時其與細胞黏附、伸展移動、增殖和分化密切相關。有研究顯示[15],Fib及其降解產物在患癌時增高,可增強血小板對癌細胞的黏附,從而利于癌細胞的轉移,故Fib 水平升高往往預示著腫瘤有轉移的傾向。本研究發現,DAPK mRNA表達改變與患者Fib呈正相關,在白血病患者中高水平表達DAPK mRNA可能預示有高度侵襲和轉移傾向。血液的高凝狀態與惡性腫瘤的發生、發展及復發轉移有著密切的關系,惡性腫瘤患者的血液多存在明顯的高凝狀態[16]。提示在白血病患者中DAPK mRNA表達較高者血液多存在明顯的高凝狀態。本研究發現AL細胞中DAPK mRNA表達量明顯低于對照組,表明DAPK表達缺失可能是AL發生、發展重要機制之一,而在高水平表達DAPK mRNA AL患者中,Fib明顯增高,可能在該類患者發病機制中Fib高表達占有重要作用。本研究因患者就診時間干擾,實驗樣本量不足,受時間實驗條件等客觀因素限制,未能進行大樣本實驗,其結果有待于進一步驗證。
腫瘤細胞中的一些抑癌基因高度甲基化可導致基因轉錄失活[17],牛一蒙等[18]通過RT-PCR檢測到AL患者中DAPK啟動子區甲基化與其mRNA的異常表達有關,目前廣泛認為DAPK在腫瘤組織中降低是由于其啟動子區CpG島區發生異常甲基化。本研究結果也證實了DAPK在AL細胞尤其ALL中異常低表達。研究DAPK分子作用機制及其參與腫瘤發生、發展的信號傳導過程,探求阻斷其信號傳導或抑制其作用的方法,可能為未來腫瘤的治療提供新的視野。
[1] Cohen O,lnbal B,Kissil JL,et al.DAP-kinase participates inTNF-alpha-and Fas-induced apoptosis and its function requires the death domain[J].J Cell Biol,1999,146(2):141-148.
[2]Raval A,Tanner SM,Byrd VC,et al.Dounregulation of death associated protein kinase 1(DAPK1) in chronic 1ymphocytic leukemoa[J].Cells,2007,129(5):879-890.
[3] Kogel D,Prehn JH,Scheidtmann KH.The DAP kinase family of pro-apoptotic;novel players in the apototic game[J].Bioessays,2001,23(4):352-358.
[4]Zhao XL,Meng ZY,Qiao YH,et al.Promoter methylation of DAPK gene in cervical carcinoma[J].Ai Zheng,2008,27(10):919-923.
[5]Yanagawa N,Osakabe M,Hayashi M,et al.Detection of HPV-DNA,p53 alterations,and methylation in penile squamous cell carcinoma in Japanese men[J].Pathol Int,2008,58(5):477-482.
[6]Kissil JL,Feinstein E,Cohen O,et al.DAP-kinase loss of expression in various carcinoma and B-cell lymphoma cell Lines:possible implications for role as tumor suppressor gene[J].Oncogene,1997,15(5):403-407.
[7] Aggerholm A,Hokland P.DAP-kinase CpG island methylation in acute myeloid leukemia:methodology versus biology? [J].Blood,2000,95(30):2997-2999.
[8] Nakatsuka S,Takakuwa T,Tomita Y,et al.Hypermethylation of death-associated protein(DAP)kinase CpG island is frequent not only in B-cell hut also in T-and natural killer(NK)/T-cell malignancies[J].Cancer Sci,2003,94(1):87-91.
[9] Wong TS,Chang HW,Tang KC,et al.High frequency of promoter hypermethylation of the death-associated protein-kinase gene in nasopharyngeal carcinoma and its detection in the peripheral blood of patients[J].Clin Cancer Res,2002,8(5):433-437.
[10] Bai T,Tanaka T,Yukawa K,et al.Reduced expression of death-associated protein kinase in human uterine and ovarian carcinoma cells[J].Oncol Rep,2004,11(7):661-665.
[11] Ogi K,Toyota M,Ohe-Toyota M,et al.Aberrant methylation of multipie genes and clinicopathological features in oral squamous cell carcinoma[J].Clin Cancer Res,2002,8(32):3164-3171.
[12]Toyooka S,Toyooka KO,Miyajima K,et al.Epigenetic down-regulation of death-associated protein kinase in lung cancers[J].Clin Cancer Res,2003,9(30):3034-3041.
[13]SatohA,ToyotaM,ItohF,etal.DNAmethylationandhistonedeacetylationassociatedwithmilencingDAP-kinasegeneexpressionincolorectalandgastriccancers[J].BrJCancer,2002,86(20):1817-1823.
[14] 吳紅紅,曹暉,王亞哲,等.CD7陽性急性髓系白血病骨髓干/祖細胞5個基因表達的研究[J].中國實驗血液學雜志,2009,17(2):298-303.
[15]朱明霞,彭佳,倪飛,等.惡性淋巴瘤患者血漿纖維蛋白原水平與功能測定的臨床意義研究[J].血栓與止血學,2010,16(5):210-212.
[16] Voland C,Serre CM,Delmas P.Platelet-osteosarcoma cell interaction is mediated through a specific fibrinogen-binding sequence located within the N-terminal domain of thrombospondin[J].J Bone Miner Res,2000,15(4):361-368.
[17]Giuseppe L,Luciana T,Maria Teresa V,et al.DNA methylation and demethylating drugs in myelodysplastic syndromes and secondary leukemias[J].Haematologica,2002,87(12):1324-1341.
[18] 牛一蒙,王萍萍,王玥,等.急性白血病死亡相關蛋白激酶基因表達及啟動子區甲基化狀態研究[J].中國實驗血液學雜志,2014,22(1):111-112.
The expression and clinical significance of death-associated protein kinase in acute leukemia
Ying Peipei,Yang Mingzhen△
(Department of Hematology,First Affiliated Hospital of Anhui Medical University,Hefei,Anhui 230032,China)
ObjectiveTo detect expression of death-associated protein kinase (DAPK) in acute leukemia cells,explore the relationship between DAPK expression and clinical characteristics of patients with acute leukemia(AL).MethodsThe relative expression of DAPK mRNA in leukemic cells and normal bone marrow cells or peripheral blood was detected by semi quantitative RT-PCR method.ResultsThe expression of DAPK mRNA in bone marrow or peripheral blood samples of 18 normal control group was 0.356 7±0.106 1,The expression of DAPK mRNA in bone marrow or peripheral blood samples of 54 patients with acute leukemia was 0.104 8±0.094 1,the experimental group was significantly lower than the control group,the difference was statistically significant (P<0.01).In the experimental group,the relative expression of 13 ALL patients was 0.057 7±0.099 5,and the relative expression of in 41 patients with AML was 0.119 80±0.088 42,AML group was lower than that of ALL group(P=0.003 7).DAPK mRNA expression was positively correlated with the white blood cell count and fibrinogen content of the patients(P<0.05);and had no correlation with sex,age,fusion gene,platelet count,LDH value,acute myeloid leukemia subtype,and first remission induction therapy in newly diagnosed acute leukemia patients(P>0.05).ConclusionDAPK mRNA expression was significantly decreased in leukemia cells.
bone marrow cells;acute leukemia;death-associated protein kinase;reverse transcriptase PCR
應裴裴(1991-),碩士,主要從事血液內科工作。△
,E-mail:Yangmingzhenymz@163.com。
論著·臨床研究10.3969/j.issn.1671-8348.2016.22.017
R733.71
A
1671-8348(2016)22-3072-03
2016-03-27
2016-05-15)

