幾種經典有機反應的分子軌道描述
許 薇 許家喜(北京化工大學理學院有機化學系,北京100029)
·知識介紹·
幾種經典有機反應的分子軌道描述
許薇許家喜*
(北京化工大學理學院有機化學系,北京100029)
用分子軌道來描述有機反應的過程對于正確理解有機反應的機理非常重要,分子軌道可以清楚地描述出反應的選擇性和立體化學等信息。本文討論了脂肪和芳香親核取代、芳香親電取代、加成和消除等幾種經典有機化學反應過程的分子軌道描述。
有機反應;分子軌道;親核取代;加成;消除
www.dxhx.pku.edu.cn
在有機化學的學習中,用分子軌道來描述有機反應的過程對于正確理解有機反應機理非常重要,分子軌道不僅可以清楚地描述有機反應的過程,還可以幫助說明和解釋反應的選擇性和立體化學等信息。但是,分子軌道理論相對比較抽象,不論是教師講授,還是學生學習,都感到比較困難。甚至目前廣泛應用的有機化學教科書中對于非常重要和典型的脂肪雙分子親核取代反應SN2反應過程的分子軌道描述都是錯誤的。因此,我們認為有必要討論一下有機化學中經典反應過程的分子軌道描述。我們在這里不再贅述分子軌道理論,只討論基礎有機化學中經典反應過程的分子軌道描述。希望本文能夠對教師授課和學生的學習和理解提供有益的幫助。
1 有機化學中化學鍵形成和斷裂的分子軌道描述
分子軌道對稱性守恒原理是基本化學理論之一。這個原理說明了分子軌道的對稱性對化學反應進行的難易程度及產物構型起決定性作用,使人們對反應動力學和反應機理的認識深入到了物質微觀結構層次。當反應物和產物的分子軌道對稱特征一致時,反應就容易發生;而不一致時,反應就不容易進行。即在基元反應中分子軌道的對稱性保持不變[1,2]。
正確理解化學鍵形成和斷裂的分子軌道描述是用分子軌道準確描述有機反應過程的基礎。所以,這里先介紹一下基礎有機化學中涉及的典型化學鍵形成和斷裂的分子軌道描述[3,4]。只有波相相同的2個原子軌道或分子軌道之間才能夠形成化學鍵,波相相反則形成反鍵。有機化學中常見的化學鍵包括σ鍵和π鍵。由2個波相相同的s軌道可以形成氫分子的σ鍵、由波相相同的s和p軌道形成σ鍵(如由氫原子和鹵素原子形成鹵化氫分子)、由2個波相相同的p軌道形成σ鍵(如由2個鹵素原子形成鹵素分子)、由波相相同的s軌道和spn(n=1,2,3)雜化軌道形成σ鍵(如由氫原子和碳原子的sp,sp2或sp3雜化軌道形成C-H鍵)、由波相相同的p軌道和spn(n=1,2,3)雜化軌道形成σ鍵(如由鹵素原子和碳原子的sp,sp2或sp3雜化軌道形成C-X鍵)、由波相相同的2個spn(n=1,2,3)雜化軌道形成σ鍵(如由2個碳原子形成C-C鍵)、由2個波相相同的p軌道形成π鍵(如由2個碳原子形成C=C鍵或1個碳原子和1個氮原子或氧原子形成的C=N或C=O雙鍵等)、及由n個p軌道形成共軛體系(如由n個碳原子形成的p-π和π-π鍵)等。化學鍵的斷裂過程就是其形成的逆過程。
2 經典有機反應過程的分子軌道描述
單分子的電環化和電開環,以及σ遷移反應等周環反應的分子軌道描述在很多教材中都講述得非常清楚[5,6],在此不再贅述。本文主要討論對雙分子反應的分子軌道描述[7]。分子軌道理論認為,雙分子反應應該滿足下列3個基本條件:
(1)起決定性作用的軌道是兩個反應物分子中一個分子的最高已占軌道(HOMO)和另一分子的最低空軌道(LUMO),當兩分子接近時,電子便從一個分子的HOMO流入另一分子的LUMO。
(2)當兩個分子互相接近時,一個分子的HOMO與另一分子的LUMO擬形成化學鍵重疊部分的波相必須相同。即這兩個起決定性作用的軌道必須具有相同的對稱性,應屬于點群中的同一對稱類型。而且,如有可能,還要兩個軌道之間軌道系數大的一段彼此重疊,軌道系數小的一段相互重疊,這樣重疊最有效,從而顯示出反應的選擇性[8],如Diels-Alder反應的區域選擇性。
(3)互相起作用的HOMO和LUMO軌道能量必須接近(約在6 eV范圍內)。對一個基元反應,如果找不到一對軌道滿足上述所有條件,則該反應就很難按這種方式進行,稱為對稱禁阻的反應。
首先來看目前一些有機化學教科書中關于脂肪SN2反應過程的分子軌道描述[3,9-11],在該描述中,親核試劑都是從一端進攻C-X鍵的σ成鍵軌道,具體來說就是進攻碳原子形成C-X鍵的sp3軌道中較小的一瓣(圖1)。這就相當于是親核試劑(Nu:)的HOMO軌道與鹵代烷C-X鍵的HOMO軌道反應,這肯定是不正確的。可是,現行的有機化學教科書中卻都是這樣來描述的。我們都知道:兩個物質之間的反應,一定是一個物質的HOMO軌道與另一個物質的LUMO軌道反應。只有這樣,HOMO軌道中的一對電子填充在新形成的能量較低的成鍵軌道中,而新形成的能量較高的反鍵軌道是空的,反應后體系能量較低,反應才可以發生。如果是兩個物質的HOMO軌道發生反應,這兩個HOMO軌道中的兩對電子將分別填充在新形成的成鍵和反鍵軌道中,反應將無法發生。兩個物質的LUMO軌道也無法反應,因為兩個LUMO軌道中都沒有電子,沒有電子可以填充在新形成的成鍵軌道中,成鍵軌道中沒有共享的電子對,該化學鍵也就沒有形成。脂肪SN2反應過程的正確描述應該是:親核試劑的HOMO軌道進攻鹵代烷C-X鍵的反鍵軌道,即鹵代烷的LUMO軌道,從而在親核試劑與碳原子間形成新的化學鍵,原來的C-X鍵則發生斷裂。即該親核取代反應過程涉及2個化學鍵,親核試劑帶有孤電子對的HOMO軌道從鹵代烷C-X鍵空的反鍵軌道σ*C-X的外端進攻,才能實現軌道系數大的軌道有效重疊,在親核試劑與碳原子間形成新化學鍵[4];同時,原來的σC-X鍵拉長發生斷裂(圖1)。同時也說明了親核試劑之所以從背面進攻,是由于軌道的有效重疊。
鹵代烷雙分子消除反應(E2)的分子軌道描述如下:堿OH-進攻C-X鍵鄰位碳原子的C-H鍵的反鍵軌道σ*C-H,接近形成O-H鍵,同時C-H鍵和C-X鍵拉長。此時,相鄰2個碳原子的p軌道已經接近形成π鍵。由于這兩個p軌道要形成C=C鍵的π鍵,因此它們必須在一個平面內,才有利于π鍵的形成。這就是為什么E2消除要求消除的氫原子和鹵素原子要反式共平面的原因(圖2)。
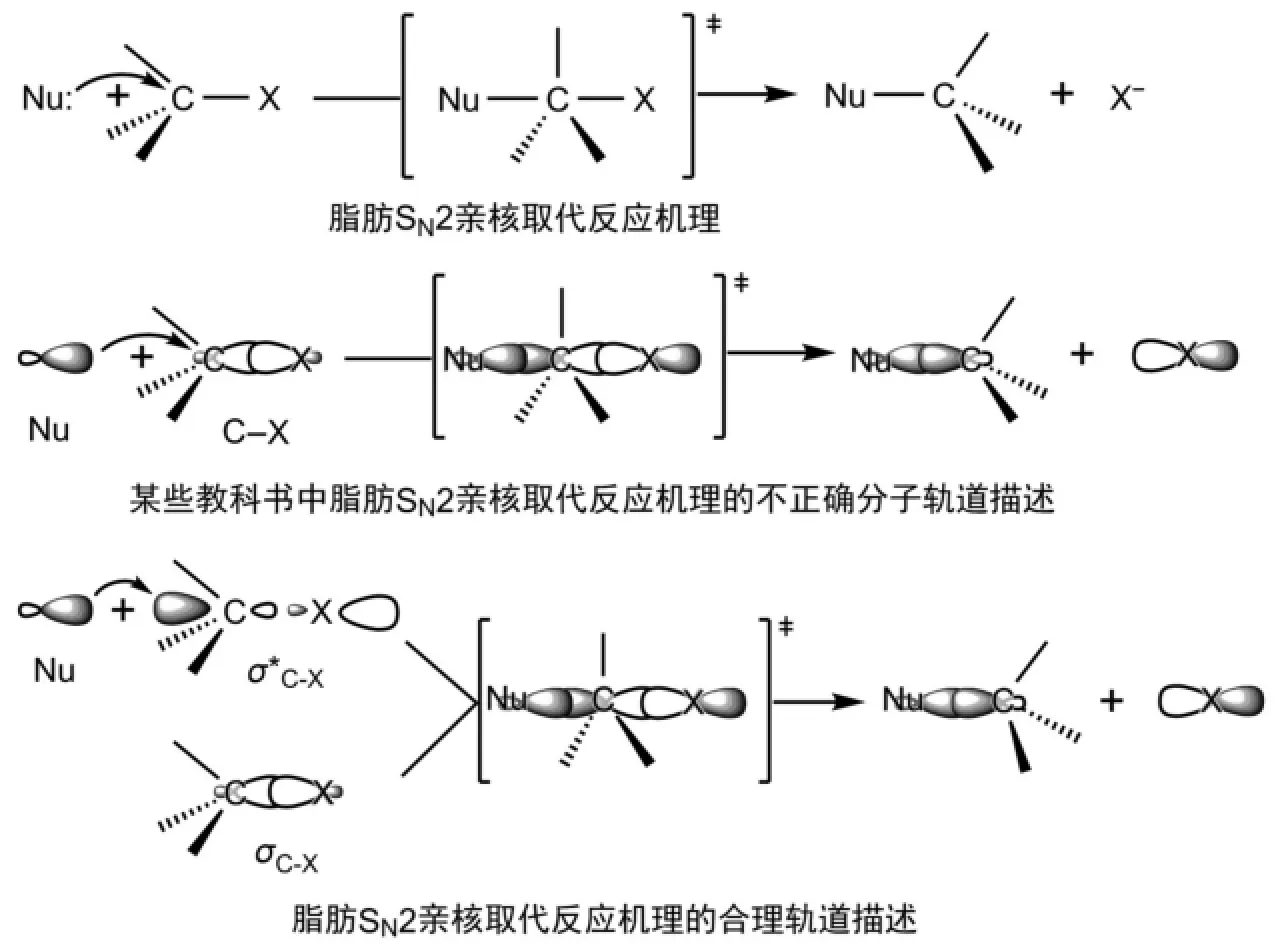
圖1 脂肪SN2反應過程的分子軌道描述
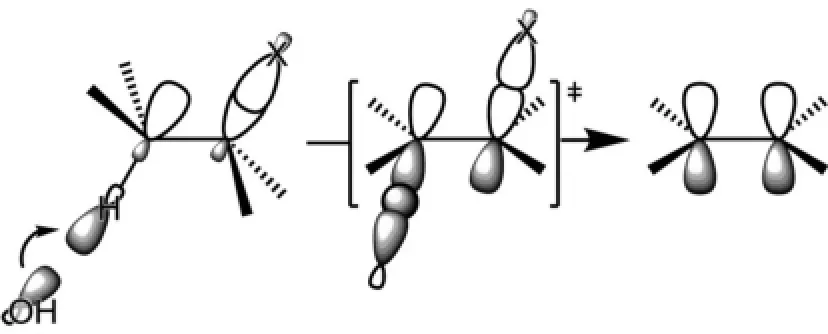
圖2 雙分子消除反應的分子軌道描述
溴對烯烴的親電加成是由溴分子異裂生成的溴正離子的LUMO軌道與C=C鍵的π鍵HOMO軌道相互作用,該相互作用由于溴原子比較大有利于形成三元環狀的環丙溴正離子中間體。然后,溴負離子作為親核試劑進攻C-Br鍵的反鍵軌道σ*C-Br,在親核試劑Br-與碳原子間形成新化學鍵,同時,被進攻的σC-Br鍵拉長發生斷裂,從而三元環打開,實現溴對烯烴的加成。從反應過程就可以看出,生成的鄰-二溴產物一定是反式加成產物(圖3)。
鹵化氫對烯烴的親電加成就是氫離子先與C=C鍵的π鍵HOMO軌道相互作用形成三元環狀中間體,由于氫離子太小,形成的三元環不穩定,很容易開環形成碳正離子。鹵素負離子對三元環開環得到反式-加成產物,而鹵素負離子對碳正離子的親核加成可以從p軌道的上下兩面進行,可以分別得到順式-和反式-加成產物,所以,該反應的反式選擇性并不好(圖4)。
在中性條件下,親核試劑(:NuH)對醛酮羰基的親核加成是親核試劑的HOMO軌道對羰基的LUMO軌道的加成,然后通過溶劑(通常是親核試劑本身)參與的質子化來實現的(圖5)。因為氫質子的[1,3]-遷移是軌道對稱性禁阻的。
酸催化的親核試劑(:NuH)對醛酮羰基的親核加成是質子首先與醛酮羰基的HOMO軌道發生親電加成,得到質子化的羰基,其會互變異構化成碳正離子(實質是以質子化的羰基和羥基碳正離子的雜化體形式存在),親核試劑再進攻碳正離子的LUMO軌道,得到質子化的加成產物,然后去掉氫質子得到產物(圖6)。
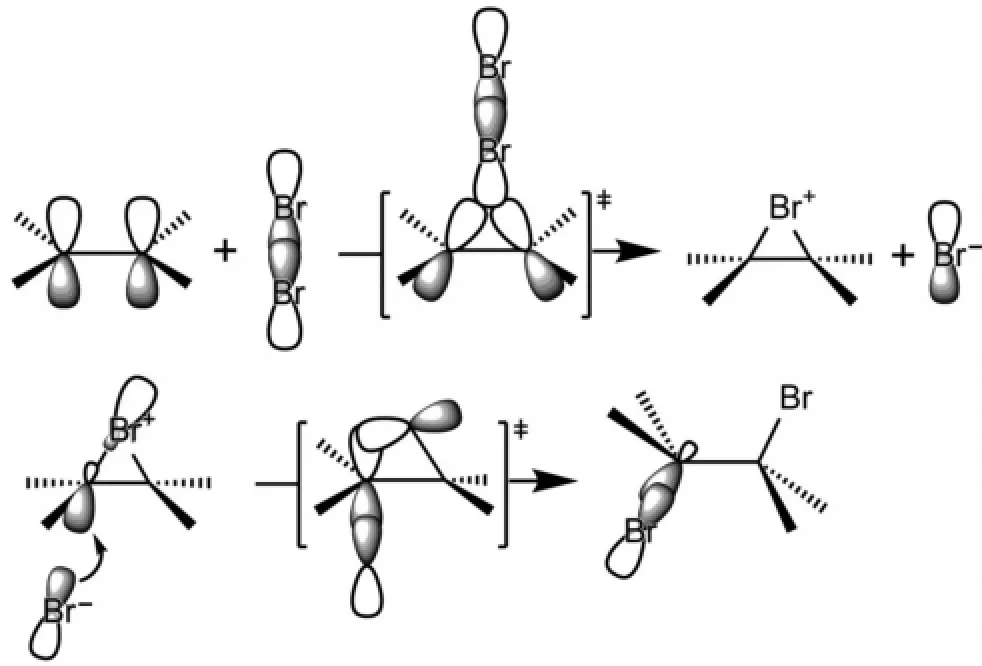
圖3 溴對烯烴親電加成反應機理的分子軌道描述
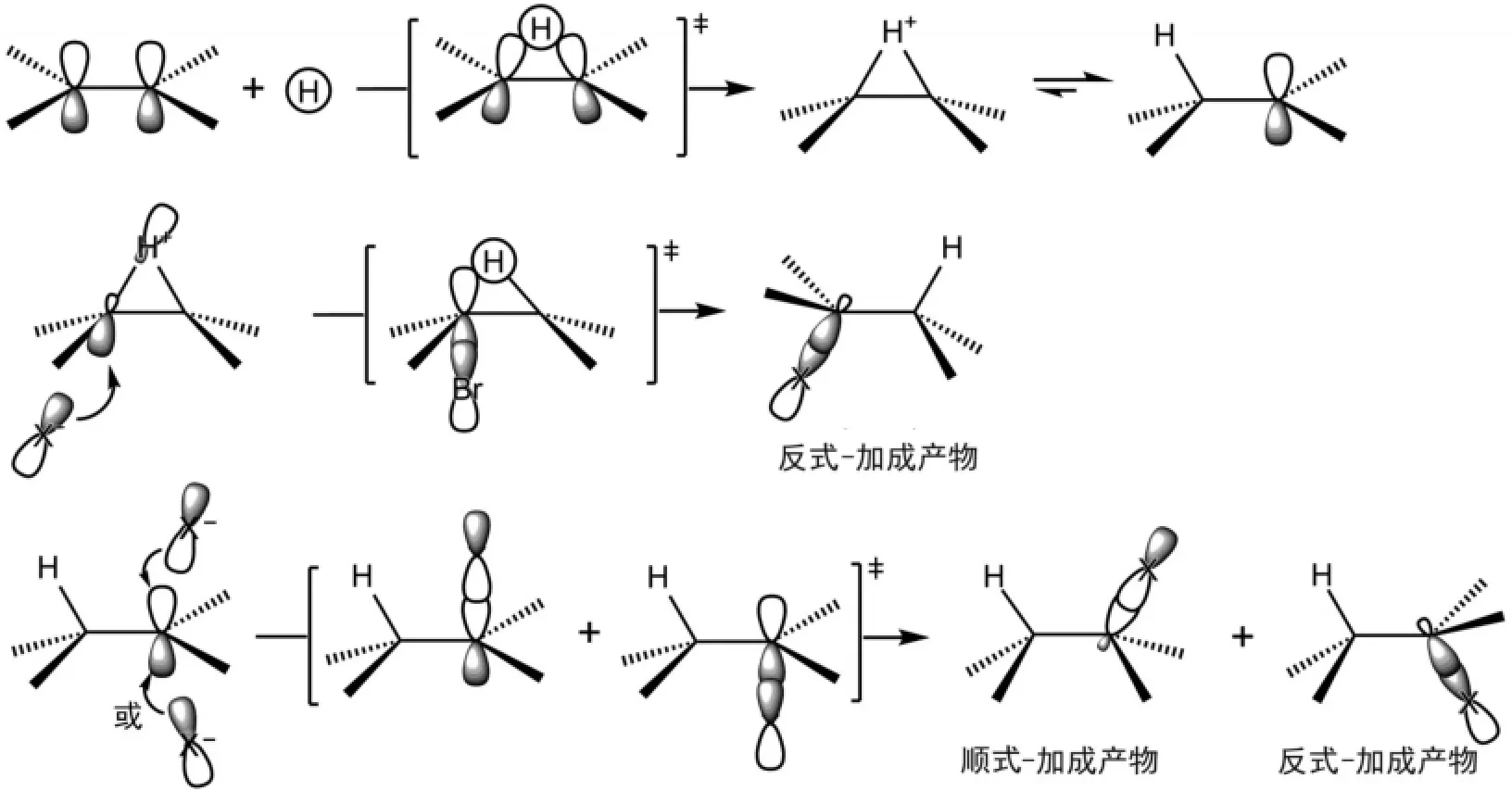
圖4 鹵化氫對烯烴親電加成反應機理的分子軌道描述
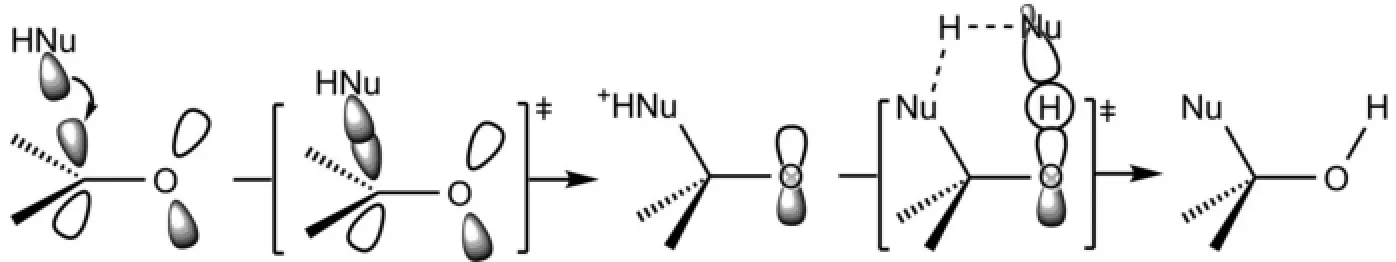
圖5 親核試劑對醛酮羰基親核加成反應機理的分子軌道描述
羧酸衍生物的相互轉化都是通過親核試劑(:Nu-)對羧酸衍生物羰基的親核加成-消除過程來實現的。親核試劑的HOMO軌道首先對羰基的LUMO軌道進行加成,得到四面體負離子中間體,該四面體中間體的C-O鍵發生旋轉,使容易離去的L基團與氧原子的p軌道處于同一平面上,然后發生消除反應,C-L鍵斷裂得到新的羧酸衍生物。對中性親核試劑參與的和酸催化的羧酸衍生物的轉化反應的分子軌道描述在此不再贅述(圖7)。
芳香親電取代反應的分子軌道描述是,親電試劑E+的LUMO軌道首先與苯環的HOMO軌道反應,形成環己二烯碳正離子中間體,苯環存在兩個軌道能量相同的簡并HOMO軌道,這里只選取其中的一個來討論,該中間體再發生C-H斷裂,得到芳香親電取代反應產物(圖8)。
芳香親核取代反應的分子軌道描述是,親核試劑Nu-的HOMO軌道首先與苯環的LUMO軌道反應,形成環己二烯碳負離子中間體,苯環存在兩個軌道能量相同的簡并LUMO軌道,這里只選取其中的一個來討論(苯環上的取代基對其不同碳原子的軌道系數是有影響的,這里只是定性描述,忽略了取代基對軌道大小的影響),該中間體再發生C-L斷裂,得到芳香親核取代反應產物(圖9)。
自由基取代和加成反應[3,12]、周環反應中的電環化和電開環、環加成反應以及σ遷移反應的分子軌道描述在很多教材和文章中都講述得非常清楚[5,13],在此不再贅述。本文討論了基礎有機化學中經典反應過程的分子軌道描述,希望能夠對教師授課和學生的學習和理解提供有益的幫助,為今后更好地利用分子軌道理論來解釋復雜有機化學反應奠定基礎。分子軌道理論不僅在解釋和預測許多化學反應上表現出了強大優勢,而且在指導有機合成等方面也顯示出很好的實用價值,因而其在有機化學中的應用具有非常重要的意義。
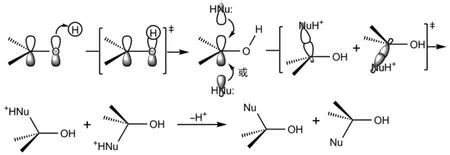
圖6 酸催化親核試劑對醛酮羰基親核加成反應機理的分子軌道描述
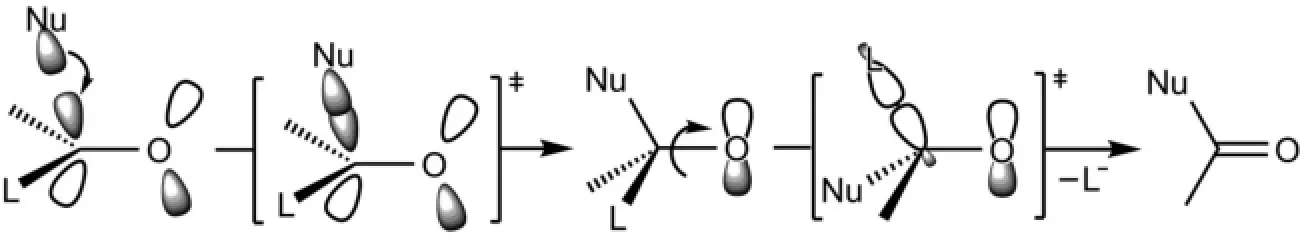
圖7 羧酸衍生物轉化的親核加成-消除反應機理的分子軌道描述
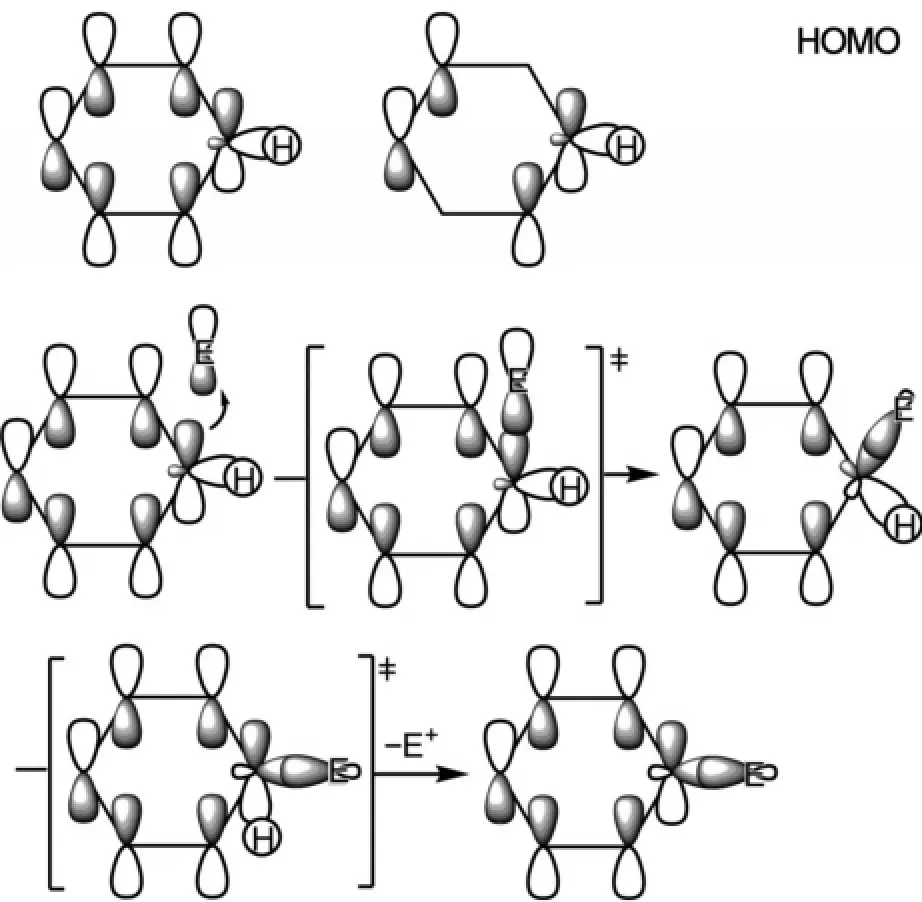
圖8 芳香親電取代反應機理的分子軌道描述
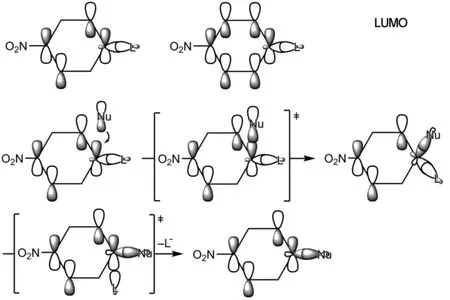
圖9 芳香親核取代反應機理的分子軌道描述
[1]Fukui,K.;Shing,H.J.Chem.Phys.1952,20,722.
[2] Fukui,K.;Yonezawa,T.;Shing,H.J.Chem.Phys.1954,22,1433.
[3]Volhardt,K.P.C.;Schore,N.E.Organic Chemistry,6th ed.;W.H.Freeman and Company:New York,2011;pp 228.
[4]McMurry.J.Organic Chemistry,8th ed.;Thomson Brooks Cole:New York,2011;pp 377.
[5]邢其毅,徐瑞秋,周政,裴偉偉.基礎有機化學.第2版.北京:高等教育出版社,2005:833-860.
[6]郭文生,劉鳳澡,袁履冰.大學化學,1992,7(1),17.
[7] 李篤.化學通報,1977,No.1,53.
[8]尚振海.有機反應中的電子效應.北京:高等教育出版社,1992:146.
[9]Wade,L.G.,Jr.Organic Chemistry,2nd ed.;Prentice Hall,Inc.:New York,1991;pp 178.
[10]李艷梅,趙圣印,王蘭英,羅自萍,李兆隴,黃志敏,麻遠.有機化學.北京:科學出版社,2011:142.
[11]伍越寰,李偉昶,沈曉明.有機化學.合肥:中國科技大學出版社,2002:246.
[12]Streitwieser,A.ACS Sym.Ser.2013,1122(Pioneers of Quantum Chemistry),275.
[13]虞忠衡.有機化學,1996,16,97.
Molecular Orbital Description on Several Classical Organic Reactions
XU WeiXU Jia-Xi*
(Department of Organic Chemistry,Faculty of Science,Beijing University of Chemical Technology,Beijing 100029,P.R.China)
It is very important to describe organic reaction processes with molecular orbitals,especially frontier orbitals,for correct and completely understanding of organic reaction mechanisms.Molecular orbital description can provide useful information on selectivity and stereochemistry of organic reactions.Molecular orbital descriptions on several classic organic reactions,including aliphatic and aromatic nucleophilic substitutions,electrophilic aromatic substitution,addition and elimination,are discussed.
Organic reaction;Molecular orbital;Nucleophilic substitution;Addition;Elimination
O621.1;G64
10.3866/PKU.DXHX201510006
,Email:jxxu@buct.edu.cn

