乳桿菌產抑菌活性物質與酵母菌DNA相互作用研究
陳忠軍,劉 靜
(內蒙古農業大學,食品科學與工程學院,內蒙古呼和浩特 010018)
?
乳桿菌產抑菌活性物質與酵母菌DNA相互作用研究
陳忠軍,劉靜
(內蒙古農業大學,食品科學與工程學院,內蒙古呼和浩特 010018)
本研究以具有抑酵母活性的乳桿菌ALAC-3和ALAC-4為研究對象,以白假絲酵母為指示菌,通過紫外光譜和熒光光譜法研究了乳桿菌所產抑菌活性物質與酵母菌DNA的相互作用機制。結果表明:酵母菌DNA與乳桿菌所產抑菌活性物質反應后,其紫外吸收值減小,產生了減色效應;隨著作用時間的延長,紫外吸收值增加,呈現增色效應。加入抑菌物質后,酵母菌DNA熒光強度降低。抑菌物質與EB-DNA復合體系反應后熒光強度降低,EB與抑菌物質-DNA復合體系反應后熒光強度增加,說明溶液體系存在抑菌物質-DNA與EB-DNA兩個復合體系競爭。
乳桿菌,抑酵母菌物質,DNA,紫外光譜法,熒光光譜法
酵母菌在很早以前就被廣泛應用于釀酒、食品、醫藥工業等。然而某些酵母菌可引起人和植物的病害[1],還有一些能夠引起食品的腐敗變質。乳桿菌不僅能抑制多種細菌的生長,也能產生抗真菌化合物,對真菌起到抑制作用[2-4]。目前對具抑細菌活性乳桿菌的研究工作已經有很大進展[5],但對于具抑真菌能力乳桿菌的研究還比較新,且主要集中在抑菌物質與真菌細胞膜作用方面。到目前為止,乳桿菌是否與真菌的染色體DNA發生作用尚不清楚[6]。因此,對具有抑酵母菌作用的乳桿菌進行深入研究,揭示其抑菌作用機理具有重大的理論意義,為天然食品防腐劑的開發及其利用奠定基礎。
1 材料與方法
1.1材料與儀器
乳桿菌從內蒙古傳統發酵食品中篩選出的2株乳桿菌ALAC-3、ALAC-4;指示菌白假絲酵母(Candidaalbicans)標準菌株,編號為32819,來自中國工業微生物菌種保藏管理中心。
MRS培養基蛋白胨10 g/L、牛肉浸膏10 g/L、酵母提取粉5 g/L、檸檬酸氫二銨2 g/L、無水乙酸鈉5 g/L、磷酸氫二鉀2 g/L、Tween 80 mL/L、硫酸鎂0.58 g/L、硫酸錳0.25 g/L、葡萄糖20 g/L,調節pH至6.5,121 ℃、20 min滅菌[7-8];YEPD培養基酵母提取粉10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,調節pH至6.0,115 ℃、20 min滅菌[6-8];0.1 mol/L Tris-HCl(pH7.4)稱取固體Tris 1.211 g于燒杯中,加入80 mL超純水,充分攪拌溶解。用濃HCl調節pH至7.4,然后定容至100 mL,高溫高壓滅菌后,室溫保存備用;溴化乙錠(10 mg/mL)。
SW-CJ-2FD型垂直凈化工作臺蘇州博萊爾凈化設備有限公司;LDZX-75KBS型立式壓力蒸汽滅菌器上海申安醫療器械廠;DPX-9002B-1/2型電熱恒溫培養箱上海福瑪實驗設備有限公司;KDC-140HR型高速冷凍離心機安徽中科中佳科學儀器有限公司;IKA?RV 10 digital型旋轉蒸發儀廣州儀科實驗室技術有限公司;T6型新世紀紫外可見分光光度計北京普析通用儀器有限責任公司;島津RF5301熒光分光光度計杭州英斯特科技有限公司。
1.2實驗方法
1.2.1乳桿菌抑菌物質的制備活化三代的乳桿菌擴培至MRS液體培養基中(37 ℃,24 h),將所得發酵液離心(4000 r/min,10 min),取上清液。再用旋轉蒸發儀對上清液進行濃縮至25倍,得到濃縮液留下備用。在濃縮液中加入適量的飽和硫酸銨溶液,放入4 ℃冰箱中放置過夜,取出后冷凍離心(4 ℃,8000 r/min,20 min),棄去上清液可得蛋白質沉淀粗提物。粗提物經初步純化后[15],得到蛋白質化合物作為抑菌物質,用滅菌蒸餾水配制成不同質量濃度的抑菌物質溶液,質量濃度分別為3×10-3、6×10-3、9×10-3g/mL,放入4 ℃冰箱中保存備用[5]。
1.2.2酵母菌DNA的提取采用玻璃珠法[9]提取酵母菌DNA。
1.2.3紫外光譜法檢測抑菌物質與DNA的相互作用在0.1 mol/L Tris-HCl緩沖液(pH7.4)介質中,將40 μL濃度為398.0 ng/μL的DNA與不同濃度的抑菌物質水溶液于30 ℃恒溫培養箱中避光反應3、6、12、24 h后,分別測其λ為220~320 nm范圍的紫外吸收光譜。
1.2.4抑菌物質與DNA結合的熒光光譜分別取各濃度的抑菌物質40 μL,與40 μL DNA溶液置于EP管中混合均勻,在0.1 mol/L Tris-HCl緩沖液(pH7.4)介質中測定熒光激發波長λex=310 nm,熒光發射波長λem為330~600 nm范圍的熒光光譜。
1.2.5抑菌物質對復合體系EB-DNA相互作用的熒光光譜EB溶液的配制:將濃度為10 mg/mL的EB 10 μL用超純水稀釋至2.5 mL,其最終濃度為79.8 μmol/L,置于棕色瓶中,4 ℃避光保存備用。分別取40 μL EB溶液和40 μL DNA溶液,置于EP管中混合均勻,于30 ℃恒溫培養箱中避光放置30 min,然后分別加入各濃度的抑菌物質40 μL,混合均勻,在30 ℃避光放置30 min。測定各反應體系熒光激發波長λex=310 nm,熒光發射波長λem為330~550 nm范圍的熒光光譜。
1.2.6EB對復合體系抑菌物質-DNA相互作用的熒光光譜分別取40 μL濃度為3×10-3g/mL的抑菌物質溶液和40 μL DNA溶液4份,置于EP管中混合均勻,于30 ℃恒溫培養箱中避光放置30 min,然后分別加入不同濃度的EB再次混勻,使得各反應體系中的EB濃度分別為0、19.95、39.90、79.80 μmol/L。測定各反應體系熒光激發波長λex=310 nm,熒光發射波長λem為330~550 nm范圍的熒光光譜。
2 結果與討論
2.1紫外光譜法檢測抑菌物質與DNA的相互作用
2.1.1不同濃度抑菌物質與DNA相互作用的紫外光譜將提取得到的白假絲酵母DNA與不同濃度的抑菌物質于30 ℃避光反應后,測定其紫外吸收光譜,結果見圖1、圖2。

圖1 ALAC-3產抑菌物質與DNA相互作用的紫外光譜Fig.1 UV absorption spectra of the interaction between DNA and different concentrations of antiyeast substance produced by ALAC-3

圖2 ALAC-4產抑菌物質與DNA相互作用的紫外光譜Fig.2 UV absorption spectra of the interaction between DNA and different concentrations of antiyeast substance produced by ALAC-4
從圖1和圖2可以看出,抑菌物質的加入使酵母DNA紫外吸收光譜發生了一定變化。最大吸收峰有紅移的趨勢,未加入抑菌物質時,ALAC-3的最大吸收峰在259 nm處,當抑菌物質濃度為0.009 g/mL時,其最大吸收峰由259 nm移到了261 nm。ALAC-4在未加抑菌物質時,最大吸收峰在258 nm處,當抑菌物質濃度為0.009 g/mL時,其最大吸收峰由258 nm移到了260 nm。且隨著抑菌物質濃度的增加,紫外吸收值明顯降低,產生了減色效應。而且ALAC-4紫外吸收值降低的程度高于ALAC-3,說明ALAC-4所產抑菌物質對酵母菌DNA的影響大于ALAC-3。
這可能是由于抑菌物質與DNA表面的磷酸基團作用,導致DNA主鏈電荷密度降低,DNA雙鏈繞性增大,結構趨于攏縮,從而構象發生變化,它的一部分發色團內陷,因此呈現減色效應[6]。
2.1.2抑菌物質與DNA相互作用不同時間的紫外光譜將白假絲酵母DNA與濃度為3×10﹣3g/mL的抑菌物質于30 ℃避光反應后,測定其紫外吸收光譜,結果見圖3、圖4。

圖3 ALAC-3產抑菌物質 與DNA相互作用不同時間的紫外光譜Fig.3 UV absorption spectra of the interaction between DNA and antiyeast substance produced by ALAC-3 at different time

圖4 ALAC-4產抑菌物質 與DNA相互作用不同時間的紫外光譜Fig.4 UV absorption spectra of the interaction between DNA and antiyeast substance produced by ALAC-4 at different time
由圖3和圖4可以看出,隨著作用時間的延長,紫外吸收值有逐漸升高的趨勢,產生了增色效應。圖3的最大吸收峰由265 nm移到了261 nm,圖4的最大吸收峰由260 nm移到了257 nm。
這可能是由于抑菌物質和DNA作用時間延長,抑菌物質不僅與DNA表面的磷酸基團發生了作用,而且抑菌物質可能部分結構嵌入DNA分子溝槽中,使DNA收縮的構象趨于松散,所以又發生增色效應[10]。
2.2抑菌物質與DNA結合的熒光光譜
按照1.2.4方法測定抑菌物質與DNA結合的熒光光譜,結果見圖5、圖6。

圖5 ALAC-3產抑菌物質與DNA相互作用的熒光光譜Fig.5 Fluorescence spectra of the interaction between DNA and antiyeast substance produced by ALAC-3

圖6 ALAC-4產抑菌物質與DNA相互作用的熒光光譜Fig.6 Fluorescence spectra of the interaction between DNA and antiyeast substance produced by ALAC-4
從圖中可以看出,ALAC-3和ALAC-4在未加抑菌物質的熒光光譜中,其最高熒光強度均為349 nm,且在掃描范圍內熒光強度呈現微弱的下降趨勢。加入抑菌物質后,隨著抑菌物質濃度的增加,熒光強度逐漸增強,各濃度的熒光光譜形狀相似且ALAC-3和ALAC-4的最高熒光強度分別在424 nm和423 nm處。ALAC-4熒光強度增加的程度高于ALAC-3,說明ALAC-4所產抑菌物質對酵母菌DNA的作用大于ALAC-3。
抑菌物質與DNA的結合主要有嵌入、溝槽結合和靜電作用[11-13]。嵌入可以導致熒光強度增強,當DNA與抑菌物質相互作用后,最高峰處的熒光強度明顯增強,說明抑菌物質與DNA發生了較強的結合作用。可能由于抑菌物質中的氨基酸殘基嵌入DNA雙螺旋鏈中與堿基對之間形成堆積效應或處于DNA作用面的疏水環境中,導致DNA熒光強度增強[9]。這與之前紫外光譜法的檢測結果相一致。
2.3抑菌物質對復合體系EB-DNA相互作用的熒光光譜
EB是一種靈敏度高、選擇性好的熒光探針,在水溶液中本身的熒光很弱,當它通過以較高的親合力、嵌入的方式與雙鏈DNA結合時,其熒光強度大幅度增強[14]。實驗測定了熒光激發波長為310 nm,熒光發射波長為330~550 nm范圍的熒光光譜,從而觀察抑菌物質對EB-DNA復合體系熒光強度的影響。結果見圖7、圖8。
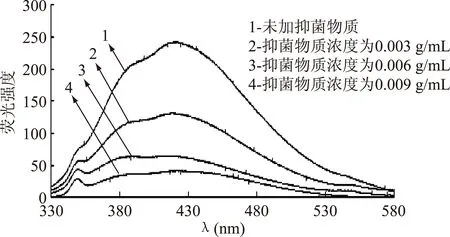
圖7 ALAC-3產抑菌物質 對復合體系EB-DNA相互作用的熒光光譜Fig.7 Fluorescence spectra of the interaction between EB-DNA and antiyeast substance produced by ALAC-3

圖8 ALAC-4產抑菌物質 對復合體系EB-DNA相互作用的熒光光譜Fig.8 Fluorescence spectra of the interaction between DNA and antiyeast substance produced by ALAC-4
由圖7和圖8可以看出,ALAC-3和ALAC-4的EB-DNA體系的熒光特征峰分別為425 nm和426 nm。在熒光特征峰處,隨著抑菌物質濃度的增加,熒光強度明顯降低且ALAC-4降低的幅度大于ALAC-3,說明ALAC-4所產抑菌物質取代EB進而與DNA結合的能力強于ALAC-3。
EB與DNA的結合的可能方式主要有:與帶負電荷的DNA骨架磷酸基團之間的靜電作用以及與DNA溝槽的嵌入作用。因此可以通過測定EB-DNA體系的熒光光譜來觀察熒光強度的變化,進而確定抑菌物質與DNA的結合方式[6]。這表明加入的抑菌物質與EB競爭結合DNA,抑菌物質取代了EB-DNA體系中的EB,從而使熒光強度降低[6]。這充分說明抑菌物質與酵母菌DNA發生了嵌入結合。
2.4EB對復合體系抑菌物質-DNA相互作用的熒光光譜
用不同濃度的EB與抑菌物質-DNA復合體系反應,從而研究了熒光光譜的變化。結果見圖9、圖10。

圖9 ALAC-3 EB對復合體系抑菌物質-DNA 相互作用的熒光光譜Fig.9 Fluorescence spectra of the interaction between EB and ALAC-3 antiyeast substance-DNA
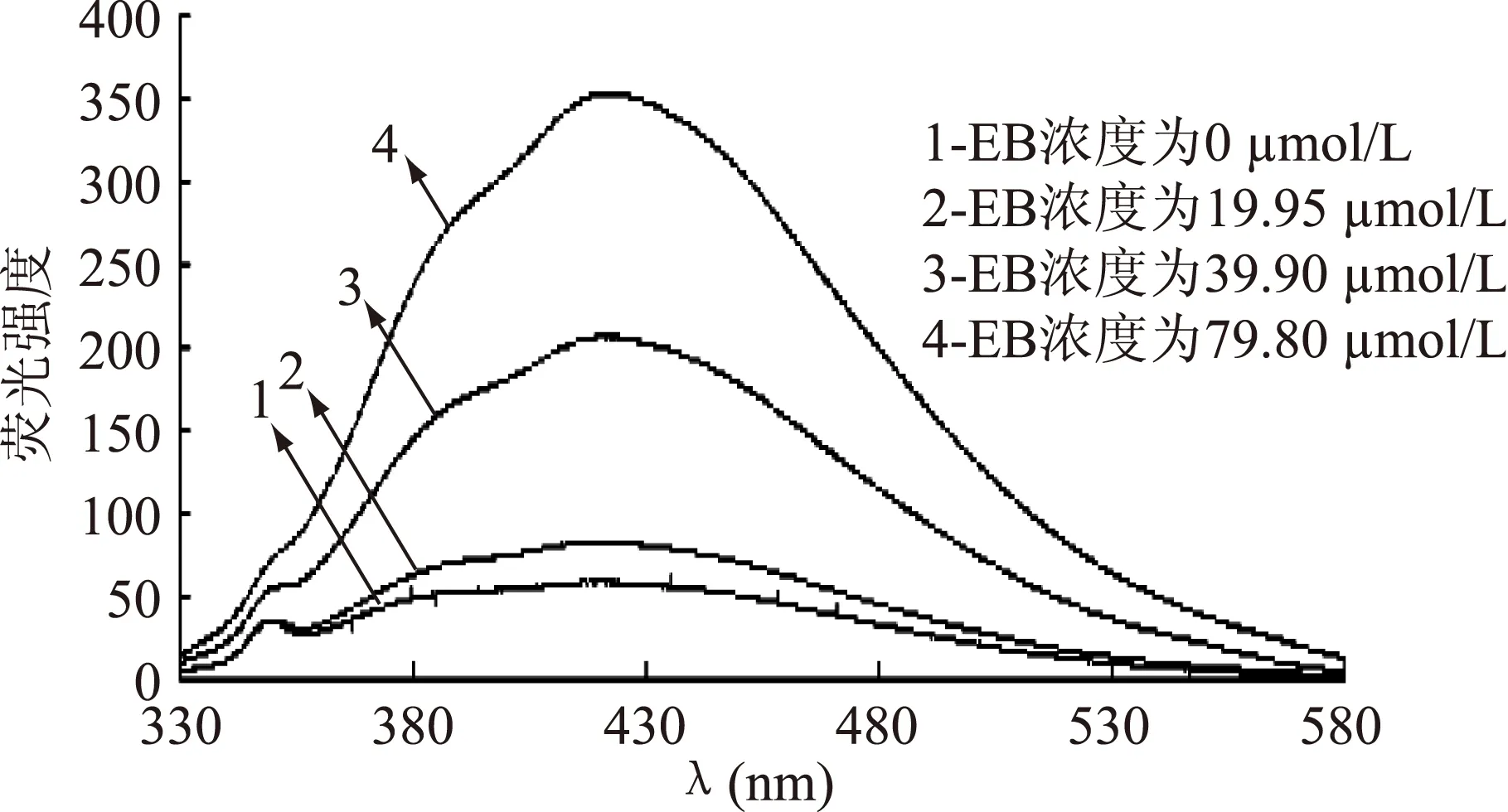
圖10 ALAC-4 EB對復合體系抑菌物質-DNA 相互作用的熒光光譜Fig.10 Fluorescence spectra of the interaction between EB and ALAC-4 antiyeast substance-DNA
從圖9和圖10中可以看到,隨著EB濃度的增大,抑菌物質-DNA復合體系的特征熒光峰逐漸升高,這表明EB逐漸取代了抑菌物質,形成了EB-DNA的復合體系,從而使熒光峰升高。結果說明了溶液體系存在抑菌物質-DNA與EB-DNA兩個復合體系競爭。
3 結論
本研究通過紫外光譜和熒光光譜法研究了乳桿菌所產抑菌活性物質與酵母菌DNA的相互作用機制,結果顯示乳桿菌所產抑菌物質可與酵母菌DNA發生相互作用。酵母菌DNA與乳桿菌所產抑菌活性物質反應后,其紫外吸收值減小,產生了減色效應;隨著作用時間的延長,紫外吸收值增加,呈現增色效應,說明抑菌物質與酵母菌DNA表面的磷酸基團通過靜電作用相結合,使DNA的空間構象發生變化,再進一步與DNA雙螺旋鏈的溝槽結合。抑菌物質與酵母菌DNA反應,其熒光強度降低,說明抑菌物質與酵母菌DNA之間存在嵌入作用。抑菌物質與EB-DNA復合體系反應,其熒光強度降低,說明抑菌物質取代EB與酵母菌DNA結合。EB與抑菌物質-DNA復合體系反應,其熒光強度增加,說明溶液體系存在抑菌物質-DNA與EB-DNA兩個復合體系競爭。通過紫外光譜和熒光光譜顯示,ALAC-4對酵母菌DNA的作用大于ALAC-3。
[1]何國慶,賈英民,丁立孝.食品微生物學[M].北京:中國農業大學出版社,2010:38-43.
[2]Gulahmadov S G,Abdullaeva N F,Guseinova N F,et al.Isolation and characterization of bacterioCin-like inhibitory Substances from lactic acid bacteria isolated from azerbaijan Cheeses[J].Applied Biochemistry and Microbiology,2009,45:266-271.
[3]宋宏霞,曾名勇,劉尊英,等.抗菌肽的生物活性及其作用機理[J].食品工業科技,2006,27(9):185-188.
[4]郭本恒. 益生菌[M].北京:化學工業出版社,2004:5-120.
[5]陳忠軍,李海瑄,高鶴塵.乳桿菌產生的抑菌活性物質對酵母細胞膜通透性的影響[J].中國乳品工業,2015,43(2):28-31.
[6]宮霞,施用暉,樂國偉.抗菌活性肽與細菌染色體DNA的相互作用機理[J].自然科學進展,2004,14(5):509-513.
[7]沈萍,范秀容,李廣武.微生物學實驗(第三版)[M].北京:高等教育出版社,1999:214-222.
[8]RE布坎南,N E吉本斯,等.伯杰細菌鑒定手冊(第八版)[M].北京:科學出版社,1984.
[9]戈海澤,郭剛,張瑞,等.玻璃珠法提取基因組DNA[J].天津醫科大學學報,2006,12(2):313-314.
[10]翟培,韓晉輝,侯麗霞,等.家蠅抗菌肽的抑菌動力學研究及其機理初探[J].中國生物工程雜志,2006,26(11):33-39.
[11]Erkkila KE,Odom DT,Barton JK Recognition and reaction of metallointercalators with DNA[J]. Chem Rev,1999,99(9):2777-2796.
[12]Zhang LZ,Tang GQ.The binding properties of photosensitizer methylene blue to herring sperm DNA:a spectroscopic study[J]. J Photochem Photobiol B,2004,74(2-3):119-125.
[13]Dong C,Wei YX,Wei YL. Study on the interaction between methylene violet and calf thymus DNA by molecular spectroscopy[J]. J Photochem Photobiol A,2005,174(1):15-22.
[14]S. Kashanian S,Askari F,Ahmadi K,et al. Tarighat,DNA Cell Biol,2008,27:581.
[15]陳忠軍,高鶴塵,李海瑄.乳桿菌代謝產生抑菌物質的特性研究[J].中國乳品工業,2015,43(3):11-14.
Study on unteraction mechanism of antiyeast substance produced by lactobacillus and the yeast DNA
CHEN Zhong-jun,LIU Jing
(Inner Mongolia Agricultural University,College of food science and Engineering,Hohhot 010018,China)
Two strains of lactobacillus ALAC-3 and ALAC-4 being of strong antiyeast ability were studied. TakingCandidaalbicansas the indicator strain,the interaction of antiyeast substance produced by lactobacillus and yeast DNA was investigated by ultraviolet spectrometry and fluorescence spectrometry. The results showed that the ultraviolet absorption value was decreased significantly and hypochromism were observed after adding anti-bacterial substances. With the extension of time,the ultraviolet absorption value was increased and hyperchromism were observed. The fluorescence intensity was decreased after adding anti-bacterial substances. When anti-bacterial substances and EB-DNA was reacted with each other,the fluorescence intensity was decreased significantly. And the fluorescence intensity was increased after EB and anti-bacterial-DNA was reacted. It indicated that there was the competition of anti-bacterial-DNA and EB-DNA in the solution system.
Lactobacillus;antiyeast substance;DNA;UV spectrometry;fluorescence spectrometry
2015-08-31
陳忠軍(1971-),女,博士,教授,從事食品微生物及發酵工程的研究,E-mail:nmndchen@126.com。
國家自然科學基金(31260390)。
TS201.3
A
1002-0306(2016)05-0159-05
10.13386/j.issn1002-0306.2016.05.022

