混合熔融Li2CO3-Na2CO3-K2CO3體系表面張力計算*
李建朝,齊素慈,許繼芳,王 璟,翁文憑
(1.河北工業職業技術學院材料系,河北石家莊050091;2.蘇州大學沙鋼鋼鐵學院)
混合熔融Li2CO3-Na2CO3-K2CO3體系表面張力計算*
李建朝1,齊素慈1,許繼芳2,王璟2,翁文憑2
(1.河北工業職業技術學院材料系,河北石家莊050091;2.蘇州大學沙鋼鋼鐵學院)
熔融碳酸鹽是一種良好的熱載體和反應介質,其表面張力直接影響反應體系中熔鹽分布和界面反應。在熔融鹽離子半徑和Butler方程的基礎上,建立了熔融混合碳酸鹽Li2CO3-Na2CO3-K2CO3體系的表面張力計算模型,考察了溫度和熔鹽組分對表面張力的影響。結果表明:模型計算的表面張力值與實際測量值比較吻合;熔融碳酸鹽純物質的表面張力隨著陽離子的靜電勢(Z/r)的增大而逐漸減小;Li2CO3-Na2CO3-K2CO3體系中,熔鹽的表面張力隨著溫度的升高而減小;混合熔融鹽表面張力隨著Li2CO3含量的增加而逐漸增大,隨著K2CO3含量的增加而逐漸減小。
熔融碳酸鹽;表面張力;模型;Butler方程
碳酸熔鹽是一種良好的熱載體和反應介質的離子型熔體,且價格便宜、熔點低、相變潛熱高、比熱大、對環境影響小,可廣泛應用于材料制備、催化反應、燃料電池等領域[1]。碳酸熔鹽常用體系為Li2CO3-Na2CO3和Li2CO3-K2CO3體系[2]。針對二元熔融碳酸鹽的基本性質如密度、表面張力、電導等的研究較多[3]。熔鹽密度決定能量轉換過程的能量密度,表面張力影響電解質在電池中隔膜和電極間的分配和電極界面反應效率,黏度影響熔融鹽在流動時的能量損失和反應物在融體內傳輸的傳質阻力,電導直接決定著燃料電池的輸出效率[4]。而且這些基本物理性質對理解熔體微觀結構、研究離子間作用力和熔鹽中離子運動規律和實際使用過程的高效利用具有重要意義。
Li2CO3、Na2CO3和 K2CO3的熔點分別為 996、1 124、1 164 K。在二元體系中添加其他碳酸鹽可形成低熔點共熔物,Li2CO3-Na2CO3-K2CO3作為最基本的三元體系受到廣泛重視[5]。該體系溫度范圍為670~1 174 K,混合熔鹽的物理性質變化范圍比較大,為熔鹽成分控制和性質優化提供了較大便利。J. Mohamedi等[6]研究了該體系作為燃料電池電解質時的氧溶解度和Warburg阻抗。S.G.Kim等[7]報道了Li2CO3-Na2CO3-K2CO3體系的相圖和蒸汽壓。但是,該體系的密度、表面張力和電導率數據比較缺乏,且物理性質與熔融組分之間關系的報道也很少。
表面張力是熔融鹽的基本特性,是表征液體性質的重要參數,其大小與溫度、界面兩相物質的性質有關[8]。可靠的物性數據是熔鹽作為傳熱蓄熱介質在工業中應用的重要前提,但高溫熔融下表面張力實驗測量比較困難,數據準確度不高,致使有關數據至今還很缺乏[9]。一種可行的解決途徑是建立合理的模型來對各種溫度和組分的熔鹽物理性質進行估算。因此,筆者基于熔融碳酸鹽離子結構和熔體表面張力的Butler方程,建立 Li2CO3-Na2CO3-K2CO3體系表面張力的計算模型,并將計算結果與實驗結果進行對比以驗證模型的準確性。在此基礎上,計算Li2CO3-Na2CO3-K2CO3三元體系及其二元子體系的表面張力,考察了溫度和熔鹽組分對表面張力的影響,以期為熔融碳酸鹽設計和優化提供數據支持和理論參考。
1 混合熔鹽表面張力計算模型
J.A.V.Bulter[10]根據化學勢和表面能推出了表面張力計算方程(Bulter方程):

式中,σA、σB、σA-B分別為純物質A、B和A-B二元系的表面張力;R、T分別表示氣體常數和絕對溫度;SA、SB分別表示純組元A、B的摩爾表面積;、分別表示組元A在表面和內部的活度;、分別表示組元B在表面和內部的活度。
基于上述基本理論,T.Tanaka等[8]將熔體中組元有效陰離子和陽離子半徑比作為模型參數來計算熔體表面張力。該模型考慮將組元的離子半徑比作為模型參數,采用純組元的表面張力和摩爾體積。其表達式:
1)ACO3-BCO3二元碳酸鹽體系:
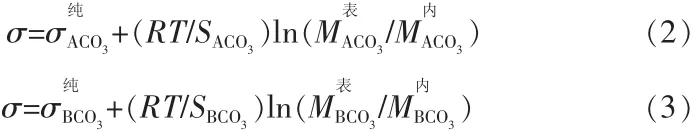
2)ACO3-BCO3-DCO3三元碳酸鹽體系:
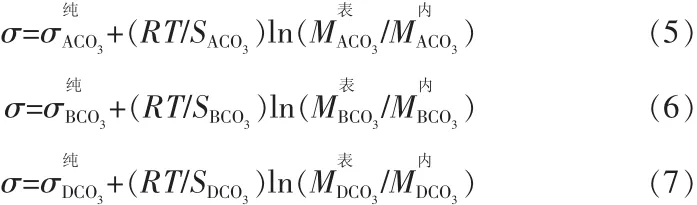

表1 陽離子半徑及碳酸根半徑 nm

表3 碳酸鹽純物質的表面張力與溫度的關系
另外,對于混合熔融鹽的物理性質,一般可運用Arrhenius混合規則來計算,以表面張力為例,計算方程如下:

式中,σi表示純物質組元i的表面張力,xi為純物質組元i的物質的量分數。
2 計算結果及討論
2.1二元體系表面張力計算結果
1 073 K和 1 123 K下Li2CO3-Na2CO3、Li2CO3-K2CO3和Na2CO3-K2CO3二元體系表面張力的計算結果如圖1~3所示。由于Na2CO3和K2CO3的熔點高于此溫度值,因此模型采用的純物質熔融鹽的物理性質數據(如物質的量分數和表面張力)由實驗數據與溫度的關系外推得到。為了驗證計算結果的準確性,相關二元體系的測量結果也如圖1~3所示。
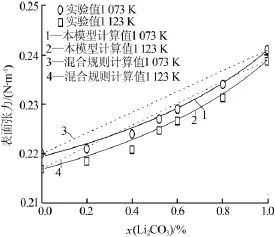
圖1 Li2CO3-Na2CO3二元碳酸鹽體系的表面張力
對比模型計算值與實際測量值表明,本模型計算結果與實驗測量結果完全吻合,熔鹽表面張力隨溫度和組分的變化關系完全一致,從而驗證了模型的正確性。二元體系中,隨著溫度的升高,熔鹽表面張力逐漸減小;隨著Li2CO3含量的增加,熔鹽表面張力逐漸增大;隨著K2CO3含量的增加,熔鹽表面張力逐漸減小。通過Arrhenius混合規則計算出的混合碳酸鹽的表面張力結果也如圖1~3所示。結果顯示,混合規則計算出的混合碳酸鹽表面張力隨著熔融組分的變化而呈現線性變化,且與實際測量結果偏離較大,混合規則計算值偏高。
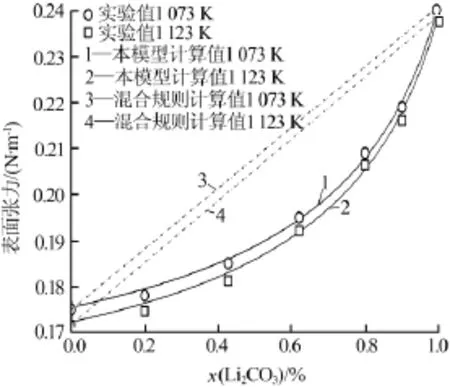
圖2 Li2CO3-K2CO3二元碳酸鹽體系的表面張力

圖3 Na2CO3-K2CO3二元碳酸鹽體系的表面張力
2.2三元體系表面張力計算結果
采用模型計算了Li2CO3-Na2CO3-K2CO3三元體系表面張力。圖4為1 073 K和1 123 K條件下由計算結果繪制的三元體系等表面張力線。為了驗證計算結果的準確性,相關的實驗測量結果也在圖4中做了標注[11]。對比模型計算值與實際測量值發現,本模型計算結果與實驗測量結果基本一致,進一步證明本模型可應用于熔融碳酸鹽表面張力計算。Li2CO3-Na2CO3-K2CO3三元體系中,熔鹽的表面張力隨著溫度的升高逐漸減小;隨著混合熔融鹽表面張力Li2CO3含量的增加而逐漸增大,隨著K2CO3含量的增加而逐漸減小。
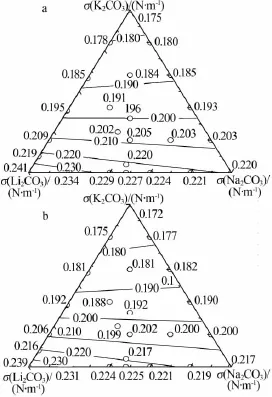
圖4 三元碳酸鹽體系中計算的等表面張力線
2.3結果討論
1)熔鹽性質與熔體中離子的靜電勢(Z/r)大小有關。在Li2CO3-Na2CO3-K2CO3三元熔融碳酸熔鹽中,陰離子均為CO32-,因而熔鹽性質與陽離子的靜電勢大小密切相關,其中陽離子的靜電勢大小關系為Li+>Na+>K+。1 073 K和1 123 K溫度下熔融碳酸鹽純物質表面張力與陽離子靜電勢的關系見圖5。
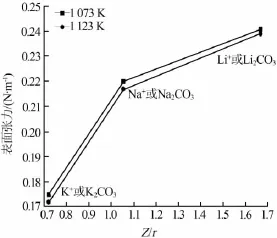
圖5 碳酸鹽純物質表面張力與陽離子靜電勢的關系
熔融鹽表面張力與離子間的作用力有關,在其他條件相同時,熔融鹽中陽離子半徑越大,陽離子的靜電勢越小,則熔融鹽的表面層中聚集的離子數量就越少,因此熔體內部的離子對表面離子的吸引力越小,從而熔融鹽表面張力也越小。因而熔融碳酸鹽純物質的表面張力隨著Li+、Na+、K+靜電勢的減小而增大。
2)混合熔融鹽的物理性質估算時,常運用Arrhenius混合規則來計算。但是混合熔融碳酸鹽二元體系的實驗結果顯示,該體系中熔融鹽表面張力與組分含量的關系并不符合簡單的混合法則,即隨著體系中某一組元含量的改變,熔融鹽表面張力并不呈現單調性變化。因此,在混合熔融碳酸鹽物理性質估算時,不適合僅采用簡單的混合規則對混合熔融鹽的物理性質進行估算。
3)熔融鹽的易得性和成本也是熔融鹽應用時需要考慮的環節,3種碳酸鹽的商業價格由高到低依次為Li2CO3>K2CO3>Na2CO3[12]。雖然LiNO3的加入能夠顯著降低熔融鹽的表面張力,但是考慮到實際使用的成本,在滿足應用要求的前提下,實際使用時應盡量降低Li2CO3的含量。
4)本模型計算時,由于熔融碳酸鹽純物質的熔點一般高于混合熔融鹽使用的溫度,因此計算使用溫度下混合熔融鹽的表面張力時,需對已有純物質的實驗數據進行合理的外推,但這也可能為模型計算結果帶來一定的誤差。考慮到多元體系表面張力實驗測量的范圍和難度,且實驗中二元體系及三元體系的模型計算結果與實際測量結果基本一致,因此本模型可對熔融碳酸鹽表面張力進行估算。鑒于本模型在多元熔鹽體系中較為成功的應用[8],本模型可推廣到多元熔融碳酸鹽表面張力的計算,以期為高溫熔融碳酸鹽的實際應用提供較為準確的表面張力數據,也為多元熔融碳酸鹽設計和優化提供數據支持和理論參考。
3 結論
1)在熔融鹽離子半徑和Butler方程的基礎上,建立了Li2CO3-Na2CO3-K2CO3體系表面張力計算模型,且模型計算結果與實際測量值比較吻合。
2)熔融碳酸鹽純物質的表面張力與陽離子的靜電勢(Z/r)大小密切相關,表面張力隨著靜電勢的減小而逐漸增大。
3)Li2CO3-Na2CO3-K2CO3體系中,熔鹽表面張力隨著溫度的升高逐漸減小,隨著混合熔融鹽中Li2CO3含量的增加而逐漸增大,隨著K2CO3含量的增加而逐漸減小。
[1]趙倩,王俊勃,宋宇寬,等.熔融鹽高儲熱材料的研究進展[J].無機鹽工業,2014,46(11):5-8.
[2]尹輝斌,丁靜,楊曉西,等.碳酸熔鹽傳熱蓄熱材料的制備與熱性能[J].工程熱物理學報,2013,34(5):952-956.
[3]Kojima T,Miyazaki Y,Nomura K,et al.Electrical conductivity of molten Li2CO3-X2CO3(X:Na,K,Rb,and Cs)and Na2CO3-Z2CO3(Z:K,Rb,and Cs)[J].J.Electrochem.Soc.,2007,154(12):F222-F230.
[4]辛嘉余,王華,何方,等.幾種碳酸鹽熔融體的粘度計算[J].工業加熱,2006,35(1):22-24.
[5]廖敏,丁靜,魏小蘭,等.高溫碳酸熔鹽的制備及傳熱蓄熱性質[J].無機鹽工業,2008,40(10):15-17
[6]Mohamedi M,Hisamitsu Y,Uchida I.Ternary alkali carbonate composition-oxygen solubility relationship under atmospheric and pressurized conditions-A utility model for MCFC[J].J.Appl.Electrochem.,2002,32(1):111-117.
[7]Kim S G,Jun J H,Jun J H.Predictions of the optimum ternary alkali-carbonate electrolyte composition for MCFC by computational calculation[J].J.Power Sources,2006,160(2):805-810.
[8]Tanaka T,Kitamura T,Back I A.Evaluation of surface tension of molten ionic mixtures[J].ISIJ Int.,2006,46(3):400-406.
[9]Raade J,Padowltz D.Development of molten salt heat transfer fluid with low melting point and high thermal stability[J].J.Sol.Energy Eng.,2011,33(3):91-96.
[10]Butler J A V.The thermodynamics of the surfaces of solutions[J]. Proc.R.Soc.A,1932,135:348-375.
[11]Kojima T,Miyazaki Y,Nomura K,et al.Density,surface tension,and electrical conductivity of ternary molten carbonate system Li2CO3-Na2CO3-K2CO3and methods for their estimation[J].Journal of The Electrochemical Society,2008,155(7):F150-F156.
[12]丁晶,魏小蘭,彭強,等.中高溫傳熱蓄熱材料[M].北京:科學出版社,2013.
聯系方式:wlzcn15@163.com
Evaluation of surface tension for molten Li2CO3-Na2CO3-K2CO3system
Li Jianchao1,Qi Suci1,Xu Jifang2,Wang Jing2,Weng Wenping2
(1.Material Department,Hebei Institute of Vocational and Technique,Shijiazhuang 050091,China;2 Shagang School of Iron and Steel,Soochow University)
Molten carbonate salt is a good thermal carrier and reaction medium.Surface tension directly affects the interfacial reaction and the distribution of molten salt in reaction system.On the basis of the ionic radii of the components and Butler′s equation,a calculating model is developed for determining the surface tension of the molten Li2CO3-Na2CO3-K2CO3carbonate ternary system.The effects of temperature and composition on surface tension of molten salt were investigated.Compared with the calculated values of surface tension as well as the data available in the literature,the results showed that the present model was working well.The surface tension of the pure molten carbonate decreased with increasing the electrostatic potential of cations in molten salt.The surface tension in Li2CO3-Na2CO3-K2CO3system increased with in increasing of the Li2CO3content.And with the increasing of the K2CO3content,the surface tension decreased.
molten carbonate;surface tension;model;Butler equation
TQ127.13
A
1006-4990(2016)05-0016-04
河北省教育廳青年基金項目(QN2015252)、國家自然科學基金資助項目(50874072,51204115)、蘇州大學大學生創新創業訓練計劃項目(2014xj044)。
2015-12-24
李建朝(1979—),男,博士研究生,主要從事無機鹽物理性質研究,已公開發表文章6篇。
齊素慈

