基于“物質轉化觀”的元素化合物教學
田長明
摘要:以“奇妙的碘”為例,從化學反應的本質、反應的條件、性質的差異及化學性質的應用四個層面就如何培養學生的“物質轉化觀”進行了嘗試。
關鍵詞:反應本質;反應條件;性質差異;性質應用;物質轉化觀
文章編號:1005–6629(2016)7–0047–03 中圖分類號:G633.8 文獻標識碼:B
“物質轉化觀”是化學學科觀念之一,化學的核心問題是物質及其相互轉化,化學科學認識活動對其基本問題“物質及其轉化”的認識,一是探尋“物質及其轉化”基本規律,二是建構“物質及其轉化”的科學理論。
如何培養學生的“物質轉化觀”?2015年10月30日,蘇州市高中課改展示課在昆山震川中學舉行,筆者上了一節高三化學的研討課,課題是“奇妙的碘”。筆者以這節課為案例,談談自己在這方面的做法。
鹵族元素的性質具有相似性,又具有遞變性。相似性:因為鹵族元素原子最外層都有7個電子,所以都易得到一個電子而達到8電子穩定結構,所以它們的單質都表現為較強的氧化性和較強的活潑性,都能與氫氣、水、堿發生反應。鹵化氫的水溶液均顯酸性,除HF為弱酸外,其余均為強酸。除F-外,Cl-、Br-、I-均與Ag+生成AgX沉淀,且不溶于稀硝酸。遞變性:鹵族元素原子的核外電子層數依次增大,原子半徑依次增大,核對核外電子的吸引力依次減小,所以得到電子的能力也就依次減小,它們單質的氧化性和活潑性依次減小,與氫氣、水、堿反應的程度依次減弱,陰離子的還原性逐漸增強等。
另外蘇教版教材中對碘的特性和用途的描述簡要如下:
(1)碘單質是紫黑色的固體,易升華。
(2)淀粉遇碘溶液變成藍色,該性質可用于檢驗碘單質的存在。
(3)在水溶液中碘離子能與銀離子反應,生成難溶于水和稀硝酸的黃色碘化銀沉淀。實驗室常用硝酸銀和稀硝酸來檢驗I-。
(4)碘和碘的化合物在生產和生活中有廣泛的應用。碘是一種重要的藥用元素,含碘食品的生產也需要碘元素,碘化銀可用于人工降雨[1]。
通過比較,我們不難發現,碘的性質既有著鹵族的通性,又有著自己鮮明的特性。這些都是我們在教學過程中探究含碘物質轉化現象及其規律的重要抓手。
1 探究有關化學反應的本質
[情境]播放電視劇《懸崖》片段
女地下工作者拿出一瓶藥水,拆開一本教科書的紙質書套,用毛筆蘸些藥水在書套背面來回地涂,一行行藍色的字跡便顯現出來。畫外音:“你已經被監視,老武已受到懷疑,明天我把孩子接走,你伺機脫身,他要你把狗處理好。另外,明天晚上之前,他們不會動手,保重!”
[問題1]那瓶藥水的主要成是什么,為什么蘸著藥水涂在書套的背面,會有藍色的字跡顯現?
這個問題學生回答得很好,他們認為藥水的主要成分是碘水,書套背面是用米湯寫的字,米湯干了后字就觀察不到了。書套用碘水涂后,因為米湯的成分有淀粉,淀粉遇碘水會變藍色。
[問題2]碘遇淀粉一定變藍嗎?
學生認為碘遇淀粉一定變藍。筆者沒有直接說錯還是對,而是做了下列兩則演示實驗:
演示實驗1:在試管中加入少許淀粉,往其中加入2毫升酒精后振蕩,再向試管中滴加碘酒2~3滴,觀察實驗現象。
演示實驗2:在試管中加入少許淀粉,往其中加入2毫升蒸餾水后振蕩,再向試管中滴加碘酒2~3滴,觀察實驗現象。
[問題3]通過上述實驗不難發現,淀粉中加酒精,再加碘酒,無現象。而淀粉中加蒸餾水,再加碘酒,淀粉溶液會變藍。這是什么原因呢?
筆者進一步引導學生思考,上述兩則實驗的區別在于在淀粉中加了不同的溶劑,其中酒精與碘不會發生反應,而水會和碘發生反應生成I-離子。實驗證明淀粉遇碘變藍必須有I-離子存在,并且I-離子的濃度越高則顯色的靈敏度也越高。
學生實驗1:在淀粉溶液中滴加碘水,將溶液稀釋20倍左右,取兩支試管各加入2mL左右稀釋后的溶液,在其中一份中滴加少量KI固體,對比兩份溶液的顏色,發現滴加KI固體的那份溶液的藍色明顯加深(如圖2)。
[學習資料]
在化學實驗中常用碘遇可溶性淀粉呈深藍色的反應,這“反應”的實質是直鏈淀粉的螺旋狀柱形剛好能容納碘鉆入并吸附成包合物(如圖 3)[2]。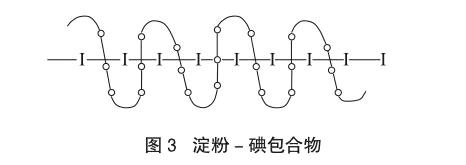
2 研討有關化學反應的條件
有人說:“化學反應條件的控制是實驗的靈魂。”認識反應條件對化學反應的影響,對學好化學具有重要意義。我們知道在不同的反應條件下,化學反應的速率可能不同;在不同的反應條件下,反應產物也有可能不同;反應條件還可以控制反應能否發生和化學反應的方向。因此在研究化學反應的過程中,必須強調條件的影響。為此筆者設計了如下問題。
[問題4]碘遇淀粉溶液一定變藍嗎?
學生對這個問題不置可否,筆者做了第3個演示實驗。
演示實驗3:取一支試管將演示實驗2加碘酒后的淀粉溶液一分為二,取其中一份逐滴加入氫氧化鈉溶液。將另一份放在酒精燈上加熱,觀察實驗現象,再將試管中的混合液冷卻,觀察實驗現象(如圖4)。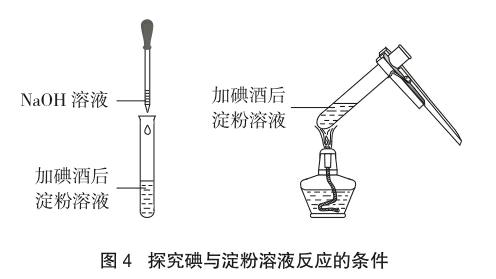
通過演示實驗3學生可以觀察到在加碘酒后的淀粉溶液中逐滴加入氫氧化鈉溶液,試管中溶液的藍色會逐漸褪去;將加碘酒后的淀粉溶液在酒精燈上加熱,藍色也會褪去,冷卻后藍色復現。endprint
學生感到很奇怪,仔細一想,加堿溶液,藍色褪去可以理解,因為碘在堿性條件下可以發生歧化反應。但加熱為什么會褪色,冷卻后藍色又復現呢?筆者提供了下列資料。
[學習資料]
碘遇淀粉變藍色與淀粉的復雜結構有關,加熱后,淀粉分子鏈伸直,所以藍色會褪去,冷卻后,淀粉分子恢復為螺旋狀,因此藍色復現。
通過演示實驗3我們可以得出淀粉溶液遇碘變藍是有條件的,它會受到溫度和酸堿度的影響,在堿性或加熱的條件下,藍色會褪去。
3 比較鹵族元素化學性質的差異
鹵族元素的性質既有相似性,又有遞變性。我們教學中可以多利用對比分析的方法,會使各鹵族元素的性質及其化合物的性質由于結構的相似而體現相似的性質,又由于結構的差異而體現了性質的遞變性這一規律一目了然,也使雜亂的元素化合物知識變得系統化、規律化,從而提高課堂教學的效率。
筆者在教學中設計了下列兩個問題:
[問題5]在一定條件下,Fe在Cl2中燃燒生成Fe3Cl8,請問該化合物中Fe的化合價?
[問題6]將鐵粉與碘加水進行研磨反應劇烈,生成Fe3I8,即“滴水生煙”。請問“煙”是什么,該化合物中Fe的化合價?
對于問題5,學生很容易聯想到Fe3O4,Fe3O4可以看作FeO·Fe2O3,因此Fe3O4中Fe的化合價為+2、+3。Fe3Cl8也可以看作FeCl2·2FeCl3,Fe3Cl8中Fe的化合價同樣為+2、+3。
問題6學生容易不假思索地認為“煙”是Fe3Cl8,根據Fe3Cl8的組成類推Fe3I8的組成為FeI2·2FeI3,從而引起錯解。錯解原因是認為“煙”一定是產物,其實“煙”是碘蒸氣,是因為鐵粉和碘在水做催化劑的條件下劇烈反應放熱,使碘升華。另外學生還忽視了Fe3+的氧化性,Fe的化合價主要有Fe2+、Fe3+,但是Fe3+具有強氧化性,而I-具有強還原性,二者不能共存,發生反應:2Fe3++ 2I-=2Fe2++I2,因此Fe3I8可以看作為3FeI2·I2,Fe3I8中Fe的化合價應為+2。
學生動手做了如下實驗:
學生實驗2:在研缽中加入鐵粉和碘,充分研磨,將研磨后的粉末加入到試管中,向試管中滴少量水,可以發現試管上方出現紫色蒸氣。
學生實驗3:在試管中加入2mL FeSO4溶液,在其中加入幾滴KSCN溶液,先向其中滴加碘水,無現象,再向其中滴加氯水,溶液變成血紅色。
4 學會應用碘的化學性質
化學是一門自然科學,我們研究化學的目的就要利用化學為人類更好地服務。在課堂教學中,體現化學的應用價值是很重要的內容,我們要讓學生不僅能學到知識,更要學會如何運用知識來解決問題。
筆者在這節課上對碘的化學性質的應用,設計了如下問題。
[學生實踐]如何證明食鹽中含有碘元素?
我們常用的加碘食鹽的包裝袋見圖5,我們如何利用學到的知識來證明食鹽中含有碘元素,學生經過討論,提出了下列實驗步驟:
(1)在試管中加入少量食鹽;
(2)向試管中加入2mL蒸餾水,振蕩,直至食鹽溶解;
(3)向試管中滴加0.5mL KI溶液,振蕩;
(4)再向試管中滴加0.5mL稀硫酸,振蕩;
(5)最后向試管中加入少量淀粉。
在試管中加入淀粉后,如果溶液變藍,證明食鹽中含有碘元素。
美國課程專家艾里克森提出“觀念為本的課程與教學”,認為“提高學業標準更多的是要求思維能力的提高,而不是掌握更多的事實內容。……學習重心應該從記憶事實轉移到可遷移的核心觀念和對更為根本的知識結構進行深層理解,培養和發展思維能力”。從化學研究的對象看,最能體現化學學科特點和核心內容的觀念是:微粒觀、元素觀、轉化觀、結構觀和能量觀等,它們共同構成化學研究物質的認識視角。為此,我們應關注并圍繞這些觀念開展化學教學實踐。
參考文獻:
[1]王祖浩主編.普通高中課程標準實驗教科書·化學1[M].南京:江蘇教育出版社,2014:47.
[2]曾昭瓊.有機化學(下冊)[M].北京:高等教育出版社,2001:608.endprint

