電環化反應規律與教學實踐
楊 芬,張永伍
(1 曲靖師范學院化學化工學院,云南 曲靖 655000;2 曲靖市第一中學,云南 曲靖 655000)
?
電環化反應規律與教學實踐
楊芬1,張永伍2
(1 曲靖師范學院化學化工學院,云南曲靖655000;2 曲靖市第一中學,云南曲靖655000)
電環化反應是周環反應的一類,對于理解和掌握分子軌道理論非常有幫助,掌握了不同P電子的分子軌道形狀和能量,但快速準確得到電環化反應立體結構產物也是不易的。分子軌道是原子軌道的線形組合,采用前線軌道理論解釋電環化反應機理,并根據前線軌道對稱性判別反應中分子軌道的旋轉方式,從而得到立體專一性結構的產物。
周環反應;電環化;教學
在基礎有機化學教學中,有機化學反應類型包括自由基型反應、離子型反應和協同反應,協同反應又叫周環反應。周環反應具有很明顯的反應條件,如光照、加熱,不為酸堿催化,反應速度極少受溶劑影響,也與自由基引發劑或抑制劑無關,反應無中間體,共價鍵的斷裂和共價鍵的生成是同時進行的,往往經過一個環狀過渡態,是一步完成的多中心反應,并且反應物到產物常常形成立體專一的產物。學生在學習過程中,因為對分子軌道的形狀不是很熟悉,加之電環化反應是可逆反應,對環狀烯烴的π電子數不知如何計數,因此學生對所得產物的立體結構往往掌握得不好,筆者根據多年的教學實踐,利用前線軌道理論和分子軌道對稱守恒原理對電環化反應進行了描述,以期學生理解反應機理的前提下快速準確得到立體選擇性正確的產物。
1 電環化反應
1.1電環化反應的定義
在光或電的作用下,由鏈狀共軛多烯(π-π共軛)的端烯碳上π電子體系協同的環化,生成具有一個新的σ鍵和相應地減少兩個π電子的環狀烯烴體系的反應,或環狀烯烴開環變為共軛多烯烴(π-π共軛)的反應都稱為電環化反應。電環化反應除了反應條件是光照或加熱外,反應物生成產物時往往發生單鍵變雙鍵或雙鍵變單鍵的變化,這是周環反應形式上的明顯特征[1]。
1.2電環化反應的理論解釋
有機化合物的結構解釋中除了雜化軌道理論,還有分子軌道理論和共振論,而周環反應的理論解釋多用到分子軌道理論(另外還有芳香過渡態理論),按照分子軌道理論,當兩個原子軌道線形組合成分子軌道時,波數相同的原子軌道相互交疊(+與+或-與-交疊)形成成鍵軌道,波數相反的原子軌道相互交疊(+與-交疊)形成反鍵軌道[2]。共軛多烯烴的分子軌道是由SP2雜化的碳原子的P原子軌道先線形組合得到等同數目的分子軌道,每一個分子軌道都有形狀和能量,且每個分子軌道最多填充P電子數是2個,而每一個分子軌道得P軌道的位相都是有規律的排列進行軌道重疊得到分子軌道,以CH2=CH-CH=CH2和CH2=CH-CH=CH-CH=CH2為例[3],分析4個π電子(4n電子)和6個π電子(4n+2電子)的分子軌道,通常電環化反應主要跟前線軌道理論中的HOMO(Highest Occupied Molecular Orbital-被電子占據的最高能量的分子軌道)軌道有關。當π電子為4(4n電子)時,加熱即基態時HOMO軌道為π2分子軌道,光照即激發態時HOMO軌道為π3*分子軌道(LUMO軌道-最低未占分子軌道);當π電子為6(4n+2電子)時,基態時HOMO軌道為π3分子軌道,光照即激發態時HOMO軌道為π4*分子軌道(LUMO軌道),不論π電子是4(4n電子)或6(4n+2電子),因為是端烯兩個SP2碳的P軌道必須重疊成鍵,因此采取不同的旋轉方式,以使HOMO兩端具有相同波相的葉瓣交疊成鍵[4]。
加熱條件下,4個π電子的1,3-丁二烯分子HOMO為π2分子軌道,其形狀如下:
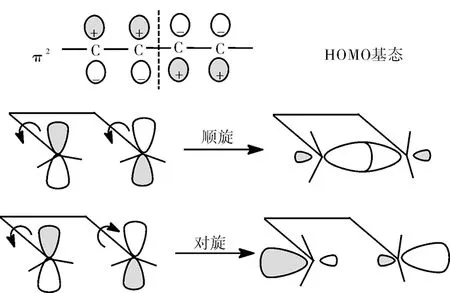
加熱條件下,6個π電子的1,3,5-己三烯的HOMO為π3分子軌道,其形狀如下:

所以加熱條件下,4個π電子的1,3-丁二烯順旋允許,6個π電子的1,3,5-己三烯對旋允許。
光照情況下,分子電子發生躍遷,處于激發態,此時4個π電子的1,3-丁二烯分子的HOMO軌道是基態時的LUMO軌道,即π3*分子軌道,其形狀如下:
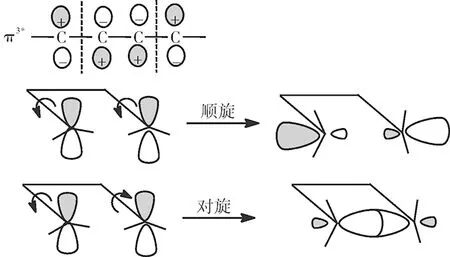
光照條件下,6個π電子的1,3,5-己三烯分子的HOMO軌道是基態時的LUMO軌道,即π4*分子軌道,其形狀如下:

所以光照條件下,1,3-丁二烯對旋允許,1,3,5-己三烯順旋允許。所以電環化反應的條件是加熱或光照都可以,π電子數計數時,如果是鏈狀共軛烯烴直接數π電子數,1,3,5-己三烯就是6個π電子;如果是一環狀烯烴,當兩個烯碳中間隔著三根單鍵時,這其實是共軛二烯經過一次電環化反應得到的,因此算π電子數時要看開鏈共軛二烯的π電子數,即把雙鍵兩側的單鍵變為雙鍵,而雙鍵變為單鍵,中間的單鍵使新形成的
不用考慮,這時就可知道π電子數;隔著4個單鍵時,其實分子本身就是一個共軛多烯,直接按鏈狀烯烴計算π電子數就可。

表1 電環化反應規律
例1:

解題分析:該反應物為一環狀烯烴,雙鍵兩個碳之間間隔三個單鍵,這其實是共軛二烯經過一次電環化反應得到的,因此算π電子數時要看開鏈共軛二烯的π電子數,即把雙鍵兩側的單鍵變為雙鍵,而雙鍵變為單鍵,即知為4nπ體系,加熱為基態,HOMO軌道為π2,加熱順旋;光照對應激發態;激發態時HOMO軌道為π3*,反應分子軌道旋轉方式為對旋。故反應的立體化學為順式(產物見上面)。
例2:

解題分析:該反應物為(4n + 2)π體系,加熱對應基態;基態時HOMO軌道為π3,反應分子軌道旋轉方式為對旋。故反應的立體化學為順式(產物見上面)。
2 結 論
對于電環化反應來說,不管是4nπ體系還是(4n+2)π體系,只涉及分子軌道中的HOMO軌道,只要把握住HOMO軌道的對稱性,即可判斷反應時分子軌道的旋轉方式,從而得出產物并確定相應的立體化學。
[1]朱萬仁.有機化學周環反應規律的探討與教學實踐[J].玉林師范學院學報,2013,34(2):59-61.
[2]孫金魚,趙三虎,趙明根.電環化和環加成反應規律初探[J].忻州師范學院學報,2014,30(5):1-5.
[3]高鴻賓.有機化學.5版[M].北京:高等教育出版社,2014:147-150.
[4]王積濤.有機化學.2版[M].天津:南開大學出版社,2003:566-583.
The Rules and Teaching of Electro Cyclic Reaction
YANG Fen1,ZHANG Yong-wu2
(1 College of Chemistry and Chemical Engineering,Qujing Normal University,Yunnan Qujing 655011;2 Qujing No.1 Middle School,Yunnan Qujing 655000,China)
The electro cyclic reaction is a kind of pericyclic reaction.It is very helpful to understand and grasp the molecular orbital theory.It is not easy to obtain the stereo-structure product although people have mastered molecular orbital shape and energy of different P electron.The two atomic orbital can linear combine and produce molecular orbital.The front orbital theory was applied to explain the mechanism of electro cyclic reaction,the rotating way of the molecular orbit was discriminated according the front orbital symmetry of molecular orbital,the stereospecificity product was obtained.
pericyclic reaction; electro cyclic reaction; teaching
O621.13
A
1001-9677(2016)06-0195-02

