右美托咪定預處理抑制腦缺血再灌注時谷氨酸的釋放及其受體機制研究*
尚宇,關雙成,李悅,高光潔(.解放軍第四六三醫院 麻醉科,遼寧 沈陽 004;.哈爾濱醫科大學附屬一院 麻醉科,黑龍江 哈爾濱 5000)
·論著·
右美托咪定預處理抑制腦缺血再灌注時谷氨酸的釋放及其受體機制研究*
尚宇1,關雙成1,李悅2,高光潔1
(1.解放軍第四六三醫院 麻醉科,遼寧 沈陽 110042;2.哈爾濱醫科大學附屬一院 麻醉科,黑龍江 哈爾濱 150001)
目的評價右美托咪定預處理對大鼠全腦缺血再灌注損傷時海馬谷氨酸(Glu)及其受體NMDAR 1 (NR 1)表達的影響。方法雄性Wistar大鼠90只,體重250~300g,采用隨機數字表法,將其分為3組(n=30):假手術組(S組)、全腦缺血再灌注組(I/R組)和右美托咪定組(D組),采用四血管阻斷法制備全腦缺血再灌注損傷模型。D組于全腦缺血前2h經尾靜脈注射右美托咪定3μg/kg,隨后以3μg/(kg·h)速率輸注120 min,I/R組給予等容量生理鹽水。應用Combs評分系統評價大鼠神經運動功能的缺損情況;采用腦微透析技術結合高效液相色譜(HPLC)檢測大鼠海馬細胞外Glu水平的變化;采用免疫組織化學方法檢測海馬CA1區NR 1蛋白表達。結果與S組比較,I/R組和D組大鼠平衡木和引繩肌力試驗評分下降(P<0.05),海馬細胞外Glu的水平增高(P<0.05),海馬CA1區NR 1表達上調(P<0.05);與I/R組比較,D組大鼠平衡木和引繩肌力試驗評分升高(P<0.05),海馬細胞外Glu的水平降低(P<0.05),海馬CA1區NR 1表達下調(P<0.05)。 結論 右美托咪定可減輕大鼠全腦缺血再灌注損傷,改善神經運動功能的缺損,其機制與抑制Glu釋放和下調NR 1表達有關。
右美托咪定;缺血/再灌注損傷;谷氨酸;N-甲基-D-天冬氨酸受體
神經外科、心臟及大血管圍手術期均有潛在腦缺血的危險,因此,術中如何最大程度預防和減輕腦缺血再灌注(ischemia/reperfusion,I/R)后的神經功能損傷備受關注。右美托咪定(dexmedetomidine,DEX)是一種新型的高選擇性腎上腺素α2受體激動藥,作為一種麻醉輔助用藥已經在臨床上廣泛應用。近年來,有動物實驗研究[1]發現右美托咪定能夠減輕實驗動物短暫性的整體或局部腦缺血后神經損傷,表明其具有神經保護功能,但機制尚不明確,推測其可能與降低兒茶酚胺水平、減少興奮性神經遞質釋放等有關。因此,本實驗在建立大鼠全腦缺血再灌注損傷模型基礎上,通過觀察模型大鼠功能行為學變化和谷氨酸(glutamate,Glu)及其受體NMDAR1 (N-methyl-D-aspartatereceptor,NR1)的演變規律,明確其對腦I/R損傷的保護機制,為預防和減輕圍術期腦缺血損傷提供新思路。
1 材料與方法
1.1主要儀器與試劑
CK-2倒置顯微鏡購自日本OLYMPUS公司,Metamorph顯微圖像分析系統購自美國Universal-Corp公司,Cryotome E冷凍切片機購自英國SHAN DON公司,江灣I型C大鼠腦立體定位儀購自第一軍醫大學,LC-10AD液相恒流泵和L-ECD-6A電化學檢測器購自日本Shimadzu公司,谷氨酸標準品購自SIGMA化學公司,右美托咪定購自江蘇恒瑞醫藥股份有限公司,NMDAR1免疫組織化學染色試劑盒和兔抗NMDAR1多克隆抗體購自武漢博士德生物工程有限公司。
1.2動物分組與給藥
健康雄性Wistar大鼠90只,體重250~300 g,購自沈陽軍區總醫院實驗動物中心(合格證號:SYXK(軍)2012-0001)。隨機分成3組,每組30只。①假手術組(S組);②全腦缺血再灌注組(I/R組);③右美托咪定組(D組)。D組于全腦缺血前2 h經尾靜脈注射(注射時間10 min)右美托咪定3μg/kg,隨后以3μg/(kg·h)速率輸注120 min;I/R組給予等容量生理鹽水。
1.3大鼠腦內微透析模型的建立
隨機抽取10只Wistar大鼠麻醉后,顱平位固定于大鼠腦立體定位儀上。參照Paxions&Watson大鼠腦圖譜,將自制透析管橫向植入雙側海馬(AP:+4.2 mm,V:-3.5 mm)用牙科水泥固定,待透析灌流實驗。將大鼠腦內透析管與微量透析泵相連,用灌流液(Ringer's:氯化鈉NaCl 147 mmol/L,氯化鉀KCl 4.0 mmol/L,氯化鈣CaCl22.3 mmol/L)以2μl/min流速恒定灌流,于不同時點收集一個樣品,立即注入熒光檢測器測定含量。灌流結束后用組織學方法檢查透析管埋植的位置,取透析管在海馬的樣本列入統計數據。
1.4大鼠腦缺血/再灌注模型的建立
透析模型制備完畢后,將大鼠置于鼠板腹位固定,參照Pulsinelli的方法[2],大鼠頸部背側切口,暴露第一頸椎兩側翼小孔,熱凝閉雙側椎動脈,造成永久性閉塞,縫合皮膚切口,放回保溫鼠籠。手術24h后,乙醚麻醉固定大鼠,頸前切口游離雙側頸總動脈,穿線提出頸總動脈,待其清醒后,用無創動脈夾夾閉雙側頸總動脈造成全腦缺血,縫合頸部傷口,同時雙側顳部頭皮插入電極描記腦電波判斷模型是否成功。缺血15 min后,松開動脈夾恢復腦血流再灌注6h。整個實驗過程,用電燈泡保持大鼠直腸溫度在(37±0.5)℃。
1.5谷氨酸測定
流動相:溶劑A為0.05 mol/L醋酸鈉緩沖液(pH=6.8)-甲醇-四氫呋喃(800∶192∶8,V/V);溶劑B為0.05 mol/L檸檬酸三鈉緩沖液(pH=6.8)-甲醇(2∶8),用G6垂熔漏斗過濾;流速:1.0 ml/min;熒光檢測器工作波長:350nm(激發波長)和450 nm(檢測波長)。精確吸取透析液 20μl,直接注入HPLC-RF-10AXL熒光檢測系統中對Glu含量進行檢測。
1.6免疫組織化學方法檢測NR1的蛋白表達
各組隨機抽取10只大鼠于再灌注3 h后,用含4%多聚甲醛的0.1 mol/L磷酸緩沖液經心臟升主動脈灌流固定,斷頭置于冰盒玻璃板上取出全腦,放入同樣固定液中進行后固定8h(4℃)再將組織移入含20%~30%的蔗糖磷酸緩沖液中(pH=7.4)浸至其沉底。次日用Cryotome E冷凍切片機在-24℃下工作,切片厚度為8μm。對大鼠腦組織連續冠狀切片,同時用蘇木素速染,顯微鏡下觀察,取每只大鼠腦前囟后3~3.5mm范圍為實驗部位。至所需部位后,切片、留片。每隔3取1,連續留5張切片,APES貼片,切片分3套,分別進行NR1免疫組織化學染色,NR1免疫組織化學對照實驗及HE染色。切片后依次加入3%過氧化氫甲醇溶液室溫30 min;正常山羊血清37℃30 min;兔抗NR1多克隆抗體置濕盒4℃過夜;生物素標記的二抗37℃30 min;鏈酶親和素過氧化物酶37℃30 min;然后滴加新鮮配制的DAB顯色液鏡下觀察5~20 min,蒸餾水沖洗,脫水,透明,中性樹膠封片,光鏡下觀察。Metamorph顯微圖像分析儀對切片進行圖像分析測量海馬CA1區:①積分光密度;②陽性細胞面積;③灰度值,每只大鼠測5張切片,取平均值。
1.7大鼠腦缺血損傷神經功能缺損的行為學評分
參照Combs的方法[3],各組隨機抽取10只大鼠于再灌注24 h后進行雙盲運動功能評價(平衡木試驗和引繩肌力試驗)。由兩位觀察者進行打分,記錄平均分數。每項測試間隔2~3min,以避免疲勞影響。行為測定在安靜的環境中進行。平衡木試驗評分標準:0分:不能平衡,1分:維持10 s,2分:維持11~ 20s,3分:維持21~30s;引繩肌力試驗評分標準:0分:堅持0~2 s,1分:堅持3~4 s,2分:堅持5 s第三肢不能搭上,3分:堅持5s可將第三肢搭上。
1.8統計學方法
采用SPSS 14.0統計軟件進行統計學處理,實驗數據以均值±標準差(±s)表示,組間比較先經方差齊性檢驗,方差齊性數據采用單因素方差分析;非齊性數據采用t檢驗,P<0.05為差異具有統計學意義。
2 結果
2.1各組大鼠海馬細胞外Glu水平變化
大鼠腦缺血15 min再灌注0~1 h時海馬細胞外Glu含量開始增多,再灌注3 h達高峰,6 h后逐漸降低。與S組相應時間點比較,I/R組和D組大鼠海馬細胞外Glu的水平增高(P<0.05);D組在相應時間點與I/R組比較,海馬細胞外Glu的水平降低(P<0.05)。見表1。
表1 各組大鼠海馬細胞外Glu水平變化 (n=10,μmol/L±s)
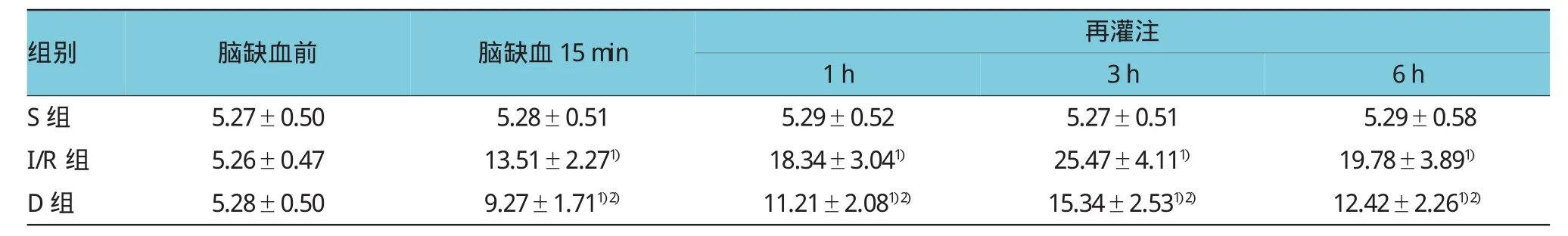
表1 各組大鼠海馬細胞外Glu水平變化 (n=10,μmol/L±s)
注:1)與S組比較,P<0.05;2)與I/R組比較,P<0.05
組別6h S組 5.27±0.50 5.27±0.51 5.29±0.58 I/R組 5.26±0.47 25.47±4.111) 19.78±3.891)D組 5.28±0.50 15.34±2.531)2) 12.42±2.261)2)腦缺血前腦缺血15min再灌注1h 5.28±0.51 5.29±0.52 13.51±2.271) 18.34±3.041)9.27±1.711)2) 11.21±2.081)2)3h
2.2各組大鼠海馬CA1區NR1表達變化
與S組比較,I/R組和D組大鼠海馬CA1區NR1積分光密度、陽性細胞面積、平均灰度值均差異有統計學意義(P<0.05);與I/R組比較,D組大鼠海馬CA1區NR1蛋白的表達下調(P<0.05)。積分光密度越強、陽性細胞面積越大、平均灰度值越小,表示陽性產物NR1表達越強烈。見表2。
2.3各組大鼠神經功能缺損的行為學評分結果
與S組比較,I/R組和D組大鼠平衡木和引繩肌力試驗評分下降(P<0.05);與I/R組比較,D組大鼠平衡木和引繩肌力試驗評分升高(P<0.05)。見表3。
表2 腦缺血再灌注3h各組大鼠海馬CA1區NR1表達變化(n=10±s)

表2 腦缺血再灌注3h各組大鼠海馬CA1區NR1表達變化(n=10±s)
注:1)與S組比較,P<0.05;2)與I/R組比較,P<0.05
組別灰度值S組 220.4±17.8 I/R組 85.3±8.61)D組 143.2±12.41)2)陽性細胞面積4078.4±364.1 52646.4±3371.1 12847.3±986.71) 94151.3±7432.81)7032.5±408.21)2)67147.8±4436.11)2)積分光密度
表3 各組大鼠神經功能行為學評分(n=10,分±s)

表3 各組大鼠神經功能行為學評分(n=10,分±s)
注:1)與S組比較,P<0.05;2)與I/R組比較,P<0.05
組別 引繩肌力試驗S組 3.18±0.57 I/R組 0.78±0.631)D組 1.79±0.481)2)平衡木試驗3.42±0.63 0.93±0.721)2.05±0.511)2)
3 討論
腦缺血損傷涉及多種病理過程,興奮性毒性是主要機制之一,其中谷氨酸(Glu)及其受體的病理變化是引起興奮性毒性的重要病理基礎。在中樞神經系統缺血缺氧等病理條件下,內源性Glu過度釋放或攝取障礙,使細胞外Glu濃度急劇升高,細胞間隙堆砌的Glu使谷氨酸受體過度激活,引起鈣超載、一氧化氮NO生成增多等一系列毒性反應,產生興奮性毒性[4]。
N-甲基-D-天冬氨酸受體是一種離子型谷氨酸受體,其中NR1亞單位是NMDAR的功能單位,具有NMDAR的一切藥理學和電生理學特性,NR1基因紊亂直接影響NMDAR的生物活性及功能狀態。腦缺血損傷后誘導或加強NR1的表達,上調的NR1可介導鈣離子Ca2+通道開放,使大量Ca2+內流,引起一系列Ca依賴的過度生化反應[5]。因此,檢測NR1的蛋白表達,能從分子水平上評估藥物對腦缺血再灌注損傷的保護機制及療效。
全腦缺血可導致不同程度的神經功能缺損,運動功能是檢測大鼠神經功能的重要指標。Combs評分系統通過特定的運動功能評分標準對大鼠進行客觀評價神經功能缺損情況[6]。本研究采用Combs評分法觀察到D組大鼠運動功能評分雖低于S組,但卻明顯高于I/R組,提示右美托咪定預處理對運動功能有一定程度的改善,有助于緩解腦缺血再灌注大鼠的神經損傷。
“四血管閉塞法”全腦缺血模型大鼠能較好地模擬圍手術期因嚴重低血壓、休克甚至心肺復蘇等造成的全腦缺血性損傷過程。本研究在評估大鼠神經功能行為學的基礎上,采用腦微透析技術結合免疫組織化學法動態觀察活體腦缺血再灌注大鼠模型海馬Glu含量及其受體的變化,發現大鼠海馬Glu水平與海馬CA1區NR1表達變化趨勢相一致:即大鼠海馬區Glu釋放和NR1的蛋白表達均在再灌注0~1h開始增多,3h達到高峰,然后逐漸下降,本文選缺血再灌注3 h作為觀察右美托咪定腦保護作用時間點。研究結果表明,與I/R組比較,D組大鼠海馬Glu含量降低,NR1的表達下調,提示右美托咪定能對抗腦缺血再灌注后Glu過度釋放及NR1的表達,減輕Glu過量生成和NR1的高表達而導致的腦繼發性損害,其機制可能是通過以下途徑實現:①在腦缺血、缺氧的情況下,右美托咪定能通過激活G0蛋白偶聯的α2-AR,抑制N型電壓門控性鈣離子通道等因素抑制Glu的釋放[7];②右美托咪定通過抑制兒茶酚胺釋放,調節腦氧供需平衡,降低神經元對興奮性氨基酸-Glu的敏感性,減輕Glu的興奮性毒性效應或提高缺血區域灌注產生神經保護作用[8];③右美托咪定作用于星形膠質細胞上的α2-AR促進星形膠質細胞對Glu的攝取及其氧化降解,Glu釋放減少抑制了腎上腺素β受體的活性,降低神經元的代謝率[9]。Chen等[10]也發現,在體外培養的星形膠質細胞加入右美托咪定后細胞內二氧化碳CO2生成增加,氧化代謝增強,星形膠質細胞對細胞間隙Glu的清除能力增加,細胞外Glu含量減少,Glu激活星形膠質細胞膜上NR1減少,星形膠質細胞激活減少;本次研究的前期工作也發現[11]右美托咪定預處理后通過抑制大鼠齒狀回星形膠質細胞GFAP的高表達,減緩腦缺血時星形膠質細胞的過度活化,穩定內環境,維持缺血時星形膠質細胞的增生狀態,有利于缺血后損傷腦組織的修復,從而減輕神經功能的損害。
綜上所述,右美托咪定可減輕大鼠全腦缺血再灌注損傷,改善神經運動功能的缺損,其機制可能與抑制Glu釋放和下調NR1的表達有關。
[1]KoseEA,Bakar B,Kasimcan O,et al.Effects of intracisternal and intravenous dexmedetomidineon ischemia-induced brain injury in rat:a comparativestudy[J].Turk Neurosurg,2013,23(2):208-217.
[2]Pulsinelli WA,Brierley JB,PlumF.Temporal profileof neuronal damagein amodel of transient forebrain ischemia[J].AnnNeurol,1982,11 (5):491-498.
[3]CombsD,D'AlecyL.Motorperformanceinratsexposedtosevereforebrainischemia:effectoffastingand1,3-butanediol[J].Stroke,1987,18 (2):503-511.
[4]宋文婷,徐立,劉建勛.腦缺血后谷氨酸及其受體介導的神經細胞損傷及相關藥物研究進展[J].中國藥理學通報,2012,28(6):747-750.
[5]Knox R,ZhaoC,Miguel-Perez D,et al.Enhanced NMDA receptor tyrosine phosphorylation and increased brain injury following neonatal hypoxia-ischemiainmicewithneuronal Fynoverepression[J].Neurobiol Dis,2013,51(3):113-119.
[6]劉小蒙,王榮亮,羅玉敏.大鼠腦缺血神經功能缺損行為學評價的研究進展[J].中國腦血管病雜志,2012,9(4):208-212.
[7]Chui KM,Lin TY,Lu CW,et al.Inhibitory effect of glutamate release from rat cerebrocortical nerve terminals by α2 adrenoceptor agonist dexmedetomidine[J].EurJ Pharmacol,2011,670(1):137-147.
[8]Dahmani S,RouelleD,Gressens P,et al.Characterization of the postconditioning effect of dexmedetomidine in mouse organotypic hippocampal slice cultures exposed to oxygen and glucose deprivation[J]. Anesthesiology,2010,112(2):373-383.
[9]焦薇,周脈濤,吳文華,等.右美托咪定與咪唑安定對重型顱腦外傷患者圍術期炎癥反應及顱內壓的影響[J].中國現代醫學雜志, 2014,24(17):34-38.
[10]ChenY,ZhaoZ,CodeWE,etal.A correlationbetweendexmedetomidine-induced biphasic increases in free cytosolic calciumconcentration and energy metabolismin astrocytes[J].Anesth Analg,2000,91 (2):353-357.
[11]尚宇,顧佩菲,袁士濤,等.右美托咪定預處理對局灶性腦缺血/再灌注星形膠質細胞膠質纖維酸性蛋白表達的影響[J].中國現代應用藥學,2015,32(7):799-803.
(張蕾編輯)
Dexmedetomidine inhibit Glu release and NR1 expression in hippocampus on global cerebral ischemia-reperfusion rats*
Yu Shang1,Shuang-cheng Guan1,Yue Li2,Guang-jie Gao1
(1.Department of Anesthesiology,PLA 463rd Hospital,Shenyang,Liaoning 110042,China;2.Department of Anesthesiology,the First Affiliated Hospital of Harbin Medical University,Harbin,Heilongjiang 150001,China)
Objective To investigate the effect of Dexmedetomidine on glutamate(Glu)release and NR1 expression in hippocampus on global cerebral ischemia-reperfusion rats.Methods Ninety male Wistar rats were randomly divided into three groups;group S received sham operation;group I/R received ischemia-reperfusion;group D received Dexmedetomidine treatment before ischemia-reperfusion(n=30).Global cerebral ischemia was induced according to Pulsinelli-Brierley method.In group D,Dexmedetomidine 3 μg/kg was injected through tail vein before ischemia,then 3 μg/(kg·h)with injection pump.Meanwhile equal volume saline administrated in group I/R animals. Combs was used to evaluate nerve function of rats;Glu levels were detected by HPLC in the rat hippocampus;NR1 expression in CA1 area was detected by immunohistochemistry method.Results Compared with group S,Balance beam and rope strength test scores in group I/R and D were significant decrease(P<0.05),and the level of Glu and NR1 were increase significantly(P<0.05).Compared with group I/R,Balance beam and rope strength test scores in group D were significant decreased(P<0.05),and the level of Glu and NR1 were increased significantly(P<0.05). Conclusion Dexmedetomidine can reduce the rat global cerebral ischemia reperfusion injury and improve the nervefunction defect,and the mechanism is related to the inhibition of Glu release and down regulate NR1 expression.
Dexmedetomidine;ischemia/reperfusion injury;glutamate;N-methyl-D-aspartate receptor
R 363;R-332
A
10.3969/j.issn.1005-8982.2016.04.001
1005-8982(2016)04-0001-04
2015-09-16
遼寧省自然科學基金資助項目(No:2015020416)
高光潔,E-mail:guangjie420@126.com,Tel:024-28845351

