不同子宮內膜癌細胞系中G蛋白耦聯受體30 mRNA及蛋白表達觀察
葉佳,楊曉清,盛楠,馬勤宜,張玉泉
(1南通大學附屬醫院,江蘇南通226001;2南通市婦幼保健院)
?
不同子宮內膜癌細胞系中G蛋白耦聯受體30 mRNA及蛋白表達觀察
葉佳1*,楊曉清1,盛楠1,馬勤宜2,張玉泉1
(1南通大學附屬醫院,江蘇南通226001;2南通市婦幼保健院)
目的觀察不同子宮內膜癌細胞系中G蛋白耦聯受體30(GPR30)mRNA及蛋白的表達變化。方法收集正常增生期人子宮內膜組織,原代培養子宮內膜腺上皮細胞并鑒定。體外培養人子宮內膜癌細胞系ISK(ERα陽性、ERβ陽性、高分化)、RL95-2(ERα陽性、ERβ陽性、中分化)、HEC-1-B(ERα陰性、ERβ陽性、中分化)、KLE(ERα陰性、ERβ陰性、低分化)。采用real-time PCR法檢測正常子宮內膜腺上皮細胞及不同子宮內膜癌細胞系中的GPR30 mRNA,采用Western blotting法檢測GPR30蛋白。結果子宮內膜腺上皮細胞、ISK細胞系、RL95-2細胞系、HEC-1-B細胞系、KLE細胞系中GPR30 mRNA相對表達量分別為0.016±0.002、0.032±0.004、0.049±0.003、0.051±0.006、0.083±0.001,GPR30蛋白相對表達量分別為0.31±0.22、0.57±0.01、1.21±0.04、1.34±0.05、1.77±0.01。各子宮內膜癌細胞系中GPR30 mRNA及蛋白相對表達量均高于子宮內膜腺上皮細胞(P均<0.05);ISK細胞系中GPR30 mRNA及蛋白相對表達量最低,與RL95-2細胞系、HEC-1-B細胞系、KLE細胞系相比,P均<0.05;KLE細胞系中GPR30 mRNA及蛋白相對表達量高于HEC-1-B細胞系及RL95-2細胞系(P均<0.05)。結論不同子宮內膜癌細胞系中GPR30 mRNA及蛋白均呈高表達,且在高、中、低分化的子宮內膜癌細胞系中表達水平逐漸增高。
子宮內膜癌;子宮內膜癌細胞系;G蛋白耦聯受體30;孕激素受體;子宮內膜腺上皮細胞
近年來研究發現,雌激素作用于靶細胞后可引起快速細胞反應,僅需幾秒到幾分鐘即可發揮生物效應,此過程與傳統的雌激素基因組效應不同,并不激活相關基因轉錄,因此稱為雌激素的“非基因組效應”。G蛋白耦聯受體30(GPR30)在介導這種效應中起到重要作用[1],被認為是一種新型雌激素受體。GPR30介導的信號轉導途徑可能在腫瘤細胞(尤其是ERα、ERβ陰性的Ⅱ型子宮內膜癌細胞)的增殖及遷移中起關鍵作用[2]。2010年8月~2013年1月,我們觀察了不同子宮內膜癌細胞系中GPR30 mRNA及蛋白的表達變化,探討GPR30在子宮內膜癌發生、發展中的作用。
1 材料與方法
1.1主要實驗材料人子宮內膜癌細胞系ISK(ERα陽性、ERβ陽性、高分化)購自湘雅醫學院細胞中心(由南通大學附屬醫院婦產科實驗室保存),人子宮內膜癌細胞系RL95-2(ERα陽性、ERβ陽性、中分化)、HEC-1-B(ERα陰性、ERβ陽性、中分化)購自中科院上海細胞庫,人子宮內膜癌細胞系KLE(ERα陰性、ERβ陰性、低分化)購自中國典型培養物保藏中心。RPMI1640、MEM培養基購自美國Gibco公司,DMEM-F12培養基購自美國Sigma公司,TRIzol試劑購自美國Introvigen公司,逆轉錄試劑盒購于杭州博日科技有限公司,real-time PCR試劑盒購于TaKaRa生物有限公司,BCA蛋白濃度測定試劑盒增強型、小鼠抗人β-actin單克隆抗體購自碧云天生物技術研究所,兔抗人GPR30多克隆抗體購自美國Santa Cruz公司,羊抗兔IgG、羊抗小鼠IgG購于美國Odyssey公司,FITC標記羊抗兔IgG購自武漢博士德生物工程有限公司。
1.2子宮內膜腺上皮細胞獲取及子宮內膜癌細胞系培養
1.2.1子宮內膜腺上皮細胞獲取方法正常增生期子宮內膜組織取自2010年8~11月因子宮肌瘤(非黏膜下肌瘤)在南通大學附屬醫院行全子宮切除術的患者。患者年齡20~45歲,月經周期正常,未放置宮內節育器,近3個月未口服藥物避孕,術后病理證實子宮內膜正常。參考文獻[3]方法并適當改進,分離培養8例患者的子宮內膜腺上皮細胞,細胞純度>95%。免疫熒光化學檢查結果顯示細胞角蛋白染色陽性、波形蛋白染色陰性,證明所得細胞為子宮內膜腺上皮細胞。
1.2.2子宮內膜癌細胞系培養方法ISK細胞培養液為RPMI1640基礎培養基添加10%FBS、100 U/mL青霉素及100 U/mL鏈霉素。RL95-2細胞培養液為DMEM-F12培養基添加10 mmol/L HEPES、2.0 g/L碳酸氫鈉、0.005 mg/mL胰島素、10%FBS、100 U/mL青霉素及100 U/mL鏈霉素。HEC-1-B細胞培養液為E-MEM培養基添加1.0 mmol/L丙酮酸鈉、0.1 mmol/L非必需氨基酸、1.5 g/L碳酸氫鈉、10% FBS、100 U/mL青霉素及100 U/mL鏈霉素。KLE細胞培養液為DMEM-F12培養基添加15 mmol/L HEPES、0.5 mmol/L丙酮酸鈉、1.2 g/L碳酸氫鈉、2.5 mmol/L L-谷氨酰胺、10%FBS、100 U/mL青霉素及100 U/mL鏈霉素。細胞均在37 ℃、含5% CO2的無菌培養箱中培養。四種細胞均貼壁生長,每2~3 d用0.25%胰酶消化傳代。
1.3不同細胞中GPR30 mRNA及蛋白檢測
1.3.1GPR30 mRNA檢測取對數生長期細胞,TRIzol法提取子宮內膜腺上皮細胞和子宮內膜癌細胞的總RNA。紫外分光光度計測總RNA OD260/OD280在1.8~2.0。從NCBI獲得GPR30 mRNA及內參β-actin mRNA全序列,利用Primer Remier5.0引物設計軟件設計引物,由上海生工生物工程有限公司合成引物。目的基因引物序列及產物長度見表1。將RNA逆轉錄為cDNA,以cDNA為模板,按照試劑盒說明書配制PCR反應液。取cDNA 2 μL,使總反應體系為25 μL,采用兩步法PCR反應檢測GPR30 mRNA。PCR反應條件:95 ℃ 30 s,1個循環;95 ℃ 5 s,60 ℃ 20 s,40個循環。由Opticon Monitor2軟件分析PCR擴增產物原始Ct值,以2-ΔΔCt表示GPR30 mRNA相對表達量。實驗重復3次,取均值。

表1 目的基因引物序列及產物長度
1.3.2GPR30蛋白檢測采用Western blotting法。收集各組對數生長期細胞,提取蛋白,BCA法測蛋白濃度;蛋白上樣15 μg,經10% SDS-PAGE恒壓電泳,恒流電轉至PVDF膜,5%脫脂奶粉常溫封閉2 h,TBST漂洗;分別加入小鼠抗人β-actin單克隆抗體(1∶1 000稀釋)和兔抗人GPR30多克隆抗體(1∶200稀釋),4 ℃孵育過夜;次日加入HRP標記的羊抗兔、羊抗小鼠IgG(1∶2 000稀釋),室溫孵育2 h;Odyssey雙色紅外激光成像系統掃膜成像,Quantity One軟件分析蛋白條帶灰度值。以GPR30條帶與β-actin條帶灰度值之比作為GPR30蛋白相對表達量。實驗重復3次,取均值。

2 結果
各子宮內膜癌細胞系中GPR30 mRNA及蛋白相對表達量均高于子宮內膜腺上皮細胞(P均<0.05);ISK細胞系中GPR30 mRNA及蛋白相對表達量最低,與RL95-2細胞系、HEC-1-B細胞系、KLE細胞系相比,P均<0.05;KLE細胞系中GPR30 mRNA及蛋白相對表達量高于HEC-1-B細胞系及RL95-2細胞系(P均<0.05)。詳見表2。
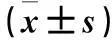
表2 子宮內膜腺上皮細胞與各子宮內膜癌細胞系中GPR30 mRNA及蛋白表達比較
注:與子宮內膜腺上皮細胞相比,*P<0.05;與ISK細胞系相比,#P<0.05;與RL95-2細胞系、HEC-1-B細胞系相比,▲P<0.05。
3 討論
GPR30為7次跨膜G蛋白耦聯受體超家族(GPCRs)成員之一,基因位于染色體7p22,全長為2 064 bp,含一長為1 128 bp的開放閱讀框架(ORF),編碼一個含375個氨基酸的蛋白質。該蛋白含有1個7次跨膜的高度保守域、3個位于細胞外區域的糖基化位點[4]。GPR30分布于大腦、心臟、血管內皮、淋巴組織、子宮內膜、卵巢、胎盤等正常組織中[5],在乳腺癌、子宮內膜癌、卵巢癌、睪丸癌等多種惡性腫瘤中亦有廣泛表達[6~9],其表達水平因腫瘤組織類型、病理狀態不同而各有差異,可能參與了激素相關性腫瘤的發生發展[10]。隨著GPR30特異性配體G-1[11]與特異性拮抗劑G-15[12]的發現,GPR30的生物學功能得到進一步揭示。
Kolkova等[13]研究發現GPR30主要定位表達于增生中晚期的子宮內膜腺上皮組織中,且在腺上皮細胞中的表達水平高于基質細胞。因此我們選擇正常增生期的子宮內膜組織,且在原代培養過程中棄去基質細胞,僅選擇分離、純化出的腺上皮細胞作為實驗對象。Ge等[14]研究顯示,子宮內膜癌組織中GPR30的表達水平與EGF呈正相關關系,與PR的表達呈負相關關系,與ER表達無相關性。過表達GPR30蛋白的腫瘤組織分化程度較低,常伴深肌層浸潤,患者預后較差。GPR30或可成為子宮內膜癌患者不良結局的預測指標。Vivacqua等[15]研究表明,雌激素與GPR30結合后,能激活GPR30下游的ERK/MAPK信號通路,使c-fos原癌基因表達上調,從而誘導子宮內膜癌細胞增殖,此過程與子宮內膜癌細胞內ERα存在與否無關,提示GPR30可能在ER陰性的Ⅱ型子宮內膜癌的發生發展中起關鍵作用。
我們前期研究已發現GPR30在子宮內膜癌細胞系ISK細胞質中的表達高于細胞膜,其亞細胞定位主要在粗面內質網[16]。為了進一步擴大研究,我們體外培養了不同特點的人子宮內膜癌細胞系,觀察各細胞系中GPR30 mRNA及蛋白的表達變化。四種癌細胞系分別為高、中、低分化級別,其中ISK、RL95-2中ERα、ERβ陽性,HEC-1-B、KLE中ERα、ERβ陰性,RL95-2、HEC-1-B同為中分化級別,但ERα、ERβ的表達有差異。本研究結果顯示,GPR30 mRNA及蛋白在四種子宮內膜癌細胞系中的表達均高于正常子宮內膜腺上皮細胞,在低分化的KLE細胞系中表達量最高,在高分化的ISK細胞系中表達量最低。上述結果提示不同子宮內膜癌細胞系中GPR30 mRNA及蛋白均呈高表達,且在高、中、低分化的子宮內膜癌細胞系中表達水平逐漸增高;GPR30表達與子宮內膜癌細胞分化程度有關,其可能參與了子宮內膜癌的發生、發展。GPR30有望成為子宮內膜癌的一個新的治療靶點。在后續研究中,我們將繼續探索GPR30的相關作用機制。
[1] Ariazi EA,Brailoiu E,Yerrum S,et al.The G protein-coupled receptor GPR30 inhibits proliferation of estrogen receptor-positive breast cancer cells [J].Cancer Res,2010,70(3):1184-1194.
[2] Lappano R,Rosano C,Santolla MF,et al.Two novel GPER agonists induce gene expression changes and growth effects in cancer cells[J].Curr Cancer Drug Targets,2012,12(5):531-542.
[3] 楊曉清,張沐,唐小軍,等.人子宮內膜細胞的純化、培養方法的改進及細胞保存[J].江蘇醫藥,2012,38(4):389-392.
[4] Wang D,Hu L,Zhang G,et al.G protein-coupled receptor 30 in tumor development[J].Endocrine,2010,38(1):29-37.
[5] Cygankiewicz AI,Jacenik D,Krajewska WM,et al.GPER receptor - the new player in estrogen signaling[J].Postepy Biochem,2015,61(1):52-60.
[6] Marjon NA,Hu C,Hathaway HJ,et al.G protein-coupled estrogen receptor regulates mammary tumorigenesis and metastasis[J].Mol Cancer Res,2014,12(11):1644-1654.
[7] Du GQ,Zhou L,Chen XY,et al.The G protein-coupled receptor GPR30 mediates the proliferative and invasive effects induced by hydroxytamoxifen in endometrial cancer cells[J].Biochem Biophys Res Commun,2012,420(2):343-349.
[8] Heublein S,Mayr D,Friese K,et al.The G-protein-coupled estrogen receptor (GPER/GPR30) in ovarian granulosa cell tumors[J].Int J Mol Sci,2014,15(9):15161-15172.
[9] Boscia F,Passaro C,Gigantino V,et al.High levels of GPR30 protein in human testicular carcinoma in situ and seminomas correlate with low levels of estrogen receptor-beta and indicate a switch in estrogen responsiveness[J].J Cell Physiol,2015,230(6):1290-1297.
[10] Arias-Pulido H,Royce M,Gong Y,et al.GPR30 and estrogen receptor expression: new insights into hormone dependence of inflammatory breast cancer[J].Breast Cancer Res Treat,2010,123(1):51-58.
[11] Skrzypczak M,Schüler S,Lattrich C,et al.G protein-coupled estrogen receptor (GPER) expression in endometrial adenocarcinoma and effect of agonist G-1 on growth of endometrial adenocarcinoma cell lines[J].Steroids,2013,78(11):1087-1091.
[12] Méndez-Luna D,Martínez-Archundia M,Maroun RC,et al.Deciphering the GPER/GPR30-agonist and antagonists interactions using molecular modeling studies,molecular dynamics,and docking simulations[J].J Biomol Struct Dyn,2015,33(10):2161-2172.
[13] Kolkova Z,Noskova V,Ehinger A,et al.G protein-coupled estrogen receptor 1 (GPER,GPR 30) in normal human endometrium and early pregnancy decidua(dagger)[J].Mol Hum Reprod,2010,16(10):743-751.
[14] Ge X,Guo R,Qiao Y,et al.The G protein-coupled receptor GPR30 mediates the nontranscriptional effect of estrogen on the activation of PI3K/Akt pathway in endometrial cancer cells[J].Int J Gynecol Cancer,2013,23(1):52-59.
[15] Vivacqua A,Romeo E,De Marco P,et al.GPER mediates the Egr-1 expression induced by 17β-estradiol and 4-hydroxitamoxifen in breast andendometrial cancer cells[J].Breast Cancer Res Treat,2012,133(3):1025-1035.
[16] 葉佳,張沐,馬勤宜,等.G蛋白偶聯受體30在子宮內膜癌Ishikawa細胞中的表達及亞細胞定位[J].腫瘤,2011,31(11):977-981.
南通市科技計劃項目(K2010043);南通大學研究生科技創新計劃項目(YKC11013)。
張玉泉(E-mail: jsnt_zhangyuquan@163.com)
*現工作于南京醫科大學附屬無錫人民醫院。
10.3969/j.issn.1002-266X.2016.19.010
R711.74
A
1002-266X(2016)19-0031-03
2016-02-14)

