犬貓皮膚癬菌病致病菌種鑒定及藥敏試驗(yàn)
王 靜,孫偉東,金藝鵬
(1.中國農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院,北京 海淀 100193;2.天津市保靈動(dòng)物保健品有限公司,天津 寧河 301500)
犬貓皮膚癬菌病致病菌種鑒定及藥敏試驗(yàn)
王靜1,孫偉東2,金藝鵬1
(1.中國農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院,北京 海淀 100193;2.天津市保靈動(dòng)物保健品有限公司,天津 寧河 301500)
本試驗(yàn)使用皮膚癬菌通用引物(CHS1 1S,CHS1 1R)與寡核苷酸序列(GACA)4方法鑒定致病菌株,并根據(jù)Nc?cls推薦的方法(M38-A2)對(duì)臨床分離株進(jìn)行藥敏試驗(yàn),以指導(dǎo)準(zhǔn)確鑒定菌種、快速診斷及正確用藥。
皮膚癬菌;菌種鑒定;藥敏試驗(yàn)
1 材料
1.1樣本來源2014年8月至2015年1月間,來中國農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)院化驗(yàn)室進(jìn)行皮膚采樣化驗(yàn)的犬貓。
1.2標(biāo)準(zhǔn)菌株須毛癬菌標(biāo)準(zhǔn)株ATCC-28185,犬小孢子菌標(biāo)準(zhǔn)菌株ATCC-36299,克柔念珠菌ATCC-6258。
1.3培養(yǎng)基沙堡勞氏培養(yǎng)基,土豆培養(yǎng)基。
2 方法
2.1菌種鑒定將所采集的毛發(fā)接種于沙堡勞氏培養(yǎng)基上,每天觀察并記錄真菌的生長速度、表面狀態(tài)、背面顏色等,根據(jù)這些特征對(duì)真菌進(jìn)行初步的鑒定。使用玻璃珠法提取疑似皮膚癬菌的DNA,并根據(jù)相關(guān)文獻(xiàn),使用皮膚癬菌通用引物[1]CHS1 1S:(5′-CAT CGA GTA CAT GTG CTC GC-3′);CHS1 1R:(5′-CTC GAG GTC AAA AGC ACG CC-3′)進(jìn)行擴(kuò)增,鑒別皮膚癬菌與非皮膚癬菌。再用寡核苷酸序列[2](GACA)4:(5′-GAC AGA CAG ACA GAC A-3′)鑒別皮膚癬菌的種屬。
2.2抗真菌藥的制備根據(jù)以往的研究結(jié)果及M38-A2方法[3],受試藥物的終濃度范圍為:伊曲康唑0.001~0.5 μg/mL;特比萘芬0.001~0.5 μg/ mL;酮康唑0.0313~16 μg/mL。因此,它們的儲(chǔ)存液濃度應(yīng)分別為:伊曲康唑與特比萘芬50 μg/ mL;酮康唑1 600 μg/mL。
將無菌的儲(chǔ)存液分裝至無菌的聚丙烯小管內(nèi),密封,存放于-80℃的溫度下。藥敏試驗(yàn)當(dāng)天,將儲(chǔ)存液用二甲基亞砜稀釋成各種中間濃度,再用RPMI1640培養(yǎng)基50倍稀釋為終濃度。
2.3真菌接種液的制備將受試菌株在土豆培養(yǎng)基上活化并轉(zhuǎn)種2次以上,以確保其純度和活性。培養(yǎng)溫度為28℃,活化時(shí)間大約7~10 d,直至顯微鏡檢查可見多量孢子產(chǎn)生。用0.85%無菌生理鹽水沖洗培養(yǎng)基表面,制備懸液。將菌懸液靜置15~20 min后,較大顆粒會(huì)沉于底部,取上層液體。用Whatman40號(hào)濾紙過濾。用血細(xì)胞計(jì)數(shù)板計(jì)算孢子數(shù)目,調(diào)整孢子量,使菌落形成單位(CFU)為(1-3)×105CFU/mL。用RPMI1640培養(yǎng)基將菌液稀釋50倍,得到2倍于終濃度的接種懸液,濃度為(2-6)×103CFU/mL。
2.496孔微型板加樣將不同濃度的抗真菌藥物按照濃度梯度由高到低排列在第1-10孔,每孔加入100 μL的2倍于終濃度的抗真菌藥液,第11孔加入100 μL的RPMI1640培養(yǎng)基,第12孔加入最低濃度的抗真菌藥物100 μL。
加藥完成后,在第1-11孔,每孔加入100 μL的2倍于終濃度的菌液。第12孔加入經(jīng)RPMI1640培養(yǎng)基稀釋50倍后的0.85%無菌鹽水作為陰性對(duì)照孔。將96孔微型板放入真菌培養(yǎng)箱,在28℃的溫度、90%濕度的條件下孵育6 d,至菌落生長良好。為使試驗(yàn)可靠,每個(gè)菌株重復(fù)做藥敏試驗(yàn)1次。
2.5最小抑菌濃度的判定根據(jù)Nccls M38-A2,采用肉眼觀察判定最小抑菌濃度(MIC)。讀取MIC時(shí),通過肉眼觀察每個(gè)孔中真菌的生長情況,將其與生長對(duì)照孔(第11孔)對(duì)照,對(duì)于酮康唑、伊曲康唑和特比萘芬,當(dāng)皮膚癬菌菌株與生長對(duì)照孔相比,達(dá)到了80%或更高的抑制時(shí),可判定為MIC。
3 結(jié)果
3.1皮膚癬菌種屬鑒定結(jié)果采樣期間,分離培養(yǎng)出疑似皮膚癬菌共117例。其中,79株擴(kuò)增條帶為450 bp左右,確認(rèn)為皮膚癬菌。27株未擴(kuò)增出條帶,并非皮膚癬菌(見圖1);79株皮膚癬菌均擴(kuò)增出以900 bp為主,伴有400 bp、600 bp、2 500 bp大小的條帶。鑒定為犬小孢子菌(見圖2)。
3.2藥敏試驗(yàn)結(jié)果見表1。
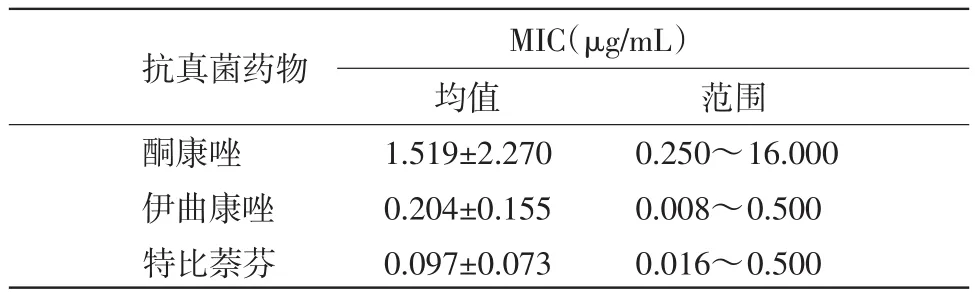
表1 不同抗真菌藥物對(duì)犬小孢子菌的MIC(μg/mL)

圖1 通用引物PCR擴(kuò)增電泳圖譜
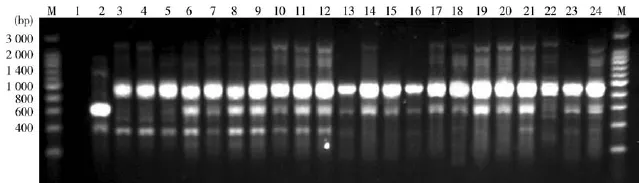
圖2 寡核苷酸序列PCR擴(kuò)增電泳圖譜
經(jīng)Kruskal-wailis檢驗(yàn)3種抗真菌藥物MIC均值,3種抗真菌藥物對(duì)79株犬小孢子菌的藥敏結(jié)果有極顯著差異(P<0.01)。
4 討論
4.1分子生物學(xué)方法鑒定結(jié)果的解讀使用通用引物(CHS 1S,CHS 1R)鑒定真菌是否為皮膚癬菌的方法,被多次證實(shí)是簡便、有效的[1,4-5]。使用這對(duì)引物,可將21種皮膚癬菌擴(kuò)增出440 bp左右的片段[4],具有皮膚癬菌特異性,可以鑒別皮膚癬菌與非皮膚癬菌。本次試驗(yàn)中,須毛癬菌標(biāo)準(zhǔn)株、犬小孢子菌標(biāo)準(zhǔn)株及臨床株均出現(xiàn)一條約450 bp的擴(kuò)增條帶,且念珠菌的標(biāo)準(zhǔn)株無擴(kuò)增條帶,與Kano等報(bào)道的約440 bp的擴(kuò)增產(chǎn)物基本一致[1]。
使用短核苷酸序列(GACA)4作為惟一引物是鑒別皮膚癬菌種類的十分有效的分子學(xué)方法[2,6]。本次試驗(yàn)中,須毛癬菌標(biāo)準(zhǔn)株的條帶特征與犬小孢子菌標(biāo)準(zhǔn)株和臨床株有很大區(qū)別。結(jié)果顯示,犬小孢子菌的條帶比較復(fù)雜,數(shù)量多、范圍大,不同的分離株條帶有所差異,但大致相同。這些犬小孢子菌生存的地理位置與之前文獻(xiàn)的研究有所不同,除此之外,條帶特征(包括須毛癬菌標(biāo)準(zhǔn)株、犬小孢子菌標(biāo)準(zhǔn)株、犬小孢子菌臨床株)一致[2,7],證明以(GACA)4為惟一引物的PCR方法是具有良好重復(fù)性的方法。
希臘的一項(xiàng)研究調(diào)查了城市與鄉(xiāng)村健康犬被毛的皮膚癬菌攜帶情況。研究發(fā)現(xiàn),從城市的犬被毛上分離出的皮膚癬菌均為犬小孢子菌,而從鄉(xiāng)村所分離出的菌種以石膏樣小孢子菌、須毛癬菌為首[8]。根據(jù)鑒定結(jié)果,試驗(yàn)中,在臨床所收集到的皮膚癬菌,均為犬小孢子菌。犬小孢子菌是親動(dòng)物性皮膚癬菌,也是臨床上從患病犬貓身上分離出的最多的皮膚癬菌。
4.2抗真菌藥物的抑菌效果本試驗(yàn)結(jié)果顯示,對(duì)犬小孢子菌的體外藥敏試驗(yàn)中,特比萘芬是最有效的藥物,MIC的平均值及范圍都較小。這說明特比萘芬對(duì)犬小孢子菌的敏感度較高,與國內(nèi)外多個(gè)研究結(jié)果一致[9-10]。特比萘芬是第二代丙烯胺類抗真菌藥物,對(duì)皮膚癬菌有著較好的作用,同時(shí),它對(duì)肝臟損害極少,與其他藥物的相互作用也相當(dāng)?shù)汀=陙硪恍┪墨I(xiàn)顯示,特比萘酚對(duì)犬皮膚癬菌病具有良好的治療效果[9,15]。因此,特比萘酚有可能成為今后寵物皮膚癬菌病的特效藥物之一。
唑類抗真菌藥中,伊曲康唑所需抑菌濃度較低,其次是酮康唑。這與Santos的研究結(jié)果一致[10]。伊曲康唑及酮康唑都是對(duì)皮膚癬菌比較有效的抗真菌藥,但是酮康唑?qū)θ埦哂懈味拘裕虼耍幥凹隘煶讨校紤?yīng)將肝功能檢測作為常規(guī)監(jiān)測。
目前,體外藥敏試驗(yàn)的結(jié)果與實(shí)際的臨床療效之間的研究較少[11],MIC與臨床療效之間的關(guān)系是非常復(fù)雜的,以現(xiàn)有的試驗(yàn)結(jié)果而言,無法得出特比萘芬的臨床療效最好的結(jié)論。
4.3試驗(yàn)條件的探討本試驗(yàn)的整體步驟是根據(jù)NCCLS對(duì)絲狀真菌的藥敏試驗(yàn)所建議的步驟進(jìn)行的。但是在某些細(xì)節(jié)方面,做出了一些改變。首先,在配置接種液的步驟中,Nccls建議將菌懸液靜止15~20 min,使真菌的菌絲沉底,取上層漂浮孢子作為接種液。但是靜止并不能保證菌絲和孢子完全分離,因此,本試驗(yàn)使用8 μm的濾紙將菌液濾過,達(dá)到分離孢子的目的。這種方法對(duì)測定MIC終點(diǎn)可能有著非常重要的意義。曾有報(bào)道研究發(fā)現(xiàn),某些皮膚癬菌的大分生孢子比菌絲的壁厚,因此他們對(duì)抗真菌藥物的敏感性可能會(huì)有所不同[12]。因而,小分生孢子與菌絲對(duì)抗真菌藥物的敏感性可能也不相同[13]。
其次,在試驗(yàn)中,本試驗(yàn)所選擇的孵育溫度與Nccls的建議(35℃)有所不同。這是因?yàn)椋鶕?jù)以往實(shí)驗(yàn)室培養(yǎng)真菌的經(jīng)驗(yàn),28℃的溫度下,真菌的生長速度較快。所以此次仍然沿用以往的做法。最理想的孵育溫度究竟是28℃還是35℃,一直以來均是一個(gè)爭論點(diǎn)。普遍認(rèn)為,絕大多數(shù)皮膚癬菌在28℃~30℃的條件下,生長的最好[14]。但是很多學(xué)者提出,更高的溫度會(huì)更好[13]。Santos 與Norris認(rèn)為無論是28℃還是35℃,在作為單一變量變化時(shí),均不會(huì)顯著影響藥敏試驗(yàn)的結(jié)果[14]。而Ferna認(rèn)為,在28℃的條件下,真菌可以更好的生長[14]。
Nccls所建議的孵育時(shí)間為4 d。但在預(yù)試驗(yàn)環(huán)節(jié),約5 d時(shí)才開始可以看到培養(yǎng)基中點(diǎn)狀的菌落,但此時(shí)菌落非常細(xì)小,不易觀察。6 d時(shí),菌落變大,且不同濃度下菌落的大小及數(shù)量有明顯的梯度變化。7 d時(shí),菌落面積進(jìn)一步增加,但梯度比較模糊。因此,本試驗(yàn)決定選擇接種后6 d作為孵育時(shí)間,根據(jù)真菌具體的生長情況,做出相應(yīng)調(diào)整。有關(guān)孵育時(shí)間,以往的文獻(xiàn)顯示,受試真菌若為皮膚癬菌,則最佳孵育時(shí)間在3~20 d不等[13]。數(shù)據(jù)分析表明,增加孵育時(shí)間,不論是4 d增加至7 d,或是7 d增加至10 d,都會(huì)造成MIC判讀結(jié)果的不同[13]。因此應(yīng)選擇盡量統(tǒng)一的時(shí)間點(diǎn)進(jìn)行判讀。
本試驗(yàn)選擇Nccls所推薦的RPMI1640作為培養(yǎng)基。有文獻(xiàn)表明,RPMI1640培養(yǎng)基可以給予皮膚癬菌充分的生長條件[14]。因?yàn)樯潮谑掀咸烟且后w培養(yǎng)基(SDB)價(jià)格較為便宜,并且是實(shí)驗(yàn)室常用試劑,所以不少學(xué)者曾用SDB代替RPMI1640進(jìn)行接種,但用于皮膚癬菌的案例較少[12]。
[1]Kano R,Hirai A,Muramatsu M,R,et al.Direct detection of der?matophytes in skin samples based on sequences of the chitin syn?thase 1(CHS1)gene[J].Journal of veterinary medical science,2003,65(2):267-270.
[2]Faggi E,Pini G,Campisi E,et al.Application of PCR to distin?guish common species of dermatophytes[J].Journal of clinical mi?crobiology,2001,39(9):3382-3385.
[3]Standard A.NCCLS document M38-A.National Committee for Clinical Laboratory Standards[S].Wayne PA,2002.
[4]Kano R,Nakamura Y,Watari T,et al.Molecular analysis of chi?tin synthase 1(CHS1)gene sequences of Trichophyton mentagro?phytes complex and T rubrum[J].Current microbiology,1998.37 (4):236-239.
[5]Kano R,Aihara S,Nakamura Y,et al.Chitin synthase 1(Chs1)gene sequences of Microsporum equinum and Trichophyton equi?num[J].Veterinary microbiology,2001.78(1):85-90.
[6]Roque H D,Vieira R,Rato S,et al.Specific primers for rapid de?tection of Microsporum audouinii by PCR in clinical samples[J]. Journal of clinical microbiology,2006,44(12):4336-4341.
[7]Bowen A R,Chen-Wu J L,Momany M,et al.Classification of fungal chitin synthases[J].Proceedings of the National Academy of Sciences,1992,89(2):519-523.
[8]Miller W H,Griffin C E,Campbell K L,et al.Muller and Kirk's Small Animal Dermatology7:Muller and Kirk's Small Animal Der?matology[C].2013:Elsevier Health Sciences.
[9]金藝鵬,林德貴.鹽酸特比萘芬對(duì)犬貓皮膚真菌病的療效觀察[J].中國獸醫(yī)雜志,2003,39(6):21-23.
[10]Santos D,J Hamdan.Evaluation of broth microdilution antifungal susceptibility testing conditions for Trichophyton rubrum.[J].Jour?nal of clinical microbiology,2005,43(4):1917-1920.
[11]Rex J H.Reference Method for Broth Dilution Antifungal Suscep?tibility Testing of Filamentous Fungi:Approved Standard[J].Clini?cal and Laboratory Standards Institute,2008.
[12]Guarro J,Llop C,Aguilar C,et al.Comparison of in vitro antifun?gal susceptibilities of conidia and hyphae of filamentous fungi[J]. Antimicrobial agents and chemotherapy,1997,41(12):2760-2762.
[13]Santos D,M Barros,J Hamdan.Establishing a method of inocu?lum preparation for susceptibility testing of Trichophyton rubrum and Trichophyton mentagrophytes[J].Journal of clinical microbiol?ogy,2006,44(1):98-101.
[14]Fernández-Torres B,Cabanes F J,Carrillo-Munoz A J,et al.Col?laborative evaluation of optimal antifungal susceptibility testing conditions for dermatophytes[J].Journal of clinical microbiology,2002,40(11):3999-4003.
[15]陸桂平.鹽酸特比萘芬和復(fù)方酮康唑?qū)θ婢〉呐R床療效觀察[J].養(yǎng)犬,2008,01:17-18.
Identification and drug susceptibility of pathogenic strains of canineand felinewith dermatophytosis
WANG Jing1,SUN Wei-dong2,JIN Yi-peng1
(1.College of Veterinary Medicine,China Agricultural University,Beijing 100193,China;2.Tianjinshi Baoling Animal Health Products Ltd.Co,Tianjin 301500,China)
In this study,used universal primer CHS1 1S,CHS1 1R and the repetitive oligonucleotide(GACA)4 as a primer to identify dermatophytes.In addition,the study used Nccls proposed in vitro susceptibility test for the clinical isolates(M38-A2).The aim of the study was to identify the clinical isolates accurately and rapidly and to find the effective antifungal drugs for clinical therapy.
dermatophytes;species identification;susceptibility testing
JIN Yi-peng皮膚癬菌病是犬貓臨床上極其常見的皮膚疾病,具有一定的傳染能力。而目前國內(nèi)對(duì)小動(dòng)物皮膚癬菌病的診斷,仍停留在形態(tài)學(xué)觀察(包括直接鏡檢及真菌培養(yǎng))層面。本試驗(yàn)使用分子生物學(xué)技術(shù),將犬貓感染、致病的皮膚癬菌準(zhǔn)確鑒定至種的水平,并試驗(yàn)已鑒定出種屬的皮膚癬菌對(duì)伊曲康唑、酮康唑及特比萘芬的敏感性,以指導(dǎo)快速診斷、正確用藥與治療,提高治愈率。
S858.292,S858.293
A
0529-6005(2016)07-0071-03
2015-05-27
王靜(1989-),女,獸醫(yī)師,碩士,從事小動(dòng)物皮膚病臨床工作,E-mail:wweverywhere@foxmail.com
孫偉東(1990-),女,獸醫(yī)師,碩士,從事獸藥注冊(cè)工作,E-mail:swd.happylife@163.com
注:孫偉東與王靜對(duì)本文具有同等貢獻(xiàn)
金藝鵬,E-mail:yipengjin@sina.com

