利用植物生長(zhǎng)調(diào)節(jié)劑誘導(dǎo)煙草器官分化的基礎(chǔ)教學(xué)實(shí)驗(yàn)
李玉明, 王洪鐘, 謝莉萍, 張貴友
(清華大學(xué) 生命科學(xué)學(xué)院, 北京 100084)
?
實(shí)驗(yàn)技術(shù)與方法
利用植物生長(zhǎng)調(diào)節(jié)劑誘導(dǎo)煙草器官分化的基礎(chǔ)教學(xué)實(shí)驗(yàn)
李玉明, 王洪鐘, 謝莉萍, 張貴友
(清華大學(xué) 生命科學(xué)學(xué)院, 北京100084)
在MS培養(yǎng)基中加入植物生長(zhǎng)調(diào)節(jié)劑,誘導(dǎo)無(wú)菌煙草葉片的生長(zhǎng)與分化,其中:2,4-D 可以誘導(dǎo)葉片生成愈傷組織;NAA與6-BA濃度比為5∶1時(shí),可以誘導(dǎo)葉片生成不定根;NAA與6-BA濃度比為1∶5時(shí),可以誘導(dǎo)葉片生成不定芽。
基礎(chǔ)實(shí)驗(yàn); 組織培養(yǎng); 誘導(dǎo)分化; 2,4-D ;NAA; 6-BA
有關(guān)植物生長(zhǎng)調(diào)節(jié)劑誘導(dǎo)植物生長(zhǎng)分化的研究十分普遍, 其中NAA和6-BA兩種生長(zhǎng)調(diào)節(jié)劑對(duì)不同種植物誘導(dǎo)分化出根和芽的相關(guān)研究較多[1-9],但尚未見(jiàn)NAA和6-BA對(duì)模式植物煙草葉片的誘導(dǎo)結(jié)果。因此,經(jīng)過(guò)設(shè)計(jì)不同濃度、不同比例的NAA和6-BA,找到最為符合誘導(dǎo)根、芽分化的濃度比。該實(shí)驗(yàn)使學(xué)生在掌握植物組織培養(yǎng)技術(shù)的同時(shí)還學(xué)習(xí)到有關(guān)植物細(xì)胞全能性和生長(zhǎng)調(diào)節(jié)劑的相關(guān)知識(shí)。
植物細(xì)胞的全能性,即植物體的每個(gè)細(xì)胞攜帶著一套完整的基因組,并具有發(fā)育成完整植株的潛在能力。因?yàn)槊總€(gè)細(xì)胞都來(lái)自受精卵,所以帶有與受精卵相同的遺傳信息。細(xì)胞分化完成后,就受到所在環(huán)境的束縛,相對(duì)穩(wěn)定,但一旦脫離原來(lái)所在的環(huán)境、成為離體狀態(tài)時(shí),在適宜的營(yíng)養(yǎng)和外界條件下,就會(huì)表現(xiàn)出全能性,生長(zhǎng)發(fā)育成完整的植株[10]。
植物組織培養(yǎng)是指在無(wú)菌條件下,分離并在培養(yǎng)基中培養(yǎng)離體植物組織(器官或細(xì)胞)[11]。當(dāng)煙草葉片被剪成1 cm2大小的外植體后,葉片邊緣創(chuàng)傷部位失去原有的葉的表皮、葉肉等組織結(jié)構(gòu)。在2,4-D誘導(dǎo)的作用下,退回到?jīng)]有分化的無(wú)組織的細(xì)胞團(tuán)或愈傷組織,這個(gè)過(guò)程也叫脫分化;在不同比例的NAA和6-BA的誘導(dǎo)作用下,葉片邊緣創(chuàng)傷部位還能分化出不定根或不定芽。
1 實(shí)驗(yàn)
1.1實(shí)驗(yàn)材料與儀器
實(shí)驗(yàn)材料:煙草Nicotiana tabacum。
實(shí)驗(yàn)儀器:超凈工作臺(tái)、高壓滅菌鍋、人工氣候箱、電子天平、pH計(jì)、移液器、剪刀、槍形鑷、燒杯、量筒、藥勺、玻璃棒、平皿、組織培養(yǎng)瓶等。
實(shí)驗(yàn)試劑:10×MS、0.1 g/L NAA(α-萘乙酸)、0.1 g/L 2,4-D(2,4-二氯苯氧乙酸)、0.1 g/L 6-BA( 6-芐
氨基腺嘌呤)、蔗糖、瓊脂、1mol/ L NaOH、1mol/L HCl。
1.2配制誘導(dǎo)培養(yǎng)基
(1) 10×MS(100 mL/L)采用Phytotechnology Laboratories公司的MS粉,配成10倍于工作濃度的基本培養(yǎng)液。方法:稱(chēng)取4.43 g的MS粉,溶于100 mL蒸餾水中,攪拌、混合均勻,4 ℃保存。
(2) 蔗糖(30 g/L)。蔗糖是碳源,同時(shí)起到維持滲透壓的作用。
(3) 瓊脂(0.8 g/L)瓊脂粉是固化劑、支持物。
(4) 植物生長(zhǎng)調(diào)節(jié)劑(以下簡(jiǎn)稱(chēng)調(diào)節(jié)劑)。將2,4-D、NAA、6-BA用少量的無(wú)水乙醇助溶后,加蒸餾水分別配制成濃度為0.1 g/L儲(chǔ)液,以便學(xué)生量取。實(shí)驗(yàn)設(shè)計(jì)中包括1個(gè)對(duì)照組和3個(gè)處理組。
對(duì)照組(T0)為30 mL MS。
誘導(dǎo)生根組(T1)為30 mLMS+0.03 mL6-BA+0.15 mL NAA。
誘導(dǎo)生芽組(T2)為30 mLMS+0.15mL 6-BA+0.03 mL NAA。
誘導(dǎo)愈傷組(T3)為30MS+0.03 mL 2,4-D。
(5) pH調(diào)節(jié)。pH調(diào)節(jié)時(shí)用精密pH試紙測(cè)定,根據(jù)測(cè)定結(jié)果,向培養(yǎng)基中加入適量的1 mol/ L NaOH、1mol/L HCl ,以達(dá)到pH=5.8。
誘引培養(yǎng)基配制見(jiàn)表1。

表1 誘導(dǎo)培養(yǎng)基配制表(30 mL)
1.3消毒
誘導(dǎo)培養(yǎng)基、剪子、鑷子、平皿需在高壓滅菌鍋120 ℃下滅菌15 min;無(wú)菌間和超凈臺(tái)紫外燈照射30 min。
1.4接種
坐在超凈工作臺(tái)前,用70%酒精棉球擦拭雙手、培養(yǎng)瓶和超凈臺(tái)面。待手上的酒精干了,點(diǎn)燃酒精燈;旋松培養(yǎng)瓶的蓋子,放到無(wú)菌風(fēng)道側(cè)面?zhèn)溆茫粚㈣囎印⒓舻对诰凭珶敉庋嫔献茻?冷卻后剪取葉片約1 cm2,剪取時(shí)注意盡量避開(kāi)主葉脈;剪好的葉片平鋪在培養(yǎng)基上,注意葉片下表面與培養(yǎng)基接觸,蓋好瓶蓋。
1.5培養(yǎng)
培養(yǎng)4周,25 ℃,光照16 h,暗8 h,濕度70%~80%。
2 實(shí)驗(yàn)結(jié)果
每周觀察1次不同處理的培養(yǎng)瓶,記錄外植體的生長(zhǎng)變化,結(jié)果見(jiàn)表2和圖1,剔出染菌培養(yǎng)瓶。
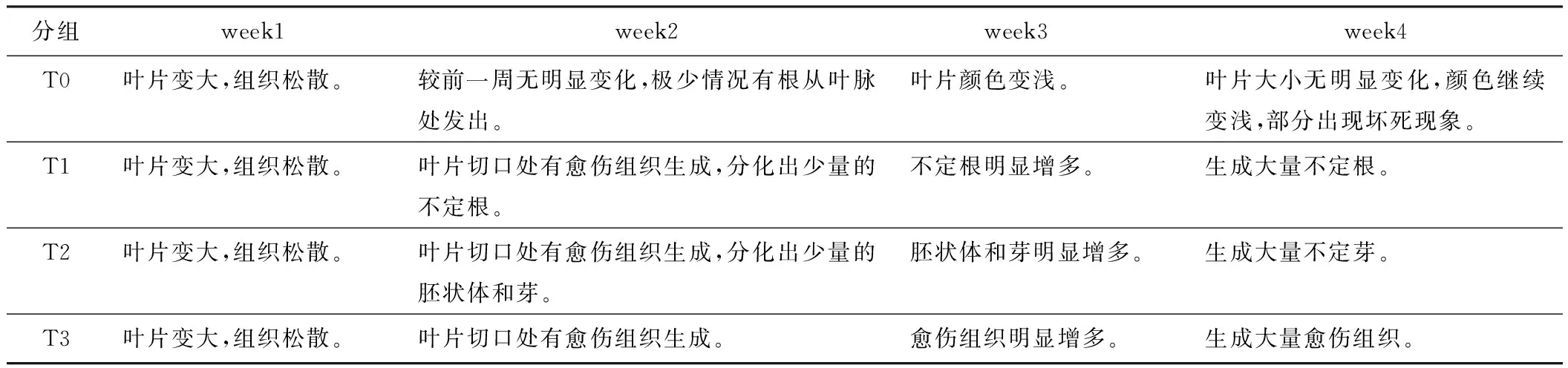
表2 煙草葉片誘導(dǎo)培養(yǎng)4周實(shí)驗(yàn)結(jié)果
(1) T0組為MS中未加調(diào)節(jié)劑的對(duì)照組。煙草葉片的變化表現(xiàn)為:葉片變大,這主要是離體葉片在光照和培養(yǎng)基的營(yíng)養(yǎng)下進(jìn)一步生長(zhǎng)的原因;葉片顏色逐漸變淺,可能是葉綠素逐漸降解的過(guò)程;也有少數(shù)葉片在葉脈處生根,可能是由于葉片本身的內(nèi)源生長(zhǎng)素作用的結(jié)果;第4周出現(xiàn)部分組織壞死現(xiàn)象。
(2) T1組為MS中加入NAA(5 mg/L)和6-BA(1 mg/L),兩者的濃度比為5∶1。NAA即α-萘乙酸,屬于人工合成的生長(zhǎng)素類(lèi)調(diào)節(jié)劑,6-BA即6-芐基腺嘌呤,屬于人工合成的細(xì)胞分裂素類(lèi)調(diào)節(jié)劑。許多教科書(shū)和研究結(jié)果認(rèn)為NAA與6-BA兩者之間存在一種劑量效應(yīng)。Skoog和Miller等人發(fā)現(xiàn)煙草愈傷組織根和芽的分化受培養(yǎng)基中生長(zhǎng)素和細(xì)胞分裂素比例的控制。較高的生長(zhǎng)素/激動(dòng)素可以刺激生根,相反,較高的激動(dòng)素/生長(zhǎng)素可以刺激芽的發(fā)生[12]。本實(shí)驗(yàn)中,在誘導(dǎo)培養(yǎng)基上生長(zhǎng)到1~2周時(shí),煙草葉片創(chuàng)傷邊緣的細(xì)胞開(kāi)始發(fā)生退分化、生成少量的愈傷組織,隨后逐漸分出不定根,并逐漸增多,培養(yǎng)到第4周已經(jīng)非常明顯看到大量的不定根。
(3) T2組為MS中加入NAA(1 mg/L)和6-BA(5 mg/L),兩者的濃度比為1∶5。經(jīng)過(guò)4周的誘導(dǎo)培養(yǎng),煙草葉片邊緣的細(xì)胞先退分化、生成少量愈傷組織,隨后愈傷組織在調(diào)節(jié)劑的作用下誘導(dǎo)生成不定芽。

圖1 植物生長(zhǎng)調(diào)節(jié)劑誘導(dǎo)煙草葉片器官分化結(jié)果
(4) T3組是MS中加入2,4-D(1 mg/L)。2,4-D即2,4-二氯苯氧乙酸,也屬于人工合成的生長(zhǎng)素類(lèi)調(diào)節(jié)劑。適合的濃度可以誘導(dǎo)煙草葉片退分化、生成愈傷組織,并控制愈傷組織增殖,但不發(fā)生再分化。
上述實(shí)驗(yàn)結(jié)果均符合相關(guān)理論,并且現(xiàn)象明顯。
3 總結(jié)
(1) 本實(shí)驗(yàn)驗(yàn)證了如下理論:①植物細(xì)胞的全能性;②植物組織存在退分化與再分化過(guò)程;③激素或生長(zhǎng)調(diào)節(jié)劑對(duì)植物的生長(zhǎng)、分化起到非常重要的調(diào)節(jié)作用;④生長(zhǎng)素與細(xì)胞分裂素兩者之間存在劑量效應(yīng)。
(2) 課堂上學(xué)生從誘導(dǎo)培養(yǎng)基的配制開(kāi)始學(xué)習(xí)組織培養(yǎng)的基本流程,從中掌握培養(yǎng)基的必要組分。配制方法;設(shè)計(jì)實(shí)驗(yàn)對(duì)照組和實(shí)驗(yàn)組;培養(yǎng)基和其他用具的消毒滅菌;超凈臺(tái)的使用,規(guī)范無(wú)菌操作的基本步驟;實(shí)驗(yàn)材料的培養(yǎng)、觀察、記錄,進(jìn)行結(jié)果分析。
(3) 實(shí)驗(yàn)中選用的煙草葉片為外植體,為無(wú)菌材料。以往使用帶菌外植體,在操作中由于消毒不當(dāng)會(huì)造成污染率且壞死率較高,成為實(shí)驗(yàn)成功的瓶頸,而使用無(wú)菌葉片可使實(shí)驗(yàn)成功率達(dá)到90%以上。
(4) 各種植物生長(zhǎng)調(diào)節(jié)劑的實(shí)際用量非常小,對(duì)于體積為30 mL的誘導(dǎo)培養(yǎng)基來(lái)說(shuō)不易稱(chēng)取,影響實(shí)驗(yàn)結(jié)果并浪費(fèi)課堂時(shí)間,因此將試劑配成儲(chǔ)液,提高了準(zhǔn)確性,便于操作,節(jié)省時(shí)間。
(5) 在配制培養(yǎng)基的過(guò)程中,pH的調(diào)節(jié)非常重要,酸堿度的不適會(huì)影響植物的正常生長(zhǎng),甚至導(dǎo)致植物死亡,pH過(guò)低還會(huì)導(dǎo)致培養(yǎng)基不易凝固,接種操作困難。
References)
[1] 鄒永梅, 黃雪方.“煙草組織培養(yǎng)”的技術(shù)探討[J].江蘇教育學(xué)院學(xué)報(bào),2007,24(3):28-29.
[2] 紀(jì)麗麗,韓 雪,王海霞.6-BA、 NAA對(duì)大花、 重瓣型非洲紫羅蘭組織培養(yǎng)的影響[J].中國(guó)園藝文摘,2012(9):17,40.
[3] 黃麗云,張奕琴. 6-BA 和 NAA 對(duì)檳榔幼胚離體培養(yǎng)的影響[J].熱帶生物學(xué)報(bào),2011,2(3):256-259.
[4] 章鵬程,陳瑜,鄧衍福. 6-BA與NAA不同濃度配比對(duì)大花蕙蘭原球莖誘導(dǎo)的影響[J].杭州師范大學(xué)學(xué)報(bào):自然科學(xué)版,2012,11(4):331-336.
[5] 康薇,鄭進(jìn). NAA 和6-BA對(duì)野生參薯愈傷組織誘導(dǎo)和不定芽分化、 生根的影響[J].湖北農(nóng)業(yè)科學(xué),2013,52(19):4809-4811.
[6] 孫瑤,黃康康. 不同激素對(duì)樹(shù)蘭組織培養(yǎng)的影響[J].浙江農(nóng)業(yè)科學(xué),2012(3):342-343.
[7] 韓柱,徐靈,羅素梅. 細(xì)胞分裂素及生長(zhǎng)素對(duì)微型月季側(cè)芽在組培快繁的影響[J].景德鎮(zhèn)高專(zhuān)學(xué)報(bào),2012,27(6):38-39.
[8] 詹虹,康永利 ,李潔. 煙草葉片再生芽器官組織培養(yǎng)研究[J].寧夏農(nóng)林科技,2012,53(12):81-83.
[9] 康實(shí). 煙草組織培養(yǎng)的研究進(jìn)展及應(yīng)用前景[J].楚雄師專(zhuān)學(xué)報(bào),1999,14(3):90-93.
[10] 潘瑞熾,董愚得.植物生理學(xué)[M].3版.北京:高等教育出版社,1995:247-251.
[11] 張志良,瞿偉菁,李小方.植物生理學(xué)實(shí)驗(yàn)指導(dǎo)[M].4版.北京:高等教育出版社,2003:200-202.
[12] 武維華.植物生理學(xué)[M].2版.北京:科學(xué)出版社,2003:304-305.
Basic teaching experiment by using plant growth regulators in nicotiana tabacum
Li Yuming, Wang Hongzhong, Xie Liping, Zhang Guiyou
(School of Life Sciences, Tsinghua University, Beijing 10084, China)
The growth and differentiation of sterile leaves could be induced by plant growth regulators. Callus was induced by 2, 4-D added in MS media. Adventitious roots were induced in MS media containing a mixture of NAA: 6-BA (5:1 concentration ratio). While the adventitious buds were induced when the concentration ratio of NAA: 6-BA was 1:5 in MS.
basic experiment; tissue culture; induction of differentiation; 2, 4-D; NAA; 6-BA
DOI:10.16791/j.cnki.sjg.2016.01.009
2015- 06- 18修改日期:2015- 08- 26
李玉明(1976—),女,黑龍江大慶,理學(xué)碩士,工程師,研究方向?yàn)橹参锷韺W(xué).
E-mail:ym-li@tsinghua.edu.cn
Q943.1;G642.423
B
1002-4956(2016)1- 0032- 03

