我國保健食品產品管理制度改革相關問題的探討與建議
趙洪靜,宛 超,張曉娜國家食品藥品監督管理總局保健食品審評中心,北京 100070
?
我國保健食品產品管理制度改革相關問題的探討與建議
趙洪靜,宛 超△,張曉娜
國家食品藥品監督管理總局保健食品審評中心,北京 100070
分析我國現有保健食品注冊制度存在的主要問題,通過比較國內、外主要國家保健食品相關產品管理制度特點,結合修訂《食品安全法》的新要求,對保健食品注冊制度改革、注冊與備案制度的界定、備案制度的實施等問題進行探討并提出政策性建議,以期對主管部門及研究者提供借鑒與參考。
保健食品;注冊制度;備案制度;改革
自1996年,保健食品注冊制度設立以來,經不斷改革與完善,形成了較為完整的注冊管理法規體系與管理制度,對于有效保證產品安全、規范行業發展、指導消費者合理選擇起了積極作用,并在提高人們健康水平的同時,促進了國民經濟發展。然而,保健食品監管也存在注冊管理法律地位缺失,注冊程序復雜、審查周期長,注冊及監管不能有效銜接等諸多問題。在審批制度改革、簡政放權的大背景下,在新修訂的《食品安全法》頒布實施之際,保健食品管理面臨挑戰與變革。如何在保障產品安全、有效,維護市場公平競爭的同時,促進產業創新發展,提高管理實效,將考量主管部門的監管能力與智慧。借鑒國際成熟管理經驗,穩步推進保健食品注冊制度改革,是優化社會資源配置,促進產業發展與創新的必由之路,值得深入研究與推敲。
本文通過對當前保健食品注冊管理存在問題的分析,比較國內、外保健食品相關產品管理制度特點,提出完善我國保健食品注冊管理制度的建議,期望對主管部門及研究者提供參考與借鑒。
1 當前保健食品注冊管理存在的主要問題
1.1 保健食品注冊基本情況 保健食品注冊是指行政主管部門根據申請人的申請,依照法定程序、條件和要求,對申請注冊的保健食品的安全性、有效性、質量可控性以及標簽說明書內容等進行系統評價和審查,并決定是否準予其注冊的審批過程[1-4]。自1995年10月《食品衛生法》首次確立了保健食品的法律地位以來,保健食品注冊管理在管理主體上經歷了原衛生部、原國家食品藥品監督管理局(SFDA)和國家食品藥品監督管理總局(CFDA)3個時期;在法律上經歷了《食品衛生法》時期及《食品安全法》時期;在管理法規上經歷了《保健食品管理辦法》時期及《保健食品注冊管理辦法(試行)》時期[1]。
1996—2014年,共批準保健食品14 430個(原衛生部批準5 076個,原SFDA及CFDA共批準9354個)。原SFDA及CFDA批準產品中營養素補充劑約占20%,其余為聲稱特定保健功能的食品。保健功能分布比較集中,主要為增強免疫力(免疫調節)、緩解體力疲勞(抗疲勞)、輔助降血脂(調節血脂),約占聲稱特定保健功能產品總量的55%。
1.2 存在的主要問題 根據2013年全國保健食品抽檢檢測數據,保健食品整體質量合格率在80%以上,存在的主要問題包括功效成分/標志性成分含量不合格,違法添加藥物等;從投訴舉報來看,主要問題包括夸大宣傳、套用批準文號等,提示保健食品市場秩序有待進一步規范。存在問題的原因錯綜復雜,涉及立法、經濟環境、歷史原因、邊界產品管理等多個方面,其中保健食品注冊管理存在的主要問題包括[5-10]:
1.2.1 保健食品法律法規缺失,監管法規體系不健全 2009年6月實施的《食品安全法》僅原則規定對保健食品實行嚴格監管,具體管理辦法由國務院規定。由于《保健食品監督管理條例》未能出臺,導致保健食品行政許可法律地位不明,生產許可、監管法規缺失,注冊與監管脫節。2015年4月,新修訂的《食品安全法》明確了保健食品立法地位,為實施注冊制度改革,健全監管法規體系奠定了基礎。
1.2.2 產品定位不清,易導致混淆 保健食品原料多為中藥材原料,含中藥材原料(包括藥食同源物品)產品約占注冊功能類產品總量的76%;部分涉及疾病風險的功能聲稱描述,如輔助降血脂、輔助降血壓等,與藥品功能主治相接近;產品劑型多為膠囊、片劑、口服液;加之部分企業夸大治療宣傳,易導致與中藥混淆。同時,保健食品還存在普通食品形態,如飲料、酒、酸奶、餅干等,易與食品混淆。部分產品以普通食品方式生產、銷售,未經注冊,非法聲稱保健功能,混亂市場秩序。
1.2.3 保健食品注冊制度亟待完善 注冊制度存在一些固有缺陷:1)單一的注冊管理制度在一定程度上限制了行政效能,產品管理均采取統一的注冊制,降低行政效率;2)對原料、功能、檢驗及評價方法等規定過細,部分原料相同、配方類似的產品重復申報審查,一定程度上限制了產品原料、功能創新;3)審批環節多,審評尺度難以完全統一,注冊周期較長。
1.2.4 產品申報數量居高不下,給有限的管理資源造成壓力 據統計,2005—2014年,新產品年平均申報產品數量為1 122個,年平均注冊產品數量為767個,2013年以來,產品年平均申報數量迅速增加到1 591個,同比增長達50%,產品申報數量一直居高不下。同時注冊審評要求不斷提高,時限緊、任務重,給有限的行政資源、技術審評力量、檢測資源等帶來壓力。
1.2.5 科學研究薄弱,技術標準滯后 目前保健食品注冊工作多沿用了原衛生部及原SFDA 2005年前后出臺的法律法規及技術標準,保健食品原料名單、功能性評價程序及檢驗方法等已沿用十余年,沒有及時更新與修訂。基礎研究薄弱,關于原料的保健功能文獻數量多,但明確的量效關系研究依然缺乏,功效成分檢測方法和質量控制水平仍待進一步提高。保健食品相關的國家食品安全標準較少。這些均嚴重制約保健食品注冊管理工作的發展。
2 國內外保健食品相關產品管理特點比較
由于各國保健食品相關產品的名稱不同,在比較各國管理法規時,明確產品范疇尤為重要。這類產品主要為膳食(食品)補充劑和功能性食品(產品)。相關國家對于保健食品相關產品的管理既有共性,又各具特點(見附表)。共同點:都有相對獨立的法規體系,有明確的法律定義,均強調補充膳食的有益成分及對人體促進健康的作用;產品形態多為小劑量、可計量、濃縮型的片劑、膠囊、粉劑等;屬于多數國家的法規體系里食品管理范疇。管理的重點均為原料的安全性及功能聲稱的科學性及真實性,多數國家制定了可用原料名單及功能聲稱名單。不同點:1)管理方式不同。美國與歐盟是上市許可寬松型管理模式的代表,主要采取自行合規及備案制,這種管理模式對企業的誠信要求較高,強調事后監管。日本與韓國實行備案(或自行合規)與注冊相結合的管理制度,對于具有產品標準的、使用名單內原料、功能聲稱的,采取備案制;對于新原料、新聲稱、新品種,采取注冊制。中國、加拿大、澳大利亞是實行注冊制的代表。中國采取單一的注冊制,加拿大和澳大利亞采取注冊制并同時注意分級管理,對于符合特定要求的產品,實行簡略申請或網上登記制度。2)對于健康(功能)聲稱的管理,多數國家都為保健食品相關產品制定了獨立的管理法規及名單,與普通食品所用聲稱相區別;少數國家采取統一管理模式。統一的管理法規及要求,適用于普通食品及保健食品相關產品,如美國、歐盟。
3 探討與建議
3.1 落實《食品安全法》,健全法規體系 新修訂的《食品安全法》(2015年版)規定對保健食品實行注冊與備案相結合的管理制度,為保健食品注冊制度改革奠定了法律基礎,實現了重大突破。但保健食品立法工作仍任重道遠,一是保健食品具有功效、原料、形態等方面的特殊性,而《食品安全法》本身更關注食品安全與整體管理,對于保健食品功效、技術創新等關注不足。二是新修訂的《食品安全法》(2015年版)提出了全新的保健食品監管要求,許多涉及注冊制度改革,如注冊與備案“雙軌制”管理制度,功能目錄與原料目錄管理等,如何用足、用好立法原意,制定相關配套部門規章及規范性文件,深入推動注冊制度改革,將面臨挑戰。三是保健食品生產與監督一直缺乏統一明確的管理規定,生產監督法律法規既自成體系,又與前期注冊法規相聯系、相配合,應以本次改革為契機,研究制定與注冊法規有效銜接的生產許可、上市后監管的法規體系。
3.2 借鑒國外管理經驗,結合我國實際,深化注冊制度改革 通過對比,主要有以下3點經驗值得借鑒:1)對于產品管理,采取注冊與備案相結合的管理制度;對于原料及功能聲稱管理,采取名單制與名單外評價的管理制度;2)實行分級分類的注冊管理,結合我國保健食品實際,合理劃分注冊與備案產品范圍。將營養素補充劑、用量及功效明確的單一原料產品納入備案管理,對于缺乏明確的用量及功效關系、統一的原料質量標準的產品,及難以標準化管理的復方產品,納入注冊管理。逐步完善注冊制度,制定成熟類型產品的技術要求,及時轉為備案管理;將變更申請中部分事項、補發批件等,列入簡略申請,簡化程序,加快進度。
3.3 創新體制機制,建立更為科學、高效的審評審批體系 制定良好審評工作細則及審評質量管理規范,明確專家和審評人員權責,完善審評機制,強化責任和時限管理。審評意見應當一次性提出,限制補充資料次數。加強技術審評過程中共性疑難問題研究,及時將研究成果轉化為審評工作技術標準,提高審評標準化水平,減少審評自由裁量權。全面公開受理、技術審評、產品檢驗和現場檢查條件與要求,提高審評審批透明度。公開受理和注冊的相關信息,引導申請人理性研發、有序申請。
3.4 基于風險-效益原則,謹慎設計備案制度 本次改革亮點之一在于引入了備案制度,但備案制度的實施主要存在兩方面的問題:一是由于缺乏明確的定義,各利益相關方對于備案的理解不同而導致不同的預期。主要包括備案的范圍、時間要求(事前還是事后)、是否需要評估、結果是否影響上市等。二是如何科學制定允許備案產品目錄。各國備案制度也不盡相同,一般多發生在事前,大多需要審核或評估。在美國,評估的結果不影響上市;韓國等其他國家需要修改完善直至符合相關要求才能上市;澳大利亞的登記制度與備案類似,需要審核,結果影響上市結論。我國應當在借鑒國外經驗的同時,結合市場及監管實際,謹慎設計備案制度。建議采取事前備案,按照備案要求,運用信息化手段,實行網上信息填報與系統自動審核,實現現場備案。未經備案的產品,不得生產上市。
3.5 統一規劃,加強引導,建立科學嚴謹的原料目錄及保健功能目錄管理體系 新修訂的《食品安全法》(2015年版)規定,實行保健食品原料目錄管理和允許保健食品聲稱的保健功能目錄管理制度。原料目錄及保健功能目錄是實施注冊與備案管理的重要依據;同時,從原料、功能角度,明確產品定位,界定保健食品與中藥、普通食品的管理邊界。名單制管理是國際上比較通行的作法(見附表),雖然各國的名單內容與管理方式不盡相同,但統一的納入原則是要有充分的科學依據及科學的評價體系,其中以歐盟PASSCLAIM為代表評價體系最為系統和完整。我國對于名單制管理缺乏經驗,新修訂的《食品安全法》要求原料目錄應當包括原料、用量及對應的功效,對目錄的科學性和實用性提出了較高要求。主管部門應加強研究,不斷提高目錄管理水平:一是要制定科學、符合實際的目錄納入原則;二是要確定目錄的主要內容及項目;三是要逐步建立科學的評價體系;四是要根據科學進展,對目錄實行動態管理。
3.6 配合注冊制度改革,加強監管制度建設 主管部門應當摒棄“重審批、輕監管”的傳統思維,樹立注冊與監管并重的管理理念。將保健食品監管統一納入食品管理體系,包括食品安全國家標準、生產經營許可、監督檢查等,統籌考慮,做好頂層設計,提高工作實效。嚴厲打擊違法違規行為,為注冊制度改革提供良好的市場及法治環境。
綜上所述,保健食品注冊制度改革是一項復雜的系統工程,需要健全法制,完善標準,強化監管,落實主體責任;同時加強宣傳與教育,逐步建立理性消費環境,形成社會共治格局。只有各方形成合力,才能落實改革措施,取得改革實效,保證產品質量與安全,促進產業發展。
3.7 積極推動信用體系建設,落實企業主體責任 加大對從業人員道德規范、行為準則以及法律法規的培訓力度,牢固樹立尚德守法的價值觀,不斷增強尚德守法自覺性。發揮好行業組織作用,加強行業自律,倒逼企業落實生產經營主體責任,促進產業健康發展。做好行業內部風險隱患的排查,及時風險提示、及時風險預警,及時組織研究,切實防范系統性風險。按照國家統一規劃和部署,結合食品藥品行業領域的實際情況,加快建設食品藥品安全信用信息數據庫和信息交換平臺,加強保健食品企業信用信息收集、管理和公開,開展信用等級評價,及時公開各類違法企業和產品名單,讓失信企業無法生存,讓違法產品無處藏身。同時,搭建與企業、協會、消費者等社會各界交流溝通的平臺,充分發揮人民群眾的智慧和力量,構建社會共治的新格局。
4 小結
受各種復雜因素影響及歷史問題積累,保健食品行業及監管存在一些問題,從行業發展層面看,一是安全保障體系不完善,創新能力不足,產業基礎薄弱、產品結構不合理;二是少數企業鉆法律制度空子、打擦邊球,對自身要求不嚴,擾亂市場秩序,嚴重影響民眾對于國產保健食品的信心;三是產品虛假夸大宣傳、非法宣稱功能問題突出,違法添加行為時有發生。從政府監管層面看,一是法律法規體系不夠完善,工作機制體制有待調整和建立;二是監管模式和工作思路尚需系統完善和統一認識,市場監管執法還不夠嚴格有力;三是技術力量和信息、檢測等技術保障體系有待加強;四是標準體系不健全,產品質量監管存在不少誤區與盲點;五是尚未建立有效運行的監管公共平臺,難以形成監管合力,實現社會共治。
新修訂的《食品安全法》明確國家對保健食品等特殊食品實行嚴格監督管理。一是明確對保健食品實行注冊與備案分類管理制度;二是對于特殊食品實行高于普通食品的生產質量管理要求,建立良好生產規范;三是進一步強化保健食品企業全面落實主體責任;四是制定了更加嚴厲的違法違規行為處罰規定及廣告管理規定。在現有審評審批制度改革的大背景下,更加充分體現了國家對于保障保健食品食用安全與質量的高度重視。
為落實《食品安全法》相關要求,推動行業發展,保健食品管理制度需要變革,其中注冊制度改革是其重要的組成部分。保健食品注冊制度改革是一項復雜的系統工程,需要健全法制,盡快完善法規體系,完善配套規章規范性文件,形成科學、系統、嚴密的法律法規和制度體系。完善標準,強化監管,落實主體責任;同時加強宣傳與教育,逐步建立理性消費環境,形成社會共治格局。只有各方形成合力,才能落實改革措施,取得改革實效,保證產品質量與安全,促進產業發展。
[1] 趙洪靜,張李偉,佟娜.保健食品變更申請注冊情況及常見問題分析[J].中國食品衛生雜志,2014,26(3):259-262.
[2] 王姝,李松波,富曉楠,等.保健食品注冊實行雙軌制的分析和思考[J].安徽農業科學,2014,42(35):12677-12678.
[3] 周素娟,宛超,白鴻.對我國單一原料保健食品審批概況的調查及注冊管理的建議[J].中國食品衛生雜志,2010,22(2):143-147.
[4] 王獻仁,趙洪靜.完善我國保健食品注冊制度思考[J].上海食品藥品監管情報研究,2011,(5):25-32.
[5] 王姝,富曉楠,李松波,等.對《保健食品注冊管理辦法》修訂稿的解析及思考[J].中國衛生產業,2015,12(3):194-195.
[6] 姜雨,佟娜.我國片劑保健食品的注冊、審評及審批情況[J].中國實驗方劑學雜志,2014,20(18):225-227.
[7] 劉霽.我國保健食品注冊管理制度的演變與安全監管[J].癌變·畸變·突變,2012,24(4):321-324.
[8] 周素娟,楊飛,白鴻.我國保健食品不予注冊現狀調查及啟示[J].中國食品衛生雜志,2012,24(4):345-347.
[9] 梁立,吳天美,喬小青.淺析廣東省保健食品品種注冊技術審評[J].科技創業月刊,2013,26(8):93-95.
[10]劉彬,李銳,劉澤龍,等.保健食品注冊中形式審查要點評析[J].首都醫藥,2010(8):8-10.
Exploration and Suggestions of the Related Issues of Health Food and Product Management Regulations Reform in China
ZHAO Hongjing,WAN Chao△,ZHANG Xiaona
Center of Food Supervision of China Food and Drug Administration,Beijing 100070,China
Main issues existed in current health food registration system in China were analyzed,the reform of health food registration system,the definitions of registration and filing system,the implementation of filing system were explored and the policy suggestions were raised through comparing the features of main countries health food related-product management system at home and broad,combined with new requirements of revising food safety laws,in the wish of providing references for the main departments and researchers.
health food;registration system;filing system;reform
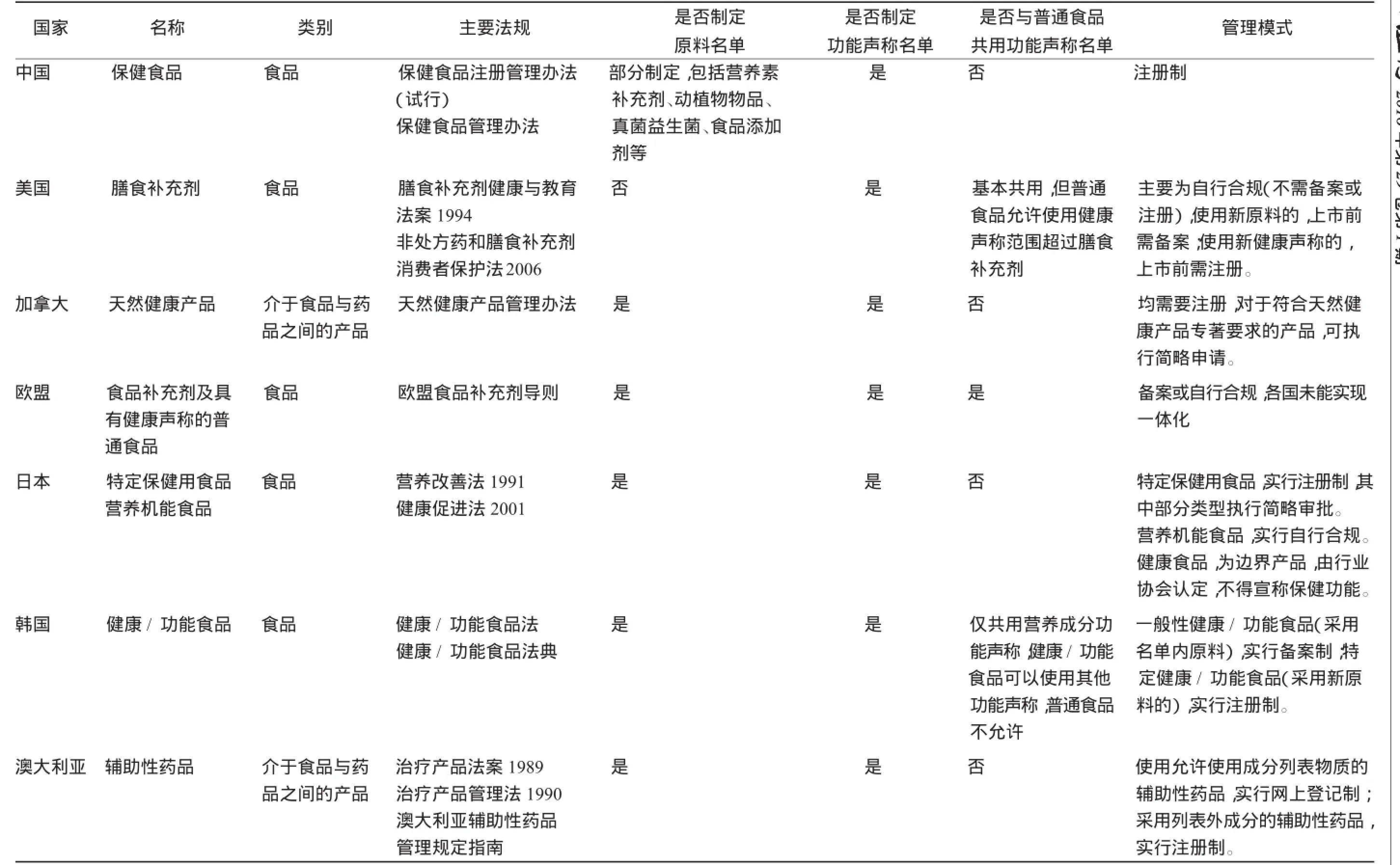
附表 各國保健食品相關產品管理制度對比
R246
A
1004-6852(2016)01-0103-05
2015-11-27
趙洪靜(1977—),女,碩士學位,副主任藥師。研究方向:保健食品管理相關政策與食品安全監管領域研究。

