胰島素樣生長因子-1和轉化生長因子-β1在來曲唑誘導多囊卵巢綜合征模型大鼠中的表達及意義
陳 巍
(海口市婦幼保健院婦產科,海南 海口 570203)
?
胰島素樣生長因子-1和轉化生長因子-β1在來曲唑誘導多囊卵巢綜合征模型大鼠中的表達及意義
陳巍
(海口市婦幼保健院婦產科,海南海口570203)
目的研究胰島素樣生長因子(IGF)-1和轉化生長因子(TGF)-β1在來曲唑誘導多囊卵巢綜合征(PCOS)模型大鼠中的表達及意義。方法將46只SD雌性大鼠按隨機數字表法分為對照組和實驗組各23只。實驗組應用來曲唑(1 mg·kg-1·d-1)灌胃制備PCOS模型,對照組灌胃等量的羧甲基纖維素,兩組均灌胃21 d。每日采集陰道涂片觀察大鼠動情周期變化,21 d后收集大鼠血清及卵巢組織切片,采用放射免疫法測定血清中的性激素水平,顯微鏡下觀察卵巢組織的病理組織學改變,應用免疫組化法測定切片中IGF-1和TGF-β1的表達情況。結果實驗組大鼠灌胃12 d時即失去動情周期變化,卵巢組織病理學顯示呈PCOS相關改變。實驗組大鼠血清促黃體生成素(LH)、孕酮(P)水平顯著高于對照組(P<0.05),而兩組促卵泡刺激素(FSH)、雌二醇(E2)、睪酮(T)水平無統計學意義(P>0.05)。實驗組IGF-1在兩組卵泡膜細胞和顆粒細胞中的表達高于對照組(P<0.05);TGF-β1在卵泡膜細胞、顆粒細胞和間質細胞中均有表達,且實驗組卵泡膜細胞中的表達強于對照組(P<0.05),而在其他細胞中的表達(P>0.05)。結論來曲唑誘導的PCOS模型大鼠與人類PCOS特征相似,而IGF-1、TGF-β1在PCOS大鼠模型中呈高表達,兩種指標的檢測對人類PCOS的診斷及發病機制研究具有重要參考價值。
多囊卵巢綜合征;胰島素樣生長因子Ⅰ;轉化生長因子β1
多囊卵巢綜合征(PCOS)發病率約6%~12%〔1〕。目前其發病原因尚不十分明確,普遍認為高雄激素血癥及胰島素抵抗是其發生的關鍵因素。胰島素樣生長因子(IGF)-1與轉化生長因子(TGF)-β1作為卵巢內產生的生長因子,在細胞生長、分化、凋亡和血管生成等方面發揮多種生物學作用,也在PCOS的發生發展中起到重要作用。有研究表明,IGF-1和TGF-β1水平異常,將對卵巢組織內卵泡發育和正常細胞的轉化等造成影響〔2〕,引起體內內分泌失調。本研究旨在探索二者在PCOS形成過程中的作用。
1 材料與方法
1.1材料
1.1.1實驗動物選取6周齡清潔級雌性SD大鼠46只(由海南醫學院動物實驗中心提供),體重100~150 g,均表現4 d的規律動情周期。于動物實驗室自由進食喂養,室溫(22.0±3.0)℃,濕度50%~75%,自然光照,適應性喂養1 w。
1.1.2主要試劑與儀器來曲唑片(江蘇恒瑞制藥廠),放射免疫法(RIA)藥盒(天津中新科炬生物制藥有限公司),免疫組織化學試劑盒、IGF-1和TGF-β1試劑盒(北京中杉金橋生物技術有限公司),切片機(金華華速科技有限公司),光學顯微鏡(日本OLYMPUS),圖像分析系統(上海山富科學儀器有限公司)
1.2實驗方法
1.2.1動物分組與模型制備采用隨機數字表法將46只大鼠隨機分為實驗組與對照組各23只。實驗組大鼠通過灌胃來曲唑1 mg·kg-1·d-1(預先溶于體積分數1%的羧甲基纖維素中)建立PCOS模型。對照組每日灌胃等量的羧甲基纖維素,兩組均持續灌胃21 d。
1.2.2標本采集實驗組造模成功大鼠最后一次灌胃12 h后,禁食12 h,行10%水合氯醛麻醉,對照組于最后一次動情間期麻醉。處死大鼠,經心臟放血收集血液5 ml,2 000 r/min離心20 min取血清,-40℃凍存待用。摘取大鼠雙側卵巢組織,經修剪、稱重后,迅速投入10%中性甲醛中固定,常規石蠟包埋,制成厚度為4 μm的切片,經烤片、脫水、蘇木精-伊紅染色、脫水、封固等處理后保存。部分切片行病理組織學觀察,另一部分進行免疫組織化學測定。
1.3觀察指標
1.3.1動情周期監測灌胃期間每日進行陰道涂片以監測大鼠動情周期的變化,顯微鏡下大鼠動情周期判斷標準;(1)動情前期:全部顯示為有核上皮細胞,偶有少量角化細胞;(2)動情期:全部為無核角化細胞或有少量上皮細胞;(3)動情后期:可見白細胞、角化細胞、有核上皮細胞;(4)動情間期:可見大量白細胞和少量上皮細胞或黏膜。
1.3.2卵巢病理組織學檢查。
1.3.3血清性激素采用放射免疫法(RIA)藥盒測定血清中的促黃體生成素(LH)、促卵泡刺激素(FSH)、雌二醇(E2)、孕酮(P)及睪酮(T)水平,確定大鼠體內內分泌的改變。
1.3.4卵巢組織中IGF-1和TGF-β1的表達取卵巢組織切片,采用免疫組織化學非生物二步法試劑盒進行組織染色,具體包括脫蠟、梯度酒精水化、抗原修復、一抗孵育、二抗孵育、顯色、脫水、透明、封片等。分別采用IGF-1和TGF-β1試劑盒檢測卵巢組織中IGF-1和TGF-β1的表達情況。所有操作過程嚴格按說明書進行。以磷酸鹽緩沖液(PBS)代替一抗作陰性對照。每張切片隨機觀察5個高倍鏡視野,在圖像分析系統下進行圖像灰度值分析。
1.4統計學方法采用SPSS14.0軟件進行t檢驗。
2 結 果
2.1兩組大鼠動情周期變化實驗組大鼠于灌胃12 d后失去動情周期的規律性變化,均顯示為動情間期時相,提示大鼠無排卵。對照組動情周期正常。
2.2兩組大鼠卵巢質量及組織病理學改變實驗組大鼠卵巢質量為(32.54±6.71)mg/100 g體質量,對照組大鼠為(25.16±5.94)mg/100 g體質量,兩組比較差異顯著(t=10.430,P<0.05)。顯微鏡下卵巢切片組織病理學觀察可見:對照組卵巢呈現不同發育階段的卵泡及黃體,卵泡內顆粒細胞多為6~8層;實驗組中卵泡內卵母細胞缺失,初級卵泡、囊狀擴張的卵泡和閉鎖卵泡增多,顆粒細胞層減少至2~3層,卵泡膜增厚,間質細胞增生。
2.3兩組大鼠血清性激素水平比較灌胃處理21 d后,實驗組大鼠血清中的LH、P水平均顯著高于對照組,差異有統計學意義(P<0.05);而兩組FSH、E2、T水平無統計學意義(P>0.05)。見表1。
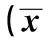
表1 兩組大鼠血清性激素水平比較±s,n=23)
2.4兩組大鼠卵巢組織中IGF-1、TGF-β1的表達免疫組化法結果顯示,IGF-1主要表達于卵泡膜細胞和顆粒細胞中,且實驗組的表達高于對照組(P<0.05);TGF-β1在卵泡膜細胞、顆粒細胞和間質細胞中均有表達,在實驗組卵泡膜細胞中的表達強于對照組(P<0.05),而在其他細胞中的表達兩組無統計學意義(P>0.05)。見表2、表3。

表2 兩組大鼠卵巢組織中IGF-1的表達

表3 兩組大鼠卵巢組織中TGF-β1的表達
3 討 論
PCOS是婦科常見的內分泌異常和代謝異常所致的排卵功能障礙性疾病,臨床主要表現為肥胖、多毛、閉經、月經不調等,患者由于肥胖癥、雄激素升高及胰島素抵抗等多種因素導致患2型糖尿病、心血管疾病、高雄激素血癥等病的風險大大增加〔3〕,該病具有反復性、難治性、終身性的特點,對患者的生理與心理健康造成嚴重危害〔4〕。PCOS的發病機制尚未完全闡明,不同領域的學者們從不同角度進行了大量研究,中醫學研究發現,PCOS的發生與患者痰濕質、氣郁質體質有關〔5〕;也有研究對PCOS的易感基因進行研究,指出有包括與胰島素調節、性激素調節和心血管風險相關的共37個基因與PCOS的發生有關〔6〕。而目前普遍認同的觀點是,高雄激素血癥、高胰島素血癥及胰島素抵抗是引發PCOS的主要病因。
IGF-1是一類在結構和功能上與胰島素有較高同源性的多肽生長因子,在促進細胞增殖、分化及血管形成等方面發揮重要作用。TGF-β1是細胞自分泌和旁分泌的細胞內源性生長抑制因子,在控制細胞生長、胚胎發育、免疫調節和細胞凋亡等方面發揮雙向調節作用。IGF-1和TGF-β1均可由卵巢合成,在生殖細胞的存活與凋亡中起重要的調控作用,其表達異常可能會引起卵泡的生長和發育障礙,造成體內內分泌功能紊亂。有研究發現,IGF-1和TGF-β1表達異常與卵巢疾病的發生有關〔7,8〕。
本研究說明來曲唑灌胃能成功建立大鼠PCOS模型。此外,本研究還提示IGF-1對PCOS的發生發展起促進作用,其作用機制可能是:(1)IGF-1與胰島素具有較高的同源性,在分子結構、受體及功能上發生相互重疊〔9〕,在卵巢功能中形成一整套完善的調節系統〔10〕。卵巢在胰島素和IGF-1的過度刺激下,對卵泡生成素、黃體生成素敏感性顯著增加,使初級卵泡增加,卵泡發育減慢甚至停止,而原始卵泡在其刺激下不斷啟動發育,造成多囊卵巢的形成;(2)IGF-1可協同LH,促進雄激素的合成和分泌〔11〕,IGF-1還能協同胰島素進一步抑制肝臟,造成游離睪酮水平的升高;(3)IGF-1參與的卵巢血管生成異常也是造成PCOS等多種病變的重要原因〔12〕。
本研究與以往研究結果相符〔13〕,其原因可能為:TGF-β1可誘導發揮血管內皮生長因子(VEGF)發揮作用,促進血管生成,引起多囊卵巢間質纖維化和包膜增厚,阻礙卵泡的發育〔14〕,同時,其對卵泡膜細胞的增殖、分化和FSH受體的形成也有重要影響。此外,TGF-β1還可促進細胞外基質(ECM)的合成和沉積,影響生殖細胞的周期性變化〔15〕。
1黎小斌,梁潔莎,孟君,等.靈術顆粒對多囊卵巢綜合癥作用機制的實驗研究〔J〕.實用醫學雜志,2013;29(16):2657-9.
2郭鵬.Ins、IGFs及VEGF在多囊卵巢綜合征中的研究〔D〕.延吉:延邊大學,2013.
3皮紅艷,楊秀敏,楊秀梅,等.多囊卵巢綜合征伴胰島素抵抗的研究進展〔J〕.現代生物醫學進展,2013;13(35):6998-7000.
4周莉.多囊卵巢綜合征的治療〔J〕.醫藥前沿,2014;4(10):144-5.
5王婷婷,沈旸.多囊卵巢綜合癥體質類型及相關因素的流行病學調查〔J〕.中國衛生產業,2013;7(25):131-2.
6張玉娟.婦女多囊卵巢綜合征易感基因的研究〔J〕.實用婦科內分泌電子雜志,2015;2:61-2.
7劉彩艷,曲芃芃.IGF-Ⅰ、TGF-β1在卵巢上皮性腫瘤中的表達及與微血管密度的關系〔J〕.中國腫瘤臨床,2012;18:1337-41.
8劉會平.IGF-1、TGF-β1、ER、PR在子宮內膜增生及癌組織中的表達及意義〔D〕.太原:山西醫科大學,2013.
9徐碧紅,張鳳.肥胖與非肥胖多囊卵巢綜合征患者內分泌激素對比研究〔J〕.華南國防醫學雜志,2011;5(5):36-8.
10Toprak S,Y?nem A,Cakir B,etal.Insulin resistance in nonobese patients with polycystic ovary syndrome〔J〕.Horm Res,2001;55(2):65-70.
11羅涌,李啟富,宋穎,等.多囊卵巢綜合征患者血清IGF-1的變化及其與肥胖、糖脂代謝的關系〔J〕.第三軍醫大學學報,2011;10(10):1087-8.
12De Groot PC,Dekkers OM,Romijn JA,etal.PCOS,coronary heart disease,stroke and the influence of obesity:a systematic review and meta-analysis〔J〕.Hum Reprod Update,2011;17(4):495-500.
13田俊華,田秀珠,馬淑狀,等.IGF-1和TGF-β1在多囊卵巢綜合征大鼠卵巢中的表達及意義〔J〕.山西醫科大學學報,2009;8:700-3,768.
14苗竹林,王自能,楊艷東,等.TGF-β1在PCOS卵巢間質纖維化形成中的作用〔J〕.生殖與避孕,2008;28(3):174-9.
15Singh NN,Ramji DP.The role of transforming growth factor-beta in atheroschlerosis〔J〕.Cytokine Growth Factor Rev,2006;17(6):487-99.
〔2015-10-23修回〕
(編輯滕欣航)
10.3969/j.issn.1005-9202.2016.14.019
陳巍(1979-),女,主治醫師,主要從事婦科內分泌研究。
R711.75
A
1005-9202(2016)14-3395-03;

