消巖湯對A549/DDP細胞自噬及耐藥蛋白的影響研究*
楊佩穎,許文婷,劉宏根,張 欣,張 瑩,于曉宇,賈英杰
(天津中醫藥大學第一附屬醫院,天津 300193)
消巖湯對A549/DDP細胞自噬及耐藥蛋白的影響研究*
楊佩穎,許文婷,劉宏根,張欣,張瑩,于曉宇,賈英杰
(天津中醫藥大學第一附屬醫院,天津300193)
[目的]通過消巖湯對耐順鉑人肺腺癌細胞A549/DDP多藥耐藥及自噬蛋白的影響,探究消巖湯對耐順鉑人肺腺癌A549/DDP的耐藥逆轉作用及探討相關分子通路。[方法]建立穩定細胞耐藥模型,連續灌胃不同濃度消巖湯10 d后,通過血清藥理學的實驗方法,提取藥物血清,用含藥血清作用于肺腺癌細胞耐藥細胞A549/DDP,通過實時熒光定量逆轉錄聚合酶鏈反應(QPT-PCR)和蛋白免疫印跡法(Werstern Blot)檢測A549/DDP耐藥、自噬相關基因的表達及相關通路蛋白的變化。[結果]高劑量消巖湯,低劑量消巖湯和生理鹽水作用于肺腺癌耐藥細胞A549/DDP,檢測A549/DDP細胞中耐藥相關蛋白P-糖蛋白(P-gp)、肺抗藥性相關蛋白(LRP)及自噬相關蛋白Beclin1,HMGB1 mRNA和蛋白表達變化,發現高劑量組消巖湯處理細胞株后P-gp、LRP及自噬相關蛋白Beclin1,HMGB1 mRNA和蛋白均發生降低(P<0.05),進一步發現消巖湯可影響AKT1-mTOR相關基因,消巖湯明顯降低AKT1,mTOR蛋白的表達。[結論]消巖湯通過影響AKT1-mTOR分子通路進而影響耐藥相關蛋白P-gp、LRP及自噬相關蛋白Beclin1,HMGB1基因的變化。
消巖湯;細胞自噬;耐藥;分子通路
化療在惡性腫瘤綜合治療中有舉足輕重的地位,據美國癌癥協會估計,90%以上腫瘤患者死亡在不同程度上受到耐藥的影響。在惡性腫瘤的治療過程中,腫瘤患者對化療藥物的耐藥性成為腫瘤治療的最大瓶頸之一。有些腫瘤,在治療開始時就會出現對藥物的高度耐受,另一些腫瘤,化療開始時有效,久用則產生抗藥,如小細胞肺癌等,出現獲得性抗藥性(Acquired resistance)稱為繼發性耐藥[1]。化療過程中產生耐藥性是腫瘤化療失敗的主要原因,因此克服多藥耐藥性是治療腫瘤不可回避的問題[2]。腫瘤細胞對化療藥物的耐藥性與腫瘤的發生一樣,是一個多因素、多步驟的過程。目前研究耐藥機制較為廣泛的是P-糖蛋白(P-gp)外排,大多數研究認為化療藥物在體內作用減少主要是因為藥物在細胞內流減少,或者由于外排增多,其中P-gp、肺抗藥性相關蛋白(LRP)是細胞膜的轉運蛋白,腫瘤藥物可以通過細胞膜的轉運蛋白使外排增多,從而減少藥物在細胞中濃度。目前大量研究顯示,細胞自噬的變化也可導致細胞耐藥性的改變。自噬在腫瘤發生發展中的作用是復雜的,是腫瘤治療的雙刃劍。化療藥物處理的腫瘤細胞可以發生死亡性自噬和保護性自噬[3]。多種抗腫瘤治療后,因腫瘤缺氧,一定程度上削弱了抗腫瘤治療的效果,從而產生耐藥[4]。大量實驗證明,通過抑制細胞自噬,使腫瘤患者對抗癌藥物和放療的敏感性增加。有學者發現通過抑制核糖核酸(RNA)干擾自噬相關基因的表達可上調自噬表達,從而逆轉乳腺癌細胞對多柔比星的耐藥性[5]。張潔等[6]發現對順鉑耐藥的A2780/DDP細胞中,下調自噬基因Beclin 1的表達對順鉑誘導的自噬激活具有抑制作用,提高了耐順鉑細胞的敏感性。在此基礎上,筆者將消巖湯分為低劑量組和高劑量組,并且與生理鹽水組相比較,分析消巖湯對耐藥基因和自噬基因的影響,并探索其分子機制。
1 材料與方法
1.1細胞人肺腺癌A549敏感細胞(由天津醫科大學基礎實驗中心提供),A549/DDP耐藥細胞(購于上海博谷生物科技有限公司:博谷公司采用恒定的順鉑濃度,周期性的作用于人肺腺癌A549敏感細胞,經過6個月的誘導,培育而成的耐順鉑人肺腺癌A549/DDP耐藥細胞)。
*基金項目:國家自然科學基金資助項目(81273937),天津市科委自然科學基金青年項目(13JCQNJC10900),天津市抗癌重大專項攻關計劃(12ZCDZSY15800)。
作者簡介:楊佩穎(1982-),女,碩士,主治醫師,主要從事中西醫結合腫瘤治療工作。
通訊作者:賈英杰,E-mail:jiayingjie1616@sina.com。
1.2試劑、耗材及儀器Mini-PROTEAN 3 Elecreophoresis Cell、Mini Trans-Blot Module、PowerPac Basic Power Supply均來自Bio-Rad,FluorChem FC2 Imaging System、AlphaView系統軟件均來自Alpha Innotech。0.02%EDTA的配制、MTT溶液的配制,PVDF膜,辣根酶標記二抗,ECL。
1.3A549裸鼠皮下移植瘤模型的建立A549細胞培養、傳代:采用人肺腺癌細胞系A549。耐DDP肺腺癌細胞系A549/DDP模型進行培養并傳代,在細胞的對數生長期收集細胞。離心5 min,磷酸鹽緩沖溶液(PBS)洗滌兩次,離心后棄上清液,離心管外周以冰袋來維持溫度在4℃左右,以此來保持瘤細胞的活性。最后用生理鹽水稀釋,把細胞濃度調整到5×106cell/mL。在高劑量組、低劑量組、生理鹽水組中每只小鼠右前腋下皮下接種0.2 mL。
1.4消巖湯含藥血清干預A549/DDP耐藥細胞1)制備消巖湯:方由黃芪、太子參、夏枯草、白花蛇舌草等藥物組成,規格每瓶100 mL。生產單位:本院制劑室。制備方法參照中藥藥物實驗方法學。消巖湯(太子參、生黃芪、姜黃、郁金、白花蛇舌草等共計140 g中藥)水煎液均由天津中醫藥大學中藥提取室嚴格按回流提取法進行提取,其終質量濃度濃縮成每毫升相當于原生藥材1.5 g的藥液。2)中藥灌胃:裸鼠接種A549腫瘤細胞7 d后,前3組小鼠右腋注射局部出現明顯皮丘,移植瘤模型建立。待前3組所有裸小鼠的皮下腫瘤的平均直徑達到約5 mm時開始消巖湯灌胃,高劑量組40 g/kg灌胃,低劑量組20 g/kg灌胃給藥,連續10 d,每日1次。3)含藥血清的制備:灌胃10d后眼眶取血法采血,37℃,無菌室內靜置4 h,離心8 000 r/min,15 min,取淡藍色血清于2 mL EP管中,標識組別。高速離心14 000 r/min,5 min,重復2次。分別提取上清液,分裝,56℃水浴滅活30 min,用0.22 μm微孔濾膜過濾除菌,-20℃保存。4)實驗分組:生理鹽水組,低濃度消巖湯組,高濃度消巖湯組干預肺癌耐藥細胞株A549/DDP,72 h以后,檢測肺癌耐藥細胞株A549/DDP相關mRNA和蛋白的表達。
1.5檢測指標
1.5.1逆轉錄聚合酶鏈反應(PCR)檢測相關mRNA的表達總RNA提取試劑盒、DNA第一鏈合成試劑盒均購自北京通瑞生物有限公司。RNA完整性采用瓊脂糖凝膠電泳檢測,其透過率與純度采用紫外分光光度計檢測。以Oligo-dT15為引物,參照20 μL反應體系合成cDNA第一鏈。引物序列由北京通瑞生物有限公司合成并提供。反應條件為95℃預變性10 s;95℃5 s,64℃34 s,40個循環。每對引物設3個復孔。結果用ABIPRISM7500分析,融解曲線特異。無引物二聚體和非特異性擴增。ABI PRISM 7500自動生成CT值。引物:P-gp forward(5'-AAACACCACGGGA GCA-3'),reverse(5'-AGTGTTAGTTGCCAGCCAT-3');LRP forward(5'-TTCTGGATTTGGTGGACGC-3'),reverse(5'-ACTTCTCTCCCTTGACCAC-3');Beclin1forward(5'-ATCCTCGACCGTGTCACCATCC ACG-3'),reverse(5'-GATGAGCTGAGTGTCCAGCTGGG-3');HMGB1 forward(5'-ATGCGCAAAGGA GATCCTA-3'),reverse(5'-ATTCATCATCATCTTC T-3');β-actin forward(5'-ATTCAACGGCACAGTCA AGG-3'),reverse(5'-GCAGAAGGGGCGGAGATGA-3')。
1.5.2用蛋白免疫印跡法(Western Blot法)檢測相關蛋白表達樣品處理:組織樣品加適量預冷的蛋白裂解液RIPA,勻漿,14 000 r/min離心15 min,上清液轉入新管。BCA法定測定蛋白含量。將蛋白質混合樣品SDS-PAGE電泳:取100 μg處理好的樣品,按《分子克隆》方法進行SDS-PAGE電泳,積層膠6%,分離膠8%,膠厚0.75 mm。濕法轉膜:膠于轉移液(含甲醇15%)中平衡10 min;從下至上分別放置濾紙、膠、PVDF膜(0.45 μm)、濾紙,夾子夾好放入倒好轉移液的轉移槽中,250 mA轉膜90 min。轉印后,將NC膜或PVDF膜與抗血清一起孵育,使第一抗體與待檢蛋白結合,再用酶標第二抗體孵育膜,使第二抗體與第一抗體結合反應,最后用酶的顯色底物或發光底物顯示靶蛋白條帶。
1.6統計學分析采用SPSS 22統計軟件處理,實驗數據用均數±標準差(±s)表示,組間比較采用單因素方差分析(One-Way ANOVA),組間兩兩比較時,若方差齊采用LSD法,若方差不齊采用Dunnett's T3法,P<0.05為差異有統計學意義。
2 結果
2.1 PCR檢測A549/DDP細胞P-gp、LRP、Beclin1、HMGB1的表達A549/DDP細胞在鹽水,低劑量消巖湯,高劑量消巖湯72 h后收集細胞提取總RNA,PCR檢測與P-gp、LRP、Beclin1、HMGB1 mRNA表達量的變化,實驗重復3次。結果表明:與生理鹽水組,隨著消巖湯含藥血清藥物濃度的增加,P-gp、LRP、Beclin1、HMGB1 mRNA表達逐漸減弱,并且差異有統計學意義(P<0.05)。見表1。
表1PCR檢測A549/DDP細胞P-gp、LRP、Beclin1、HMGB1的表達(±s)Tab.1 PCR detection of A549/DDP cell P-gp,LRP,Beclin1,HMGB1 expression(±s)
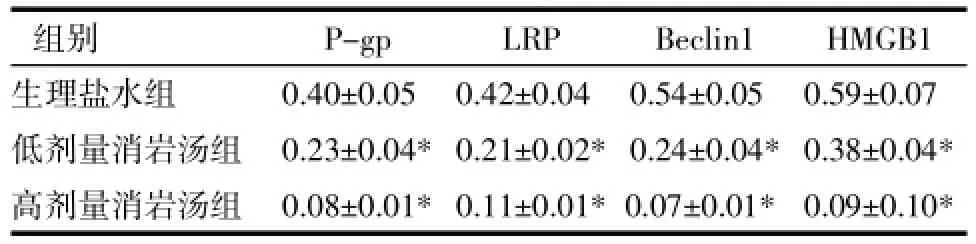
表1PCR檢測A549/DDP細胞P-gp、LRP、Beclin1、HMGB1的表達(±s)Tab.1 PCR detection of A549/DDP cell P-gp,LRP,Beclin1,HMGB1 expression(±s)
注:與生理鹽水組比較,*P<0.05。
組別 P-gp LRP Beclin1 HMGB1生理鹽水組 0.40±0.05*0.42±0.04*0.54±0.05*0.59±0.07*低劑量消巖湯組 0.23±0.04*0.21±0.02*0.24±0.04*0.38±0.04*高劑量消巖湯組 0.08±0.01*0.11±0.01*0.07±0.01* 0.09±0.10*
2.2Western Blot法檢測 A549/DDP細胞 P-gp、LRP、Beclin1、HMGB1蛋白的表達A549/DDP細胞在鹽水,低劑量消巖湯,高劑量消巖湯72 h后收集細胞提取總蛋白,Western blot檢測與自噬、耐藥相關的P-gp、LRP、Beclin1、HMGB1蛋白表達量的變化。結果表明:與生理鹽水組比較,隨著消巖湯藥物濃度的增加,P-gp、LRP、Beclin1、HMGB1蛋白表達逐漸減弱,并且差異有統計學意義(P<0.05)。見圖1。
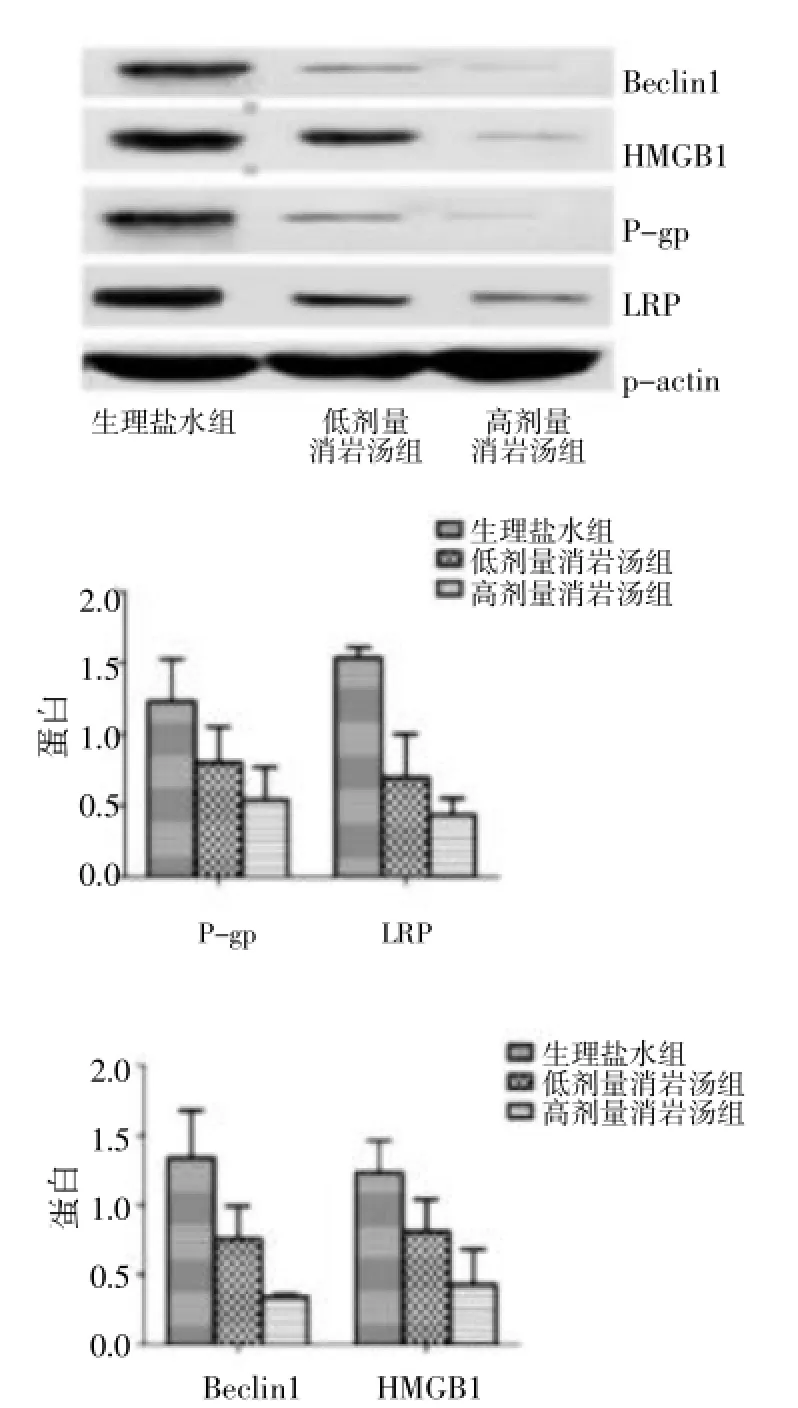
圖1 Western Blot法檢測A549/DDP細胞P-gp、LRP、Beclin1、HMGB1蛋白的表達Fig.1 Western Blot method to detect the A549/DDP cell P-gp,LRP,Beclin1,HMGB1 protein expression
2.3Western Blot法檢測 A549/DDP細胞檢測AKT1-mTOR分子通路蛋白A549/DDP細胞在生理鹽水,低劑量消巖湯,高劑量消巖湯72 h后收集細胞提取收集細胞提取總蛋白,Western blot檢測與細胞自噬相關的AKT1,mTOR的表達變化,實驗重復3次。結果表明:與生理鹽水組比較,隨著消巖湯藥物劑量的增加,AKT1,mTOR蛋白表達逐漸減弱,并且差異有統計學差異(P<0.05)。見圖2。
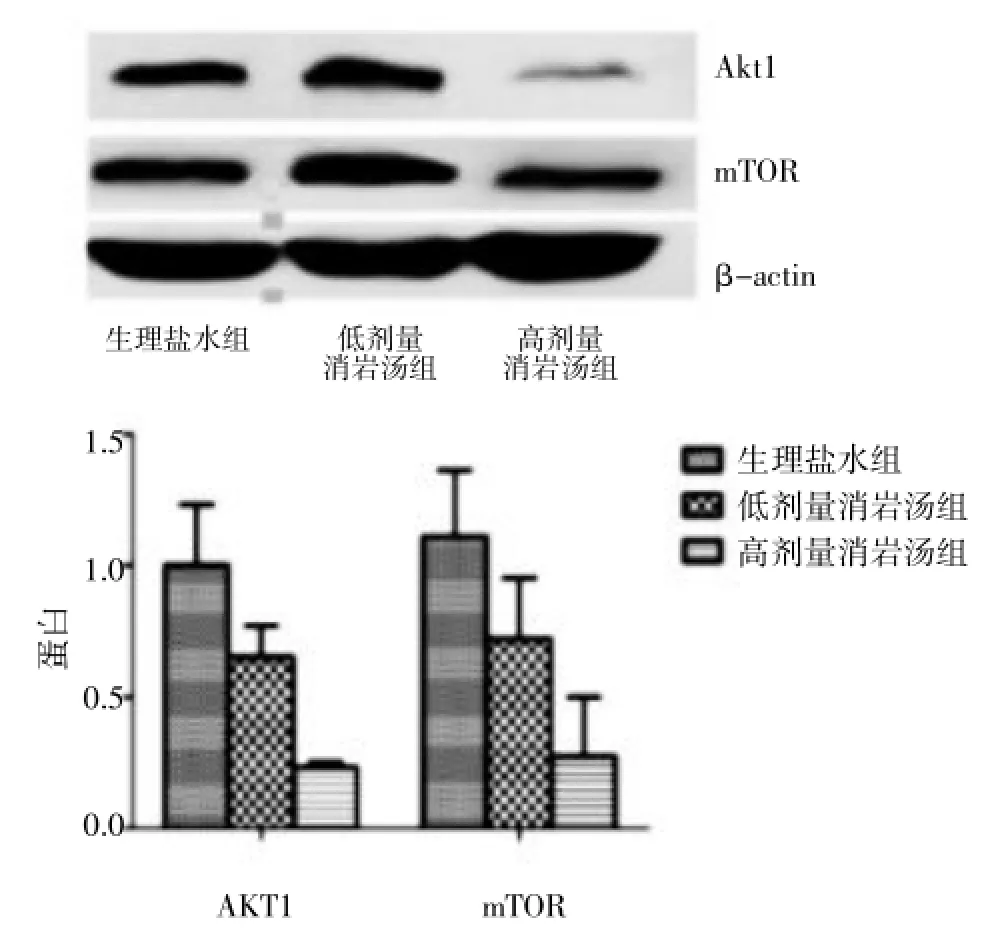
圖2Western Blot法檢測A549/DDP細胞AKT1-mTOR分子通路蛋白Fig.2 Western Blot method to detect the A549/DDP cells AKT1-mTOR molecular pathways protein
3 結論
不同濃度的消巖湯作用于肺腺癌耐藥細胞A549/DDP,隨著中藥濃度的增加,細胞耐藥相關蛋白P-gp、LRP蛋白表達逐漸減弱(P<0.05),消巖湯能下調自噬相關蛋白Beclin1、HMGB1表達,從而抑制自噬發生。進一步發現消巖湯可影響AKT1-mTOR通路相關基因變化,筆者推測消巖湯可能通過影響AKT1-mTOR分子通路進而影響耐藥相關蛋白P-gp、LRP及自噬相關蛋白Beclin1,HMGB1基因的變化。
4 討論
在腫瘤化療過程中,大多數患者都會產生不同程度的腫瘤耐藥性,影響治療效果,降低患者的生存率及臨床獲益。因此,越來越多的國內外關注腫瘤耐藥性的發生機制及其治療策略。目前逆轉腫瘤耐藥性的研究已經取得了一定的成果,但由于大多數逆轉劑的毒副反應限制在臨床中的嚴格使用。中醫藥立足于辨證論治,以低毒、多靶點等優勢在逆轉腫瘤多藥耐藥性方面取得了可喜的成績,能明顯提高腫瘤對化療藥物敏感性。有研究通過觀察補腎化瘀解毒復方荷瘤動物含藥血清對肺腺癌敏感細胞和耐藥細胞細胞毒作用,以及對細胞周期的影響和對順鉑的耐藥逆轉作用,結果發現補腎化瘀解毒復方使肺癌耐藥細胞MRP和GST的表達下調,增強TOPOⅡ含量及其活性,并進一步研究發現,此復方有阻止肺癌耐藥細胞內鈣離子(Ca2+)的內流或釋放作用[8],證明中藥復方聯合化療可以起到增效減毒的作用,為逆轉肺癌化療耐藥性提供客觀的實驗依據[9]。
腫瘤的多藥耐藥機制十分復雜,主要與P-gp所介導的經典機制以及LRP等介導的非經典機制密切相關。Levatic J等[10]研究發現Akt介導的耐藥性可能與作用于MDR1進而促進P-gp的表達相關,在腫瘤細胞內,P-gp通過利用ATP提供的能量降低細胞內藥物的濃度從而使細胞產生耐藥性。LRP系構成人體穹隆蛋白的主要成分,廣泛分布于人體的體腔上皮、巨噬細胞、血腦屏障和分泌性器官中[11],通過降低核內藥物濃度,消除藥物對脫氧核糖核酸(DNA)靶點的影響,介導對鉑類、烷化劑等的耐藥。有研究表明LRP在肺腺癌中的表達明顯高于癌周組織[12]。這兩種耐藥基因產物在肺癌耐藥研究中較多,其過度表達可產生耐藥現象。本研究消巖湯干預耐藥細胞株A549/DDP后,發現LRP和P-gp mRNA和蛋白水平均發生變化,并且發現隨著濃度增加,LRP和P-gp表達越低,并且差異有統計學意義。表明消巖湯可以逆轉肺癌對順鉑的耐藥,分析原因認為通過抑制細胞膜上P-gp蛋白組織對化療藥物的外排和抑制LRP及其基因的表達與轉錄,增強了以細胞核為靶點的化療藥物進入核內,從而達到有效的藥物濃度而成功逆轉肺癌的耐藥。
Beclin1是自噬啟動過程的標志[13],具有獨特結構序列的多功能蛋白,對凋亡和自噬都有一定的調節作用,因此抑制耐藥細胞Beclin 1的表達可能影響凋亡與細胞自噬的發生[14]。腫瘤細胞為了緩解化療應激狀態而存活下來,必須通過自噬及時將積聚在內質網腔內的錯誤折疊蛋白清除,這是腫瘤產生化療耐藥性的一種重要機制[15]。劉郁鵬等[16]研究發現新輔助多西他賽和順鉑方案術前化療,可影響肺腺癌組織中Beclin1的表達水平,RT-PCR法檢測結果顯示經新輔助化療后Beclin1 mRNA水平明顯高于對照組,而Bcl-2水平明顯低于對照組,Beclin1與Bcl-2呈負相關。諸多學者發現細胞自噬與肺癌化療產生耐受相關,通過上調自噬相關基因如Beclin1,下調凋亡分子,如Caspase-3水平,使細胞耐受化療,從而逃避凋亡而存活[17]。本研究消巖湯處理A549/DDP,發現自噬相關蛋白Beclin1,高遷移率族蛋白B-1 (HMGB1)呈藥物依賴性表達下調,Beclin1通過與classⅢPI3K通路形成復合物參與自噬體的形成,Beclin1表達下降,影響自噬小體形成,無法啟動自噬。Beclin1高表達增強自噬的活性,減少順鉑損傷腫瘤細胞的作用,從而發揮腫瘤保護作用,因此,抑制Belin1的表達可逆轉細胞耐藥,促進細胞凋亡。
消巖湯具有扶正、解毒、祛瘀之功效,黃芪、太子參滋陰益氣、扶正以祛邪共為君藥。夏枯草、生牡蠣、白花蛇舌草相伍清熱解毒、軟堅散結,為臣藥。郁金、姜黃行氣解郁、活血祛瘀,為佐藥;蜂房搜剔絡脈中之瘀毒,為使藥。消巖湯君藥黃芪的有效成分黃芪多糖能夠逆轉H22/ADM細胞株的耐藥,其機制是降低了P-gp的外排功能,下調了MDRlmRNA 和P-gp的表達。AKT1-mTOR分子通路是影響細胞增殖,耐藥和自噬的相關分子通路,許多研究證明AKT1-mTOR分子通路的激活與癌癥的發生發展密切相關[18]。并且有研究證實姜黃素抑制腫瘤與AKT1-mTOR分子通路密切相關,通過抑制AKT1-mTOR分子通路的表達,進而降低下游基因的表達,可顯著增強化療藥物的殺傷作用[19]。筆者前期發現消巖湯逆轉肺癌耐藥的可能機制為通過抑制P-gP及其基因的表達而阻止細胞對順鉑的輸出,從而達到有效逆轉肺癌耐藥的療效[20],本研究為進一步探究中藥復方消巖湯對耐順鉑人肺腺癌A549/DDP的耐藥逆轉作用及探討相關分子通路。筆者研究發現,在耐藥細胞株中消巖湯可以抑制AKT1和mTOR基因的表達,進而抑制AKT1-mTOR分子通路的表達,導致腫瘤細胞的死亡,而消巖湯是否直接通過抑制AKT1-mTOR分子通路導致耐藥基因和自噬基因的變化,仍需進一步實驗證明。
[1]孔易,胡占峰,徐樹雷,等.多藥耐藥相關蛋白和肺耐藥蛋白在大腸癌中的表達及其意義[J].廣東醫學,2014,35(2):255-257.
[2]郭毅,李慧穎,王磊.天然生物堿單體在結腸癌領域中的研究進展[J].中國老年學雜志,2015,35(3):832-835.
[3]Hanawhan D,Weinberg RA.Hallmarks of cancer:the next generation [J].Cell,2011,144(5):646-674.
[4]Rohwen N,Cramer T.Hypoxia-mediated drug resistance:novelinsights on the functional interaction of HIFs and cell death pathways[J].Drug Resistance Updates,2011,14(3):191-201.
[5]Wang Z,Wang N,Liu P,et al.Micro RNA-25 regulates chemoresistance-associated autophagy in breast cancer cells,a processmodulatedbythenaturalautophagyinducer isoliquiritigenin[J].Oncotarget,2014,5(16):7013-7026
[6]張潔,彭芝蘭.抑制自噬基因Beclin 1的表達對耐藥卵巢癌細胞A2780/DDP順鉑敏感性的影響及相關機制研究[J].現代預防醫學,2011,38(11):2128-2131,2134.
[7]Ren JH,He WS,Nong L,et al.Acquired cisplatin resistance in human lung adenocarcinoma cells is associated with enhanced autophagy[J].Cancer Biother Radiopharm,2010,25(1):75-80.
[8]曹勇,張丹,鄭廣娟,等.補腎化瘀解毒方藥物血清對肺癌耐藥細胞內Ca2+濃度影響的研究[J].四川中醫,2003,21(11):24-26.
[9]鐘安樸.補腎化瘀解毒復方對肺癌耐藥逆轉作用及機理研究[D].廣州:暨南大學,2006:11-19.
[10]Levatic J,Curak J,Kralj M,et al.Accurate Models for P-gp Drug Recognition Induced from a Cancer Cell Line Cytotoxicity Screen[J]. J Med Chem,2013,56(14):5691-5708.
[11]Lv J,Tian Y.Effect of Src tyrosine kinase inhibition on the drugresistance as well as MDRl and LRP expression of the human cisplatinum-resistant lung cancer cell line A549/DDP[J].Chin J Lung Cancer,2012,15(9):501-506.
[12]王曉紅,白淑平,趙玲,等.LRP、P-gp、GST-π蛋自在肺腺癌中的表達及其臨床意義[J].中國老年學雜志,2013,33(2):260-262.
[13]朱良綱,杭均彪,杜海磊,等.自噬在吉西他濱誘導肺癌細胞A549凋亡中的作用及其相關機制[J].中國腫瘤臨床,2012,39(10):652-655.
[14]張潔,彭芝蘭.抑制自噬基因Beclin 1的表達對耐藥卵巢癌細胞A2780/DDP順鉑敏感性的影響及相關機制研究[J].現代預防醫學,2011,38(11):2128-2131,2134.
[15]Mizushima N,Levine B,Cuervo AM,et al.Autophagy fights disease through cellular self-digestion[J].Nature,2008,451(7182):1069-1075.
[16]劉郁鵬,朱燁菁,陳 櫞,等.新輔助化療對相關肺癌基因Bcl-2 和Beclin-1表達影響[J].交通醫學,2014,28(5):449-452,455
[17]金柱,高寶安.雷帕霉素對順鉑作用下人肺腺癌A549及耐藥A549/DDP細胞增殖、侵襲、黏附及自噬凋亡的影響[J].中國病理生理雜志,2014,30(12):2120-2127.
[18]Zhao G,Han X,Zheng S,et al.Curcumin?induces autophagy,inhibitsproliferationandinvasionbydownregulatingAKT/ mTORsignaling pathway in human melanoma cells[J].Oncol Rep,2016,35(2):1065-1074.
[19]Han W,Pan H,Chen Y,et al.EGFR tyrosine kinase inhibitors activate autophagy as a cytoprotecteve response in human lung cancer cells[J].Cancer Cells,2010,6(6):e18691.
[20]張瑩,賈英杰,李小江,等.消巖湯對耐順鉑人肺腺癌A549/ DDP細胞多藥耐藥基因調控作用的研究[J].藥物評價研究,2014,37(6):507-510.
(本文編輯:馬英,高杉)
Study on the autophagy and resistance protein affected by Xiaoyan decoction in A549/DDP cells
YANG Pei-ying,XU Wen-ting,LIU Hong-gen,ZHANG Xin,ZHANG Ying,YU Xiao-yu,JIA Ying-jie
(The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]Through the cisplatin resistance of the human lung adenocarcinoma cells A549/DDP multi-resistant and influence of autophagy protein by Xiaoyan decoction,finding out the influence of elimination of cisplatin resistance of lung adenocarcinoma A549/DDP resistance reversal agents and explore relevant molecular pathways.[Methods]Establish a stable cell resistance model,continuous lavaging Xiaoyan decoction with different concentrations in 10 days,by serum pharmacology experiment method with drug-containing serum on lung adenocarcinoma cells resistant cells A549/DDP,through the QRT-PCR and Werstern Blot western Blot method to detect A549/DDP resistant,autophagy protein expression of related genes and related pathways.[Results]Resistance effect on lung adenocarcinoma cells A549/DDP with high dose Xiaoyan decoction,low dose Xiaoyan Decoction and normal saline,elimination saline resistance effect on lung adenocarcinoma cells A549/DDP,detecting drug-resistant related proteins in A549/DDP cell P-gp,LRP and Beclin1 protein involved in autophagy,HMGB1mRNA and protein expression changes,through the detection of A549/DDP cells drug-resistant related proteins P-gp,LRP and Beclin1 protein involved in autophagy,HMGB1mRNA and protein expression changes,high dose group of rock soup elimination processing cell lines after P-gp,LRP and Beclin1 protein involved in autophagy,both the HMGB1 mRNA and protein were lower(P<0.05).Further found that Xiaoyan decoction can affect the AKT1-elimination mTOR related genes and significantly reduce the AKT1,mTOR protein expression.[Conclusion]We hypothesized that Xiaoyan decoction influence elimination drug-resistant related proteins P-gp,LRP and Beclin1 protein involved in autophagy,HMGB1 genetic changes by AKT1-mTOR molecular pathways.
Xiaoyan decoction;autophagy;resistance;molecular pathway
R285.5
A
1672-1519(2016)06-0358-05
10.11656/j.issn.1672-1519.2016.06.11
2016-01-16)

