阻斷白介素-3減輕膿毒血癥小鼠的炎癥反應
許白葉,張靜,王清海,梁世山,陳真,王海島
(1.福建醫科大學附屬泉州第一醫院 兒科,福建 泉州 362000;2.福建泉州醫學高等專科學校,福建 泉州 362000)
?
論著
阻斷白介素-3減輕膿毒血癥小鼠的炎癥反應
許白葉1,張靜2,王清海1,梁世山1,陳真1,王海島1
(1.福建醫科大學附屬泉州第一醫院 兒科,福建 泉州 362000;2.福建泉州醫學高等專科學校,福建 泉州 362000)
摘要:目的探究阻斷白介素-3(IL-3)對膿毒性小鼠炎癥反應的作用及其潛在機制。方法小鼠盲腸結扎穿孔手術(CLP)后,分為野生型小鼠組和IL-3缺陷型小鼠組,每組13只,連續7 d觀察和記錄小鼠的死亡數。另取野生型小鼠和IL-3缺陷型小鼠,每組20只,分為3組進行實驗:①組小鼠分別在CLP后0、12和24h進行臨床癥狀評分和體溫測量;另在24h測血壓,采血,用于測定干擾素-α(IFN-α)、白介素-1β(IL-1β)和白介素-6(IL-6)水平;②組小鼠分別在CLP后0、6、12和24 h采血并在24 h取材(肝、肺),用于測定中性粒細胞、單核細胞總數及病理、免疫組織化學分析;③組小鼠分別在CLP后0和24h采血并收集支氣管肺泡灌洗液用于蛋白總量和生化指標[天冬氨酸轉氨酶(AST)、丙氨酸轉氨酶(ALT)]的測定。結果與野生型小鼠組比較,CLP后IL-3缺陷型小鼠的存活率和體溫升高(P<0.05),血壓良好,臨床癥狀評分下降(P<0.05)。此外,與野生型小鼠組比較,CLP后IL-3缺陷型小鼠炎癥細胞因子IFN-α、IL-1β和IL-6水平降低(P<0.05);肺和肝組織中的中性粒細胞和單核細胞總數降低(P<0.05);支氣管肺泡灌洗液中的總蛋白和血生化指標(AST、ALT)也降低(P<0.05)。結論 阻斷IL-3能夠減輕膿毒性小鼠的炎癥反應,提高膿毒性小鼠的存活率。
關鍵詞:膿毒血癥;盲腸結扎穿孔手術;中性粒細胞;單核細胞;支氣管肺泡灌洗液;干擾素-α
膿毒血癥是指由病原微生物感染引起的并對宿主產生危害及不可控的全身炎癥反應綜合征(sys temic inflammatory response syndrome,SIRS),導致多個器官衰竭,具有發病率高、病情發展迅速、臨床死亡率高(30%~70%)的特點,全球每年有超過1 800萬例的嚴重膿毒血癥患者。
盲腸結扎穿孔手術(cecal ligation and puncture,CLP)最廣泛用于嚙齒類動物實驗性膿毒血癥模型,目前被認為是膿毒血癥研究的黃金標準[1-4]。由于盲腸是病原菌感染的內在來源,CLP后,穿孔的盲腸將導致病原菌性腹膜炎,并且引發混合的腸原桿菌轉移至血液循環系統。膿毒血癥發病初期,菌血癥會激活全身性炎癥反應,隨后出現膿毒性休克,多器官功能損傷,最后導致死亡。膿毒血癥在臨床上仍然具有很大挑戰,其潛在的病理生理特性還不清楚。
白介素-3(Interleukin-3,IL-3),又稱多集落刺激因子,是白細胞介素家族重要成員之一,主要由活化的T細胞、巨噬細胞和骨髓基質干細胞產生,IL-3不僅介導白細胞的產生,增殖和生長,還能促進骨髓基質細胞的定向分化與增殖,并在炎癥反應中起著重要作用。白細胞和中性粒細胞等骨髓基質細胞能夠產生腫瘤壞死因子-α(Interferon-α,IFN-α)、白介素-1β(Interleukin-1β,IL-1β)和白介素-6 (Interleukin-6,IL-6),這些細胞因子是膿毒性休克的標志性炎癥因子[5-7]。研究表明,大多數膿毒性休克與炎癥細胞因子增多密切相關,包括IFN-α、IL-1和IL-6[8-9]。盡管炎癥細胞因子與膿毒血癥有關,但IL-3在膿毒血癥中的作用仍不清楚。
本研究旨在通過盲腸結扎穿孔手術建立小鼠膿毒血癥模型,闡述IL-3在膿毒血癥中的作用及其潛在機制,尤其是IL-3對膿毒性小鼠炎癥反應的影響,為臨床治療膿毒血癥提供理論依據。
1 材料與方法
1.1動物
品系為Balb/c的IL-3基因敲除小鼠,4周齡,購買于北京維通利華實驗動物技術有限公司(合格證號2014621553276679)。IL-3基因敲除:通過IL-3基因組文庫構建一個替換型載體替換IL-3的第4個外顯子(80bp)。采用電穿孔法將此打靶載體轉入Balb/c小鼠胚胎干細胞(embryonic stem cell,ES細胞),經過篩選得到陽性克隆的ES細胞,并植入假孕的Balb/c小鼠子宮內,發育得到雜合子的IL-3基因敲除小鼠。小鼠的性成熟期約為35d,妊娠期約20d。雄雌鼠各1只合籠飼養,繁育出的子代為野生型IL-3+/+、雜合子型IL-3+/-和突變純合子型IL-3-/-3種表型。剪取小鼠尾巴末端約0.6 cm,根據QIAGEN說明書提取DNA,聚合酶鏈反應(polymerase chain reaction,PCR)鑒定子代小鼠的基因型。野生型IL-3+/+小鼠作為對照組,突變純合子型IL-3-/-小鼠作為實驗組,雄性,8~12周齡,體重27~29g。小鼠飼養在無菌的籠盒內,每籠5只,動物房溫度控制在20~25℃,12h晝/夜循環照明,動物可自由攝取高壓滅菌的水和食物,適應性飼養1周。所有動物實驗符合國家實驗動物保護和使用健康指南,所有的動物實驗操作都遵守動物福利。
1.2試劑與儀器
紅細胞裂解液(美國,BioLegend),磷酸鹽緩沖溶液(phosphatebuffersaline,PBS),anti-CD115(AF598,美國eBioscience公司),anti-Ly-6G(1A8,美國Bio Legend公司),生物素標記的二抗(美國Vector Laboratories lnc公司),二氨基聯苯胺(Diaminobenzidine,DAB)(美國Dako公司),丙氨酸轉氨酶(alanine transaminase,ALT) 或天冬氨酸轉氨酶(aspartate transaminase AST)活性測定試劑盒(美國Sigma公司),Bio-Rad蛋白測定試劑盒(美國Bio-Rad公司),酶聯免疫吸附法(enzyme-linked immunosorbent assay,ELISA)試劑盒(美國BD Bioscience公司),酶標儀(Model450,美國Bio-Rad Laboratories公司),BX-51光學顯微鏡(日本,Olympus公司),溫度感應器(TH212型號,北京鴻鷗成運科技有限公司),血壓測定儀(無創尾動脈血壓測定儀,RBP-1型號,澳大利亞,ADInstruments),冷凍切片機(CM1950,德國LEICA公司)。Image-Pro Plus 5.0形態學分析軟件(美國,Media Cybernetics公司)。
1.3方法
1.3.1PCR檢測PCR反應引物由上海生物工程有限公司合成。引物1:CTCCAGATCGTTAAGGTGG A位于替換的基因片段,用于檢測突變型;引物2:GACCCTCTCTGAGGAATAAG位于IL-2基因敲除區域,用于檢測野生型;引物3:GTAGGTGGAAATTCTA GCAT作為通用引物。反應條件:94℃預變性3min,94℃變性30s,64℃退火45s,72℃延伸45 s,共35個循環,72℃繼續延伸2 min。取PCR產物5μl于1.2%瓊脂糖凝膠上進行電泳分析,由引物1和3檢測出的條帶位于500bp處,為純合子小鼠;由引物2 和3檢測出的條帶位于324bp處,為野生型小鼠。2條帶均存在的為雜合子小鼠。
1.3.2小鼠CLP模型的建立所有實驗動物術前8h禁食,可自由飲水。手術前,動物常規腹部消毒,異氟烷持續麻醉,取腹部皮膚正中切開約2 cm,打開腹腔輕輕提出盲腸,小心分離其遠端與大腸系膜,避免損傷腸系膜血管。如盲腸內有糞便,可輕輕將其擠向與之相連的結腸。在盲腸遠端1/2處用無菌可吸收的7號手術縫合絲線緊緊結扎,避免形成腸梗塞,用20號無菌注射針頭在已結扎盲腸遠端中央處貫通穿刺2次,形成4個穿刺孔,輕輕擠出少量腸內物以防止穿刺孔閉合,將盲腸推向腹腔,閉腹,逐層縫合。假手術:僅分離盲腸末端,不進行結扎穿刺,其他所有手術操作一樣。所有動物均在術后背部皮下注射1 ml生理鹽水,行液體復蘇治療。整個實驗過程在室溫環境下進行,術后小鼠自由飲食飲水。
1.3.3實驗分組①動物生存實驗。隨機選取野生型和IL-3缺陷型(IL-3-/-)的Balb/c小鼠各13只,分為野生型組(WT組)和IL-3缺陷型組(IL-3-/-組)。兩組實驗動物行CLP手術造模,CLP手術方法參考文獻[10]。首次造模后連續觀察7 d,記錄小鼠死亡數。②病理組織學與蛋白分析。另選取野生型和IL-3缺陷型的Balb/c小鼠各20只,分為兩組:野生型CLP組(WT組)和IL-3缺陷型CLP組(IL-3-/-組)。以前述方法造模,造模后按照以下時間點進行病理組織學與蛋白分析。實驗操作:a.0、12和24h的臨床癥狀評分和體溫測量;0和24 h測血壓;24 h后采血,用于后續炎癥細胞因子的測定(每組7~8只)。b.0、6、12和24 h眼眶采血;24 h后取材(肝、肺),用于后續炎癥細胞總數測定、病理及免疫組織化學分析(每組6只)。C.0和24h麻醉下眼眶采血和支氣管肺泡灌洗后,收集灌洗液和血清做后續的蛋白總量和生化指標的測定(每組6只)(0h作為CLP手術前的時間)。
1.3.4血生化指標測定①炎癥細胞計數。將眼眶取血以1∶10稀釋比放入紅細胞裂解液中除去紅細胞,與臺盼藍1∶1混合,血細胞計數板進行細胞計數。②血清生化指標測定。取5μl血清加入到96孔平底板中,ALT或AST測試緩沖液調整體積為50μl,加入100μl反應混合液,37℃孵育,酶標儀450 nm波長處測定吸光度,根據吸光度計算酶的活力。方法參考AST或ALT活性測定試劑盒說明書。
1.3.5動物形態學檢測①體溫測量。將溫度感應器插入麻醉狀態的小鼠直腸內1.5~2.0 cm,溫度感應器頭部涂抹凡士林以減少對動物的傷害,待溫度穩定后記錄每只小鼠的體溫數據,平行測3次。②血壓測定。采用尾袖法(tail-cuff plethysmograph,TCP)測定小鼠的血壓。小鼠放在37℃熱板上,以保持小鼠尾部溫度適宜,連接血壓測定儀,每只動物連續測5次,取其平均值作為每只動物的收縮壓值。③臨床癥狀評分。根據如下標準對每個小鼠進行臨床癥狀評分:a.外表:正常,0分;缺乏理毛行為,1分;被毛雜亂,2分;彎腰弓背,3分;眼睛半閉合,4分。b.行為(無攻擊性):正常,0分;沉郁,1分;少動孤立,2分;焦躁不安或非常平靜,3分。c.行為(攻擊性):警覺,0分;無警覺感,3分。d.呼吸癥狀:呼吸正常,0分;呼吸微弱,1分;呼吸率降低并行腹式呼吸,2分;明顯的腹式呼吸并發紺,3分。e.脫水狀態:正常,0分;脫水,5分。臨床癥狀總分越高表明動物身體狀況越差。
1.3.6生理功能指標檢測①蘇木精-伊紅染色法(hematoxylin-eosin staining,HE)與免疫組織化學法。野生型(WT)和IL-3缺陷型(IL-3-/-)的Balb/c小鼠分別在CLP后24h取出肺和肝組織,切一小塊放入盛有最佳切削溫度(opti-mum cutting temperature, OCT)包埋劑的包埋盒中,包埋盒緩慢地放入預冷的異戊烷液面上,直至OCT包埋劑凝固,取出放入-80℃冰箱冷凍保存。取出冷凍的組織塊,切片機切6μm厚的薄片,放入預冷丙酮中固定10 min。將固定好的切片放入PBS中洗滌,HE染色,乙醇脫水,二甲苯透明,封片,鏡檢。另取組織切片,用磷酸鹽緩沖溶液Twen-20(phosphate buffer solution twen-20,PBST)洗滌后,經5%BSA室溫孵育封閉1 h,加入anti-CD115和anti-Ly-6G 4℃過夜,加入生物素標記的二抗,二氨基聯苯胺顯色,蘇木精復染、封片、鏡檢、拍照。BX-51光學顯微鏡和Image-Pro Plus 5.0形態學分析軟件觀察并數據分析。②ELISA測定炎癥細胞因子。CLP后24h收集血液分離出血清,適當稀釋后ELISA試劑盒分析IFN-α、IL-1β和IL-6含量。③支氣管肺泡灌洗液總蛋白測定。小鼠在1%戊巴比妥鈉(50 mg/kg)麻醉下,眼科剪切開頸部皮膚,鈍性分離,暴露氣管,氣管上剪一小口,14 G針頭插入,橡皮筋扎緊,注射器吸取1 ml PBS緩沖液接上針頭,來回抽吸,直至肺部變白。Bio-Rad蛋白測定試劑盒測定支氣管肺泡灌洗液總蛋白。
1.4統計學方法
采用SPSS 17.0統計軟件進行數據分析,計量資料以均數±標準差(±s)表示,生存資料數據行Kaplan-Meier計算和Log-rank test分析。兩兩多重比較用Turkey檢驗,兩組比較用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1子代小鼠基因型鑒定
其中IL-3-/-有1條帶,大小為500 bp,IL-3+/-有2條帶,分別為500和324 bp,野生型有1條帶為324bp。見圖1。
2.2阻斷IL-3對CLP誘導小鼠死亡率的影響
野生型和IL-3缺陷型小鼠CLP手術后,連續觀察7d,記錄小鼠死亡數,結果顯示,野生型組小鼠手術后第1天死亡1只,第2天死亡3只,第3天死亡1只,第5天死亡1只,第6天死亡1只,存活率46%(6/13)。IL-3缺陷型小鼠手術后第3天死亡2只,第6天死亡1只,存活率76%(10/13)。經Logrank test分析,IL-3缺陷型小鼠存活率高于野生型小鼠,膿毒性小鼠的生存率明顯提高(χ2=4.182,P= 0.040)。見圖2。
2.3阻斷IL-3對CLP小鼠行為、體溫和血壓的影響
小鼠CLP手術后0、12和24 h的臨床評分、體溫,并0和24h血壓結果中,IL-3缺陷型小鼠CLP手術后12和24 h的臨床評分分別為(5.41±3.95)和(6.63±3.56)分,與野生型小鼠的臨床評分[(18.44± 4.70)和(21.02±5.28)分]比較,分別降低70.88%和68.47%(t=6.005和6.392,P=0.000);體溫分別為(35.77±3.60)和(36.18±1.79)℃,與野生型小鼠的體溫[(28.90±4.32)和(27.57±2.18)℃]比較,升高23.78%和 31.25%(t=3.455和 8.634,P=0.004和 0.000)。野生型小鼠和IL-3缺陷型小鼠CLP手術后0h的血壓分別為(95.58±2.84)和(95.81±5.12)mmHg;CLP手術后24h,IL-3缺陷型小鼠的血壓為(91.56± 6.06)mmHg,野生型小鼠血壓低于測量范圍。見圖3。
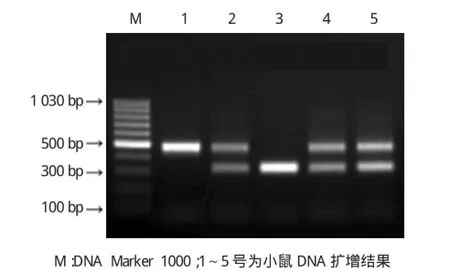
圖1 子代IL-3小鼠PCR鑒定結果
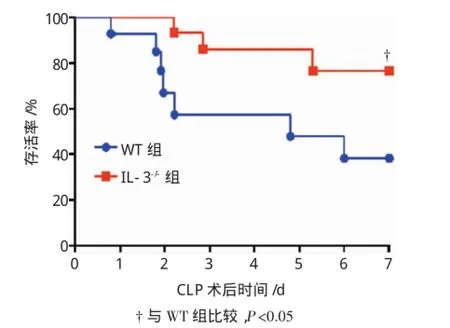
圖2 CLP術后兩組小鼠生存曲線
2.4阻斷IL-3對CLP小鼠肺和肝組織炎癥反應的影響
CLP手術后24 h,IL-3缺陷型小鼠支氣管肺泡灌洗液的總蛋白含量為(0.34±0.28)mg/ml,與野生型小鼠[(0.81±0.18)mg/ml]比較,下降57.82%(t= 3.990,P=0.001);而CLP手術后0 h,IL-3缺陷型小鼠和野生型小鼠支氣管肺泡灌洗液的總蛋白含量分別為(0.32±0.06)和(0.28±0.13)mg/ml,差異無統計學意義(t=0.720,P=0.483)。IL-3缺陷型小鼠CLP手術后24 h,血清中的AST和ALT分別為(1.66± 0.33)IU/ml和(18.86±5.77)IU/ml,比野生型小鼠AST[(2.28±0.62)UI/ml]和ALT[(32.02±15.82)IU/ml]降低27.15%和41.11%(t=2.490和2.211,P=0.026和0.044);而CLP手術后0 h,IL-3缺陷型小鼠的AST[(0.61±0.39)IU/ml]和ALT[(9.34±4.80)IU/ml]與野生型的AST[(0.34±0.10)IU/ml]和ALT[(12.93± 4.58)IU/ml]比較,差異無統計學意義(t=1.931和1.529,P=0.074和0.149)。見表1。
表1 阻斷IL-3對CLP小鼠肺和肝組織炎癥反應的影響 (n=6±s)
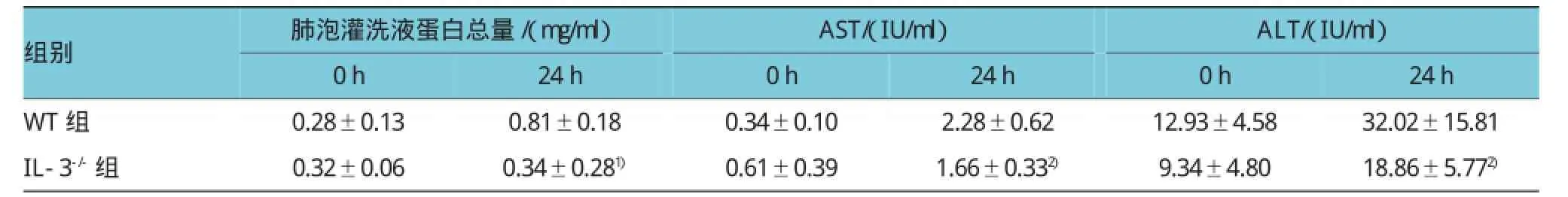
表1 阻斷IL-3對CLP小鼠肺和肝組織炎癥反應的影響 (n=6±s)
注:1)與WT組比較,P<0.01;2)與WT組比較,P<0.05
組別肺泡灌洗液蛋白總量/(mg/ml)AST/(IU/ml)ALT/(IU/ml)24h WT組 0.28±0.13 0.81±0.18 0.34±0.10 2.28±0.62 12.93±4.58 32.02±15.81 IL-3-/-組 0.32±0.06 0.34±0.281) 0.61±0.39 1.66±0.332) 9.34±4.80 18.86±5.772)0h 24h 0h 24h 0h
HE染色表明,CLP手術后1d,野生型小鼠的肺組織出現明顯的間質性肺炎病理學特征,肺泡壁增寬,毛細血管充血擴張,嚴重的可見炎癥細胞浸潤和肺泡上皮細胞脫落,肺組織損傷嚴重;IL-3缺陷型小鼠肺組織結構清晰,炎癥細胞浸潤較少,肺組織損傷較輕。野生型小鼠的肝組織顏色變淺,發生水腫,肝細胞壞死,細胞核裂解,溶解,細胞體積膨脹,細胞膜不完整,肝組織損傷嚴重;IL-3缺陷型小鼠的肝組織結構清晰,肝細胞較完整。見圖4。
2.5阻斷IL-3對CLP小鼠炎癥細胞的影響
為檢測IL-3對組織和血液中炎癥細胞的影響,小鼠CLP手術后0、6、12和24 h采血并在24 h安樂死取肺和肝組織,測定血液中的炎癥細胞,并行肺以及肝組織的免疫組織化學染色,結果表明,CLP手術后24 h,IL-3缺陷型小鼠血液中的中性粒細胞和單核細胞分別為(7.23±3.79)×105/ml和(0.60± 0.28)×105/ml,與野生型小鼠[(13.22±6.86)×105/ml和(1.37±0.65)×105/ml]比較,分別降低1.83和2.29倍(t=3.213和3.063,P=0.015和0.008)。此外,野生型小鼠的單核細胞在CLP手術后0和24 h分別(0.52±0.42)×105/ml和(1.37±0.65)×105/ml,差異有統計學意義(t=3.072,P=0.008)。見表2。
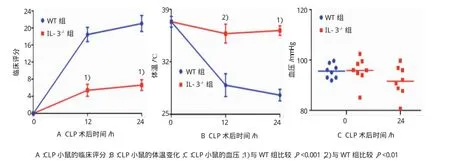
圖3 阻斷IL-3對CLP小鼠行為、體溫和血壓的影響
免疫組織化學染色結果表明,小鼠CLP手術后24 h后,野生型小鼠肺和肝組織存在大量的中性粒細胞和單核細胞聚集,肺組織的單核細胞和中性粒細胞分別為(5.25±1.79)×106和(1.80±0.87)× 106;肝組織的單核細胞和中性粒細胞分別為(1.23± 0.36)×106和(5.44±4.56)×107;而IL-3缺陷型小鼠肺組織的單核細胞和中性粒細胞分別為(3.44± 0.99)×106和(1.03±1.00)×106;肝組織的單核細胞和中性粒細胞分別為(0.56±0.32)×106和(1.59± 1.63)×107,兩組比較IL-3缺陷型小鼠中性粒細胞和單核細胞數量減少(t=2.493、2.594、3.940和2.253,P=0.026、0.021、0.002和0.041)。見表3和圖5~7。
2.6阻斷IL-3對CLP小鼠炎癥細胞因子表達的影響
ELISA檢測結果表明,野生型小鼠組中,IL-1β、IL-6和 IFN-α 分別為(412.84±243.23)pg/ml、(37.94±24.49)ng/ml和(139.71±114.18)pg/ml。IL-3缺陷型小鼠組中,IL-1β、IL-6和IFN-α分別為(22.61±6.68)pg/ml、(7.22±5.00)ng/ml和(23.17± 26.95)pg/ml,與野生型小鼠組比較,分別下降95%、81%和83%(t=4.536、3.475和2.810,P=0.001、0.004 和0.014)。見表4和圖8。
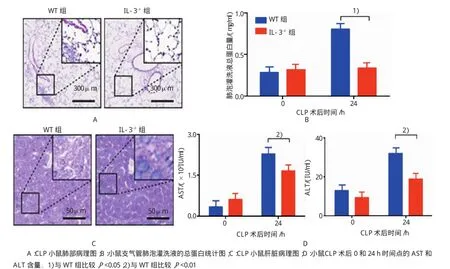
圖4 阻斷IL-3對CLP小鼠肺和肝組織炎癥反應的影響

圖5 阻斷IL-3對CLP小鼠肺組織炎癥細胞的影響
表2 兩組CLP術后血液中性粒細胞及單核細胞比較 (n=6,×105/ml±s)
表2 兩組CLP術后血液中性粒細胞及單核細胞比較 (n=6,×105/ml±s)
注:1)與WT組比較,P<0.05;2)與WT組比較,P<0.01
組別0h 6h 12h 24h WT組中性粒細胞 5.62±2.55 8.93±5.58 6.30±3.52 13.22±6.86單核細胞0.52±0.42 0.49±0.23 0.75±0.42 1.37±0.65 IL-3-/-組中性粒細胞 6.45±2.74 12.17±3.38 8.93±5.71 7.23±3.791)單核細胞 0.64±0.42 0.49±0.32 0.46±0.46 0.60±0.282)
表3 兩組CLP術后24 h肺及肝組織炎癥細胞比較 (n=6,×106±s)
表3 兩組CLP術后24 h肺及肝組織炎癥細胞比較 (n=6,×106±s)
注:1)與WT組比較,P<0.05;2)與WT組比較,P<0.01
組別肺組織肝組織中性粒細胞WT組 5.25±1.79 1.80±0.87 1.23±0.36 54.44±45.58 IL-3-/-組 3.44±0.991) 1.03±1.001) 0.56±0.322) 15.88±16.321)單核細胞中性粒細胞單核細胞
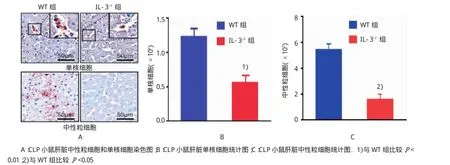
圖6 阻斷IL-3對CLP小鼠肝組織炎癥細胞的影響
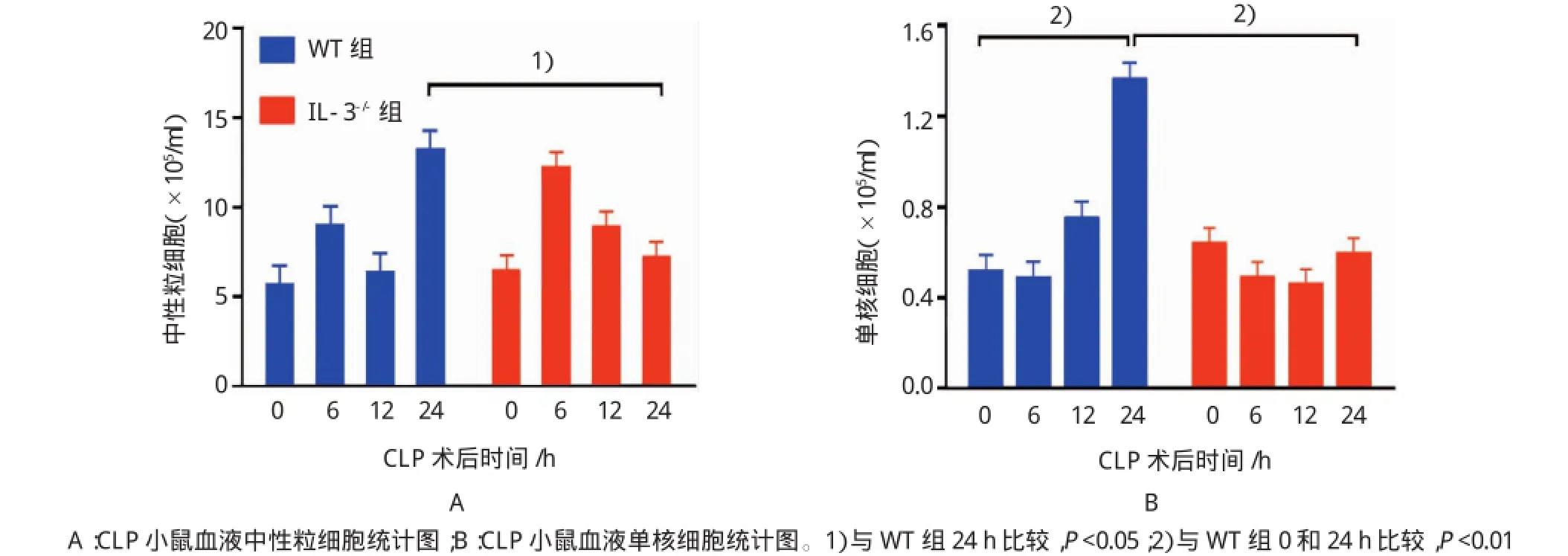
圖7 阻斷IL-3對CLP小鼠血液中炎癥細胞的影響
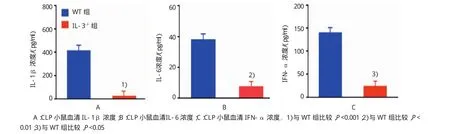
圖8 阻斷IL-3對CLP小鼠炎癥細胞因子表達的影響
表4 兩組CLP后24 h血清炎癥細胞因子含量比較(n=6±s)
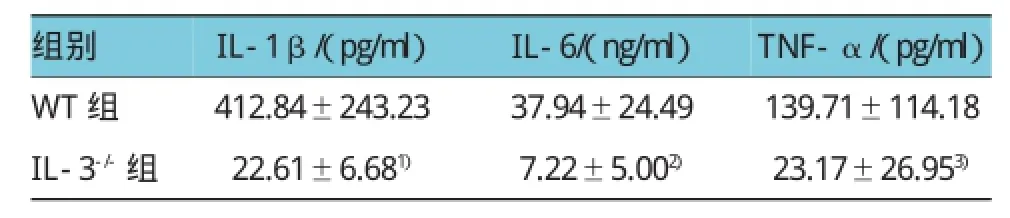
表4 兩組CLP后24 h血清炎癥細胞因子含量比較(n=6±s)
注:1)與WT組比較,P<0.001;2)與WT組比較,P<0.01;3)與WT組比較,P<0.05
組別TNF-α/(pg/ml)WT組 412.84±243.23 37.94±24.49 139.71±114.18 IL-3-/-組 22.61±6.681) 7.22±5.002) 23.17±26.953)IL-1β/(pg/ml)IL-6/(ng/ml)
3 討論
膿毒血癥是由感染引起的,具有免疫與炎癥反應的高發病率和死亡率疾病。炎癥反應往往伴隨著炎癥細胞的激活和多種炎癥細胞因子的產生和釋放。許多研究表明,膿毒血癥與大量的炎癥細胞因子(IFN-α、IL-1和IL-6)產生有關。這些炎癥細胞因子產生似乎代表著不受控制的強烈炎癥反應。據研究報道,給予這些炎癥細胞因子可以模仿產生許多膿毒性休克癥狀,包括不良的心血管反應[8,11]。給予抗細胞因子,如IFN-α抗體能夠提高嚴重膿毒性休克動物和人的成活率[12-13]。本研究表明,IL-3缺陷型小鼠組CLP手術后小鼠的存活率和臨床癥狀表現出明顯的改善,提示IL-3參與膿毒血癥的發病機制。WEBER等[14]研究發現,給予健康的野生型小鼠IL-3,可以使其炎癥細胞數增加,等同野生型CLP小鼠。相反,給予IL-3受體拮抗劑(Anti-CD123)能夠減少野生型CLP小鼠的炎癥細胞數并提高其生存率。研究報告表明,膿毒血癥患者中的IL-3濃度很高,并伴有高死亡風險[15]。這些研究表明IL-3通過與其受體結合,可以促進炎癥細胞的產生,提高膿毒性小鼠的成活率。
本研究中筆者還發現,與野生型小鼠比較,敲除IL-3能夠降低小鼠肺和肝組織中的單核細胞和中性粒細胞以及血液中炎癥細胞因子IL-1β、IL-6和IFN-α的表達水平。這提示當機體發生感染,IL-3會促進單核細胞和中性粒細胞及免疫細胞等產生,而這些細胞會釋放出大量的炎癥細胞因子。膿毒血癥是免疫系統對感染或組織損傷發生的一種過度反應,產生大量的細胞因子,導致大量的免疫細胞募集。這些細胞又會釋放出更多的細胞因子,從而又招募更多的免疫細胞,形成一個惡性循環。這些細胞因子和免疫細胞并不會阻止初始的感染,而是攻擊機體的組織和器官,導致器官衰竭和死亡。RAUCH等[16]研究表明,IL-3由脾臟、胸腺和淋巴結中的B細胞產生,IL-3能導致多種白細胞的產生和增殖,從而釋放出大量的細胞因子(被稱為細胞因子風暴)。另有研究顯示,CLP術后,小鼠產生IL-3的T細胞和B細胞數不同,但嗜堿性細胞與肥大細胞數相差不大,這表明IL-3在炎癥初期對嗜堿性細胞和肥大細胞的產生及功能沒有影響[17-19]。本研究也表明,CLP術后野生型小鼠的肺和肝組織積累著比IL-3缺陷型小鼠更多的單核細胞和中性粒細胞,并且支氣管灌洗液中的蛋白也明顯增多。這說明IL-3促進膿毒血癥中的炎癥反應。ANNANE[20]和WARD 等[21]報道,IL-3還會導致膿毒血癥中的膿毒性休克。
綜上可知,IL-3可以通過增強炎癥反應促進膿毒血癥的發生,而阻斷IL-3能夠減輕炎癥反應,改善膿毒血癥的成活率,這為IL-3成為臨床上治療膿毒血癥的靶點提供研究基礎。
參考文獻:
[1]RITTIRSCH D,HOESEL L M,WARD P A.The disconnect between animal models of sepsis and human sepsis[J].J Leukoc Biol, 2007,81(1):137-143.
[2]DEITCH E A.Rodent models of intra-abdominal infection[J]. Shock,2005,24(1):19-23.
[3]DYSON A,SINGER M.Animal models of sepsis:why does preclinical efficacy fail to translate to the clinical setting[J].Crit Care Med,2009,37(1):30-37.
[4]BURAS J A,HOLZMANN B,SITKOVSKY M.Animal models of sepsis:setting the stage[J].Nat Rev Drug Discov,2005,4(10): 854-865.
[5]ANGUS D C,POLL T.Severe sepsis and septic shock[J].N Engl J Med,2013,369(21):2063.
[6]HOTCHKISS R S,MONNERET G,PAYEN D.Sepsis-induced immunosuppression:from cellular dysfunctions to immunotherapy [J].Nat Rev Immunol,2013,13(12):862-874.
[7]DEUTSCHMAN C S,TRACEY K J.Sepsis:current dogma and new perspectives[J].Immunity,2014,40(4):463-475.
[8]CASEY L C,BALK R A,BONE R C.Plasma cytokine and endotoxin levels correlate with survival in patients with the sepsis syndrome[J].Ann Intern Med,1993,119(8):771-778.
[9]高戎,徐建如,李仁奇,等.人參皂苷Rg5對膿毒血癥大鼠急性肺損傷的保護作用[J].現代生物醫學進展,2013,13(11):2062-2064.
[10]RITTIRSCH D,HUBER-LANG M S,FLIERL M A,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[11]TAKAO K,MIYAKAWA T.Genomic responses in mouse models greatly mimic human inflammatory diseases[J].Proc Natl A-cad Sci USA,2015,112(4):1167-1172.
[12]ABRAHAM E,WUNDERINK R,SILVERMAN H,et al.Effi-cacy and safety of monoclonal antibody to human tumor necrosis factor alpha in patients with sepsis syndrome.A randomized, controlled,double-blind,multicenter clinical trial[J].TNF-alpha MAb Sepsis Study Group JAMA,1995,273(12):934-941.
[13]BOSMANN M,WARD PA.The inflammatory response in sepsis[J]. Trends Immunol,2013,34(3):129-136.
[14]WEBER G F,CHOUSTERMAN B G,HE S,et al.Nterleukin-3 amplifies acute inflammation and is a potential therapeutic target in sepsis[J].Science,2015,347(6227):1260-1265.
[15]WEBER G F,CHOUSTERMAN B G,HE S,et al.Inflammatory factor IL-3 may play essential role in development of sepsis[J]. Science,March 2015.DOI:10.1126/science.aaa4268
[16]RAUCH P J,CHUDNOVSKIY A,ROBBINS C S,et al.Innate response activator B cells protect against microbial sepsis[J]. Science,2012,335(6068):597-601.
[17]JAMUR MC,OLIVER C.Origin,maturation and recruitment of mast cell precursors[J].Front Biosci,2011,3:1390-1406.
[18]VOEHRINGER D.Basophil modulation by cytokine instruction[J]. Eur J Immunol,2012,42(10):2544-2550.
[19]RONNBERG E,JOHNZON C F,CALOUNOVA G,et al.Mast cells are activated by staphylococcus aureus in vitro but do not influence the outcome of intraperitoneal S[J].Aureus Infection In Vivo Immunology,2014,143(2):155-163.
[20]ANNANE D,BELLISSANT E,CAVAILLON J M.Septic shock[J]. Lancet,2005,365(9453):63-78.
[21]WARD P A.New approaches to the study of sepsis[J].EMBO Mol Med,2012,4(12):1234-1243.
(申海菊編輯)
中圖分類號:R 459.7
文獻標識碼:A
DOI:10.3969/j.issn.1005-8982.2016.13.006
文章編號:1005-8982(2016)13-0028-09
收稿日期:2015-12-02
Blockade of IL-3 ameliorates sepsis-induced inflammation in mice
Bai-ye Xu1,Jing Zhang2,Qing-hai Wang1,Shi-shan Liang1,Zhen Chen1,Hai-dao Wang1
(1.Department of Pediatrics,Quanzhou First Hospital Affiliated to Fujian Medical University,Quanzhou,Fujian 362000,China;2.Quanzhou Medical College,Quanzhou,Fujian 362000,China)
Abstract:Objective To investigate the effect of blockade of IL-3 on sepsis-induced inflammation in mice and explore its underlying mechanism.Methods Mice in WT group(n=13)and IL-3-/-group(n=13)were observed and mortality was recorded up to 7 days after cecal ligation and puncture(CLP).In addition,more mice were randomly assigned to WT group(n=20)and IL-3-/-group(n=20)after CLP,each group was divided into 3 subgroups for study.In the first subgroup,clinical score assessment and body temperature measurement were conducted at 0,12 and 24 h after CLP;blood pressure was measured and blood was collected to determine the levels of IFN-α,IL-1β and IL-6 by ELISA at 24 h after CLP.In the second subgroup,blood was collected to determine the total number of neutrophils and monocytes at 0,6,12 and 24 h after CLP,and lungs and liver were harvested for histopathological analysis at 24 h after CLP.In the third subgroup,blood and bronchoalveolar lavage fluid(BALF)were collected to determine total protein content and enzyme activity(AST and ALT)at 0 h,24 h after CLP.Results The survival,body temperature and blood pressure of septic mice in the IL-3-/-group were significantly improved after CLP compared with mice in the WT group(P<0.05).The clinical score of the septic mice in the IL-3-/-group significantly decreased compared with the WT group(P<0.05).In addition,the levels of IL-2 and IFN-γ in the IL-3-/-group significantly decreased compared with the WT group(P<0.05).The total number of neutrophils and monocytes inthe lung and liver tissues of the IL-3-/-group significantly decreased,and the total protein content of BALF and enzyme activity of serum AST and ALT also significantly decreased in the IL-3-/-group compared with the WT group(P<0.05).Conclusions Blockade of IL-3 can improve survival of septic mice through alleviation of sepsis-induced inflammation.
Keywords:sepsis;cecal ligation and puncture;neutrophil;monocyte;blood and bronchoalveolar lavage fluid;interferon-α

