富生酮氨基酸飲食改善高脂誘導(dǎo)小鼠非酒精性脂肪肝*
徐玲,馬紅艷,肖斌,高陳林
(1.瀘州醫(yī)學(xué)院附屬醫(yī)院 內(nèi)分泌代謝科,四川 瀘州 646000;2.四川醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院 生物化學(xué)教研室,四川 瀘州 646000)
?
論著
富生酮氨基酸飲食改善高脂誘導(dǎo)小鼠非酒精性脂肪肝*
徐玲1,馬紅艷1,肖斌2,高陳林1
(1.瀘州醫(yī)學(xué)院附屬醫(yī)院 內(nèi)分泌代謝科,四川 瀘州 646000;2.四川醫(yī)科大學(xué)基礎(chǔ)醫(yī)學(xué)院 生物化學(xué)教研室,四川 瀘州 646000)
摘要:目的探討富生酮氨基酸(KAA)飲食對高脂誘導(dǎo)小鼠非酒精性脂肪肝的影響及機(jī)制。方法C57BL雄性小鼠隨機(jī)分4組,給予常規(guī)飲食(NC)、高脂飲食(HFD)、富生酮氨基酸高脂飲食(HFDKAAR)以及高脂喂養(yǎng)8周后改為富生酮氨基酸高脂飲食(HFD→HFDKAAR)喂養(yǎng)。每周測進(jìn)食量、體重,16周后行腹腔內(nèi)注射葡萄糖耐量實驗后處死小鼠,測肝重量、內(nèi)臟脂肪重量、肝脂質(zhì)沉積、Kupffer細(xì)胞聚集及腫瘤壞死因子-α(TNF-α)和白介素-1β(IL-1β)mR NA表達(dá)。結(jié)果各組小鼠攝入熱卡比較差異無統(tǒng)計學(xué)意義。與NC組比較,HFD組小鼠體重和內(nèi)臟脂肪重量增加,伴隨胰島素抵抗,肝脂質(zhì)沉積和Kupffer細(xì)胞數(shù)量顯著增加,TNF-α和IL-1β mR NA表達(dá)增加(P<0.05)。與HFD組比較,HFDKAAR及HFD→HFDKAAR組小鼠體重、內(nèi)臟脂肪下降,胰島素抵抗均減輕(P<0.05),肝臟Kupffer細(xì)胞的數(shù)量及脂質(zhì)沉積減少,TNF-α和IL-1β mR NA的高表達(dá)均被逆轉(zhuǎn)(P<0.05)。結(jié)論高脂膳食能誘導(dǎo)出非酒精性脂肪肝小鼠模型,富生酮氨基酸飲食可抑制高脂誘導(dǎo)的肝臟Kupffer細(xì)胞的表達(dá),顯著改善高脂飲食誘導(dǎo)的肥胖、胰島素抵抗、肝脂質(zhì)沉積,減輕肝臟的炎癥損傷。
關(guān)鍵詞:氨基酸;非酒精性脂肪肝病;代謝綜合征
生酮氨基酸(ketogenic amino acid,KAA)是指分解代謝過程中能轉(zhuǎn)變成酮體的的氨基酸,不能在體內(nèi)合成,屬于必須氨基酸。一些臨床和動物實驗顯示氨基酸參與的代謝異常與多種疾病的發(fā)生發(fā)展有關(guān)。目前有學(xué)者報道生酮氨基酸能減輕脂肪肝及改善胰島素抵抗,也有與之相反的報道,因此從非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的病因?qū)W和治療學(xué)的角度看氨基酸代謝,其作用還存在爭議。本實驗用高脂飲食誘導(dǎo)小鼠NAFLD,用富生酮氨基酸飲食作為干預(yù)因素,觀察小鼠的血糖、胰島素抵抗指數(shù)、肝臟脂質(zhì)沉積和肝臟巨噬細(xì)胞、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(Interleukin-1β,IL-1β)mRNA的表達(dá),旨在進(jìn)一步探討富生酮氨基酸飲食對NAFLD的作用及可能機(jī)制,為防治非酒精性脂肪肝提供新的依據(jù)。
1 材料與方法
1.1一般材料
1.1.1實驗動物清潔級8周齡體重為20~23 g 的C57BL雄性小鼠(四川醫(yī)科大學(xué)動物實驗室提供),動物飼料(日本Ajinomoto公司)。
1.1.2主要實驗材料實時熒光定量聚合酶鏈反應(yīng)(real-time quantitative polymerase chain reaction,Real-time qPCR)試劑盒(日本TaKaRa公司),大鼠抗小鼠單克隆F4/80抗體(英國AbD Serotec公司),羅丹明標(biāo)記熒光二抗(美國Jackson Immuno Research公司),胰島素酶聯(lián)免疫吸附法(enzyme-linked immunosorbent assay,ELISA)試劑盒(日本MIoBS公司),微量血糖儀(上海羅氏診斷)。
1.2實驗方法
1.2.1動物分組將32只小鼠隨機(jī)分組,分別給予普通飲食(normal control,NC)(n=8)、高脂飲食[52%脂肪(high fat diet,HFD)](n=16)、富含生酮氨基酸的高脂飲食(8%生酮氨基酸+52%脂肪HFDKAAR)(n= 8)喂養(yǎng);喂養(yǎng)8周后再將高脂飲食組小鼠隨機(jī)分為兩組,一組繼續(xù)原高脂飲食喂養(yǎng)(n=8),另一組改為富生酮氨基酸高脂飲食喂養(yǎng)(HFD→HFDKAAR)(n= 8)。具體飲食配方參照文獻(xiàn)[1],每周測進(jìn)食量和體重 [第8、12周時因腹腔注射葡萄糖耐量試驗(intraperitoneal glucose tolerance test,IPGTT)故停測進(jìn)食量],共喂養(yǎng)16周。
1.2.2血糖、胰島素水平的檢測各組小鼠喂養(yǎng)16周后,禁食6h,測體重后腹腔內(nèi)注射葡萄糖(1g/kg),分別在注射葡萄糖前、注射葡萄糖后15、30、60、90和120min測血糖,繪制曲線并依據(jù)公式計算曲線下面積(area under curve,AUC)[mmol/(L·h)]=(0 min血糖值+30min血糖值)×0.5/2+(30min血糖值+60min血糖值)×0.5/2+(60min血糖值+120min血糖值)× 1/2;同時收集注射葡萄糖前、注射葡萄糖后15、30和60 min尾靜脈血,用ELISA方法測各時間點小鼠血漿中胰島素濃度,根據(jù)血糖和胰島素濃度計算胰島素抵抗指數(shù)(insulin resistance index,IRI),公式為:IRI=葡萄糖(mmol/L)×胰島素(mIU/L)/22.5。
1.2.3油紅O染色測肝細(xì)胞脂質(zhì)沉積處死小鼠取肝組織,優(yōu)化的切片溫度(opti-mum cutting temperature,OCT)包埋冷凍切片(8μm),10%甲醛固定,60%異丙醇處理后行油紅O染色20 min,70%甘油封片,顯微鏡下觀察肝細(xì)胞中脂質(zhì)沉積。
1.2.4R eal-time qPCR檢測肝細(xì)胞中炎癥因子TNF-α和IL-1β mR NA表達(dá)處死小鼠,Trizol提肝臟總RNA,按試劑盒逆轉(zhuǎn)錄成互補(bǔ)脫氧核糖核酸(complementary DNA,cDNA)。引物、染料由日本TaKaRa公司合成。將cDNA按Real-time qPCR體系(20μl)反應(yīng),18 S作為管家基因。TNF-α:正向引物5'-GTTCTATGGCCCAGACCCTCAC-3',反向引物5'-GGCACCACTAGTTGGTTGTCTTTG-3';IL-1β:正向引物5'-TCCAGGATGAGGACATGAGCAC-3',反向引物5'-GAACGTCACACACCAGCAGGTTA-3';18S:正向引物5'-TTCTGGCCAACGGTCTAGACAAC -3',反向引物5'-CCAGTCGTCTTGGTGTGCTGA-3'。反應(yīng)條件:95℃預(yù)變性30 s,95℃變性5 s,60℃退火30 s,擴(kuò)增40個循環(huán)后收集數(shù)據(jù)繪制動力學(xué)曲線讀取Ct值,擴(kuò)增重復(fù)3次。將各組目的基因Ct值與管家基因Ct值相減得△Ct,再將各組的△Ct與正常對照組的△Ct相減得△△Ct,最后根據(jù)2-△△Ct值進(jìn)行統(tǒng)計分析。
1.2.5免疫熒光染色檢測肝臟 F4/80巨嗜細(xì)胞(kuffer cells,KCs)表達(dá)處死小鼠取肝組織,OCT包埋冷凍切片(5μm),每組隨機(jī)選4張切片,丙酮處理,2%牛血清白蛋白封閉后加大鼠抗小鼠F4/80單克隆抗體(1∶100),室溫孵育,再經(jīng)TRITC熒光標(biāo)記的二抗室溫反應(yīng)(1∶200),4',6-二脒基-2-苯基吲哚封片,免疫熒光顯微鏡觀察肝臟F4/80陽性KCs數(shù)量,每組隨機(jī)選10個視野行F4/80陽性細(xì)胞計數(shù)進(jìn)行統(tǒng)計分析。
1.3統(tǒng)計學(xué)方法
采用SPSS 13.0統(tǒng)計軟件進(jìn)行數(shù)據(jù)分析,計量數(shù)據(jù)以均數(shù)±標(biāo)準(zhǔn)差(±s)表示,各組均數(shù)的比較用方差分析,兩兩比較用方差分析的SNK-q檢驗,P< 0.05為差異有統(tǒng)計學(xué)意義。
2 結(jié)果
2.1各組小鼠的進(jìn)食量比較
與NC組比較,HFD、HFDKAAR及HFD→HFDKAAR組小鼠每周進(jìn)食量稍減少;而HFD、HFDKAAR及HFD →HFDKAAR3組間小鼠每周進(jìn)食量基本一致。經(jīng)不同飲食提供的熱量矯正后,各組小鼠每天進(jìn)食熱量差異無統(tǒng)計學(xué)意義(F=1.703,P=0.212)。見圖1。
2.2各組小鼠體重、肝臟重量、內(nèi)臟脂肪重量、內(nèi)臟脂肪/體重百分比比較
HFD組小鼠與對照組比較體重增加,HFDKAAR組及HFD→HFDKAAR組小鼠體重較HFD組減輕,經(jīng)SNK-q檢驗方差分析后,差異有統(tǒng)計學(xué)意義(P=0.000、0.032和P=0.000)。HFD組小鼠內(nèi)臟脂肪(腸系膜和附睪脂肪組織)重量及內(nèi)臟脂肪/體重百分比高于NC組(P=0.001和0.002)。富生酮氨基酸飲食喂養(yǎng)16周后,不管是HFDKAAR組還是HFD→HFDKAAR組小鼠肝臟重量、內(nèi)臟脂肪重量及內(nèi)臟脂肪/體重百分比與HFD組比較均下降,差異有統(tǒng)計學(xué)意義。見表1。
2.3各組小鼠糖耐量及胰島素抵抗的比較
IPGTT結(jié)果顯示,與NC組比較,HFD組小鼠各時間點血糖、胰島素濃度、IRI上升,表現(xiàn)出糖耐量異常和胰島素抵抗。與HFD組比較,HFDKAAR及HFD→HFDKAAR組小鼠各時間點血糖、胰島素濃度、IRI均降低,特別是HFDKAAR組注射葡萄糖30min后胰島素濃度[(0.78±0.46)ng/ml]較HFD組[(1.24± 0.38)ng/ml]下降,注射葡萄糖60 min后HFDKAAR組血糖 [(13.96±3.08)mmol/L]較HFD組 [(21.35± 4.36)mmol/L]下降,經(jīng)SNK-q檢驗方差分析后,差異有統(tǒng)計學(xué)意義(P=0.035和0.034)。HFD組小鼠AUC[(37.93±2.17)]較NC組[(24.73±1.42)]增加41.25% (P=0.000);與HFD組小鼠比較,HFDKAAR組小鼠AUC[(28.22±1.38)]下降23.73%(P=0.000),HFD→HFDKAAR組小鼠AUC[(31.49±1.17)]下降13.91%(P= 0.002)。見圖2。
2.4各組小鼠肝臟TNF-α和IL-1β mRNA表達(dá)比較
Real-time qPCR結(jié)果顯示,與NC組比較,HFD組小鼠肝臟組織中炎癥因子TNF-α和IL-1β mRNA的表達(dá)分別增加2.56和3.29倍;與HFD組比較,HFDKAAR組和HFD→HFDKAAR組小鼠肝臟組織中TNF-α和IL-1β mRNA的高表達(dá)都被抑制。見表2和圖3。
2.5各組小鼠肝臟F4/80 KCs表達(dá)的比較
免疫熒光染色顯示F4/80在肝成熟KCs表面表達(dá)。NC組小鼠肝臟F4/80陽性細(xì)胞數(shù)為(2.33± 0.75)/視野,HFD組小鼠肝臟F4/80陽性細(xì)胞數(shù)為(9.70±1.96)/視野,HFD組小鼠肝臟KCs表達(dá)較NC組增加(P=0.000);與HFD組比較,不管是HFDKAAR組[F4/80陽性細(xì)胞數(shù)為(3.40±0.84)/視野]還是HFD→HFDKAAR組[F4/80陽性細(xì)胞數(shù)為(4.00±0.82)/視野],小鼠肝臟KCs表達(dá)均下降,差異有統(tǒng)計學(xué)意義(P=0.000)。見圖4。
2.6各組小鼠肝細(xì)胞脂質(zhì)沉積的比較
NC組小鼠肝細(xì)胞脂質(zhì)沉積較少,HFD組小鼠肝細(xì)胞脂質(zhì)沉積較NC組增加,脂滴增大;與HFD組比較,不管是HFDKAAR組還是HFD→HFDKAAR組,小鼠肝細(xì)胞脂質(zhì)沉積均減少,脂滴縮小。見圖5。
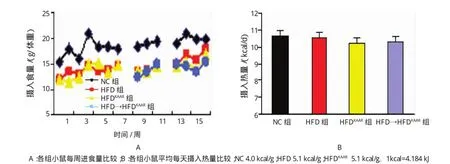
圖1 各組小鼠的進(jìn)食量比較

圖2 各組小鼠血糖、胰島素濃度、IRI及AUC比較
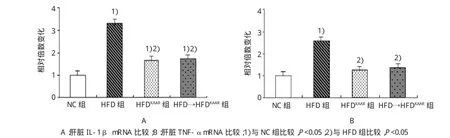
圖3 各組小鼠肝臟IL-1β和TNF-α mRNA表達(dá)比較
表1 各組小鼠體重、肝臟重量、內(nèi)臟脂肪重量及內(nèi)臟脂肪/體重百分比的比較(n=8±s)
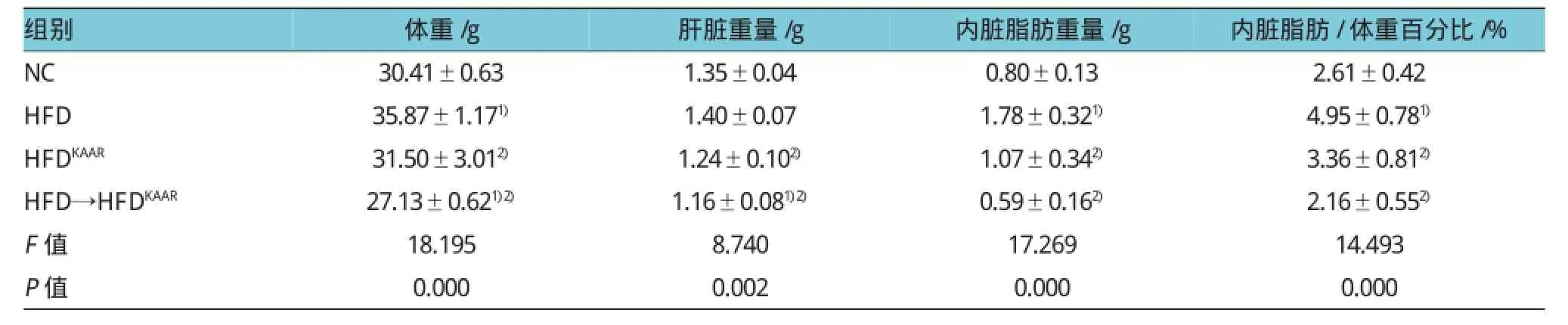
表1 各組小鼠體重、肝臟重量、內(nèi)臟脂肪重量及內(nèi)臟脂肪/體重百分比的比較(n=8±s)
注:1)與NC組比較,P<0.05;2)與HFD組比較,P<0.05
組別內(nèi)臟脂肪/體重百分比/% NC 30.41±0.63 1.35±0.04 0.80±0.13 2.61±0.42 HFD 35.87±1.171) 1.40±0.07 1.78±0.321) 4.95±0.781)體重/g 肝臟重量/g 內(nèi)臟脂肪重量/g HFDKAARHFD→HFDKAAR31.50±3.012)27.13±0.621)2)1.24±0.102)1.16±0.081)2)1.07±0.342)0.59±0.162)3.36±0.812)2.16±0.552)F值 18.195 8.740 17.269 14.493 P值 0.000 0.002 0.000 0.000
表2 各組小鼠肝臟TNF-α和IL-1β mRNA表達(dá)比較 (n=6±s)

表2 各組小鼠肝臟TNF-α和IL-1β mRNA表達(dá)比較 (n=6±s)
注:1)與NC組比較,P<0.05;2)與HFD組比較,P<0.05
組別IL-1β mRNA 2-△△CtNC 32.29±0.32 1.00±0.45 1.00±0.38 TNF-αmRNA Ct值IL-1β mRNA Ct值18S mRNA Ct值25.53±0.22 18.76±0.18 TNF-αmRNA 2-△△CtHFD HFDKAAR31.25±0.34 31.87±0.41 24.25±0.23 18.38±0.42 24.78±0.32 18.47±0.30 2.56±0.871)1.24±0.392)3.29±1.371)1.67±0.401)2)HFD→HFDKAAR 31.94±0.241.34±0.262) 1.73±0.331)2)24.72±0.24 18.66±0.24 F值13.032 7.627 P值 0.000 0.002
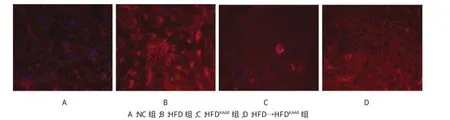
圖4 各組小鼠肝臟F4/80 KCs表達(dá)比較 (免疫熒光染色×400)
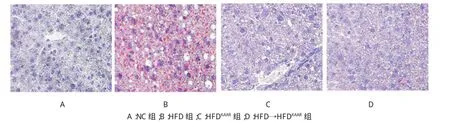
圖5 各組小鼠肝細(xì)胞脂質(zhì)沉積比較 (油紅O染色×400)
3 討論
隨著人們生活方式的改變,NAFLD已成為西方發(fā)達(dá)國家最為普遍的慢性肝病,近年來我國的發(fā)病率也大幅攀升。NAFLD不僅可進(jìn)展為肝硬化、肝癌,還與機(jī)體胰島素抵抗、2型糖尿病等代謝性疾病密切相關(guān)[2]。公認(rèn)的NAFLD病理生理改變核心是肝臟胰島素抵抗,故NAFLD被看作是代謝綜合征在肝臟的表現(xiàn)[3],其發(fā)生、發(fā)展的機(jī)制未完全明確。如何有效防治NAFLD等代謝性疾病一直是研究的熱點。
KAA是指分解代謝過程中能轉(zhuǎn)變成酮體的氨基酸,有異亮氨酸、亮氨酸、賴氨酸、色氨酸、苯丙氨酸、蘇氨酸和酪氨酸。這些氨基酸不能在體內(nèi)合成,屬于必須氨基酸。近年氨基酸代謝異常與NAFLD等代謝性疾病發(fā)生發(fā)展的關(guān)系越來越受到重視。有報道補(bǔ)充支鏈氨基酸可降低小鼠心臟和骨骼肌的氧化應(yīng)激,延長小鼠壽命[4-5]。新近報道長期生酮飲食可以轉(zhuǎn)變機(jī)體氨基酸代謝水平,改善肥胖及脂肪性肝炎[6]。SOLERTE等[7]發(fā)現(xiàn)口服異亮氨酸等生酮氨基酸混合制劑能改善老年2型糖尿病胰島素抵抗。YASUSHI等[1]發(fā)現(xiàn)生酮氨基酸飲食能顯著抑制小鼠肝臟脂質(zhì)合成并預(yù)防脂肪肝和胰島素抵抗的發(fā)生。國內(nèi)宋文琪等[8]報道,單純性肥胖患兒的血清氨基酸水平嚴(yán)重失衡,且普遍存在胰島素抵抗。金玲鳳等[9]發(fā)現(xiàn)高脂飲食誘導(dǎo)的SD大鼠NAFLD肝內(nèi)蛋白質(zhì)組學(xué)隨著肝內(nèi)脂肪的聚集而改變。葉春等[10]發(fā)現(xiàn)運動使NAFLD大鼠血清中支鏈氨基酸上升,芳香族氨基酸明顯下降,肝功能明顯好轉(zhuǎn)。但與之相反,NEWGARD等[11]報道持續(xù)氨基酸灌注會通過活化mTOR通路而導(dǎo)致胰島素抵抗,氨基酸代謝如何參與NAFLD等代謝性疾病的發(fā)生、發(fā)展未完全明確,有必要進(jìn)一步研究。
KCs是定居于肝血竇的單核巨噬細(xì)胞,是體內(nèi)最大的巨噬細(xì)胞群。巨噬細(xì)胞作為炎癥因子的經(jīng)典來源,激活的KCs產(chǎn)生多種細(xì)胞因子如TNF-α、白介素-6等。KCs在NAFLD等代謝性疾病發(fā)生機(jī)制中的作用已越來越受到關(guān)注[12-14]。F4/80是KCs的特異性表達(dá)表面抗原,本研究利用F4/80抗體對肝組織行免疫熒光染色檢測肝KCs的數(shù)量及募集情況。
前期預(yù)實驗中發(fā)現(xiàn),小鼠高脂喂養(yǎng)8周開始出現(xiàn)糖耐量異常和肝脂質(zhì)沉積,所以本研究干預(yù)組有HFD組和HFD→HFDKAAR組,旨在觀察富KAA飲食能否改善高脂飲食誘導(dǎo)的小鼠脂肪肝,同時也觀察已經(jīng)出現(xiàn)脂肪肝的小鼠,再用富KAA飲食能否改善或逆轉(zhuǎn)脂肪肝。研究發(fā)現(xiàn),高脂飲食能誘導(dǎo)肝脂肪變性,KCs增多聚集,炎癥因子表達(dá)顯著增加,與黃海琇等[15]報道NAFLD早期階段,KCs已經(jīng)呈現(xiàn)出經(jīng)典激活巨噬細(xì)胞M1型,TNF-α等炎癥因子明顯增加一致。本研究中筆者發(fā)現(xiàn),飲食中增加生酮氨基酸含量沒有影響小鼠食欲。在攝入相同卡路里、相同脂肪情況下,不管是HFDKAAR組還是HFD→HFDKAAR組小鼠肝脂肪變性、胰島素抵抗、肥胖等均明顯改善或被逆轉(zhuǎn);肝臟炎癥因子TNF-α和IL-1β mRNA的高表達(dá)均明顯被抑制,可能與減少高脂飲食所誘導(dǎo)的小鼠肝臟KCs的聚集密切相關(guān)。
綜上所述,高脂膳食能構(gòu)建出NAFLD小鼠模型,中長期的富生酮氨基酸飲食可抑制肝臟KCs的激活,顯著改善或逆轉(zhuǎn)高脂飲食誘導(dǎo)的肥胖、胰島素抵抗、肝臟脂質(zhì)沉積,減輕肝臟的炎癥損傷。
參考文獻(xiàn):
[1]YASUSHI N,NATSUMI N,NAHOKO S,et al.Ketogenic essential amino acids modulate lipid synthetic pathways and prevent hepatic steatosis in mice[J].PLoS One,2010,5(8):e12057.DOI: 10.1371/journal.pone.0012057.
[2]PARASH O,HAMID S.Are we ready for a new epidemic of under recognized liver disease in South Asia especially in Pasistin?Non alcoholic fatty liver disease[J].JPak Med Assoc, 2013,63(3):95-99.
[3]HE B,LIU L,YU C,et al.Roux-en-Y gastric bypass reduces lipid overaccumulation in liver by upregulating hepatic autophagy in obese diabetic rats[J].Obes Surg,2015,25(1):109-118.
[4]ALESSANDRAV,GIUSEPPEDA,ENZO N.Branched-chain amino acids,mitochondrial biogenesis,and healthspan:an evolutionary perspective[J].Aging,2011,3(5):464-478.
[5]GIUSEPPE D A,MAURIZIO R,ANNALISA C,et al.Branchedchain amino acid supplementation promotes survival and supports cardiac and skeletal muscle mitochondrial biogenesis in middle-aged mice[J].Cell Metab,2010,12(10):362-372.
[6]DOURIS N,MELMAN T,PECHERERJM,et al.Adaptive changes in amino acid metabolism permit normal longevity in mice consuming a low-carbohydrate ketogenic diet[J].Biochim Biophys Acta,2015,1852(10):2056-2065.
[7]SOLERTE S B,GAZZARUSO C,SCHIFINO N,et al.Metabolic effects of orally administered amino acid mixture in elderly subjects with poorly controlled type 2 diabetes mellitus[J].Am J Cardiol,2004,93(8):23-29.
[8]宋文琪,李時蓮,張美和,等.單純性肥胖兒童血清氨基酸水平分析[J].中國兒童保健雜志,2011,19(4):580-583.
[9]金玲鳳,劉小偉,盧放根,等.大鼠非酒精性脂肪肝形成過程中肝臟蛋白質(zhì)組動態(tài)變化的研究[J].中國現(xiàn)代醫(yī)學(xué)雜志,2014,24(21): 26-32.
[10]葉春,何執(zhí)靜.長期游泳運動對非酒精性脂肪肝大鼠血清氨基酸譜的影響及分析[J].南京師大學(xué)報(自然科學(xué)版),2015,38(2):122-127.
[11]NEWGARD C B,AN J,BAIN J R,et al.A branched-chain amino acid-related metabolic signature that differentiates obese and lean humans and contributes to insulin resistance[J].Cell Metab,2009,9(4):311-326.
[12]ZENG T S,LIU F M,ZHOU J,et al.Depletion of kupffer cells attenuates systemic insulin resistance,inflammation and improves liver autophagy in high-fat diet fed mice[J].Endocr J,2015,62(7): 615-626.
[13]王軍英,王紅梅.非酒精性脂肪肝患者血清TNF-α、IL-6水平及意義[J].中國現(xiàn)代醫(yī)學(xué)雜志,2013,23(33):42-46.
[14]BISWAS SK,CHITTEZHATH M,SHALOVA I N,et al.Macrophage polarization and plasticity in health and disease[J].Immunol Res,2012,53(1/2/3):11-24.
[15]黃海琇.非酒精性脂肪性肝病中Kupffer細(xì)胞激活方式的研究[D].杭州:浙江大學(xué),2013.
(申海菊編輯)
中圖分類號:R 589.2
文獻(xiàn)標(biāo)識碼:A
DOI:10.3969/j.issn.1005-8982.2016.13.005
文章編號:1005-8982(2016)13-0022-06
收稿日期:2015-12-11
*基金項目:四川省衛(wèi)生廳科研基金(No:120330)
Ketogenic essential amino acid replacement diet ameliorates nonalcoholic fatty liver disease in high-fat diet mice*
Ling Xu1,Hong-yan Ma1,Bin Xiao2,Chen-lin Gao1
(1.Department of Endocrinology,the Affiliated Hospital of Luzhou Medical College,Luzhou,Sichuan 646000,China;2.Department of Biochemistry,College of Basic Medical Sciences,Sichuan Medical University,Luzhou,Sichuan 646000,China)
Abstract:Objective To reveal the effects of ketogenic amino acid(KAA)replacement diet in the high-fat diet-induced nonalcoholic fatty liver disease in mice.Methods C57BL male mice were randomly fed with a conventional diet(NC group),high-fat diet(HFD group)or KAA-fortified HFD(HFDKAAR group);and 8 weeks after HFD initiation,the HFD-fed mice were randomly divided into two groups:one group of mice was fed the same HFD,the other group was fed HFDKAAR(HFD→HFDKAAR).The metabolic status and biochemical evaluations were performed 16 weeks after the initiation of experimental food.Blood glucose was measured by intraperitoneal glucose tolerance test.Insulin levels in plasma were measured using ELISA,the insulin resistance index(IRI)and area under curve(AUC)were calculated.The mesenteric and epididymal fat tissues and liver were weighed.Frozen liver sections were used for evaluation of hepatic steatosis and accumulation of Kupffer cells labeled by f4/80 via Oil Red O staining and immunofluorescence method respectively.The expressions ofTNF-α andIL-1βmRNA were measured by real-time qPCR.Results All the mice ate almost similar calories.Compared to the NC group,the HFD-fed mice displayed significantly heavier body weight and intra-abdominal fat weight,severer hepatic steatosis,deterioration of glucose tolerance,and significantly-enhanced macrophage accumulation in liver;interestingly,these changes were reversed after rich-KAA diet administration.Furthermore,real-time qPCR showed hepaticTNF-α andIL-1β mRNA expressions were up-regulated in the HFD fed mice(P<0.05),these changes were dramatically ameliorated by taking rich-KAA diet(P<0.05).Conclusions Our data demonstrate that rich-KAA diet could significantly ameliorate HFD-induced hepatic steatosis,obesity and glucose intolerance via normalizing the macrophage accumulation.KAA replacement diet could be a potential nutritional intervention for treatment in patients with metabolic defects.
Keywords:amino acid;non-alcoholic fatty liver disease;metabolic syndrome

