糖原合成酶激酶3β介導心房鈉尿肽對H9c2心肌細胞線粒體保護作用的研究*
洪蘭,洪英姬,金紅花
(1.延邊大學醫(yī)學院 生理學與病理生理學教研部,吉林 延吉 133002;2.延邊大學附屬醫(yī)院 藥學部,吉林 延吉 133000)
?
論著
糖原合成酶激酶3β介導心房鈉尿肽對H9c2心肌細胞線粒體保護作用的研究*
洪蘭1,洪英姬1,金紅花2
(1.延邊大學醫(yī)學院 生理學與病理生理學教研部,吉林 延吉 133002;2.延邊大學附屬醫(yī)院 藥學部,吉林 延吉 133000)
摘要:目的探討心房鈉尿肽(ANP)對H9c2心肌細胞缺血再灌注損傷的保護作用機制。方法采用四甲基羅丹明乙酯(TMR E)熒光染料和激光共聚焦顯微鏡成像技術測定H9c2心肌細胞TMR E熒光強度的變化,即線粒體膜通透性轉換孔(mPTP)開放程度。利用雙氧水H2O2誘導H9c2心肌細胞線粒體mPTP的開放,預處理不同濃度的ANP后,觀察ANP對mPTP開放的影響;同時利用Western blot檢測H9c2心肌細胞的糖原合成酶激酶3β(GSK-3β Ser9)磷酸化程度,即失活程度。利用激活型GSK-3β質粒轉染的H9c2心肌細胞(GSK-3β-S9A-HA),來觀察ANP對GSK-3β-S9A-HA的線粒體mPTP開放程度。結果與對照組(600μmol/L H2O2)比較,0.01、0.10、1.00和10.00nmol/L ANP明顯抑制H2O2對TMR E熒光強度的衰減效應(P<0.05),其中1.00 nmol/L的ANP效應最強。Western blot檢測結果顯示,0.01、0.10、1.00和10.00 nmol/L ANP明顯增強GSK-3β Ser9的磷酸化(P<0.05),即抑制GSK-3β的活性。利用GSK-3β-S9A-HA后發(fā)現(xiàn),ANP(1.0nmol/L)不能抑制mPTP開放(與H9c2比較P<0.05)。結論ANP通過調節(jié)GSK-3β活性來抑制H9c2心肌細胞mPTP的開放,從而保護H9c2心肌細胞的缺血再灌注損傷。
關鍵詞:心房鈉尿肽;缺血再灌注;線粒體膜通透性轉移孔;糖原合成酶激酶3β
心房鈉尿肽(atrial natriuretic peptide,ANP)是由心房肌細胞合成和分泌的肽類激素。ANP對缺血再灌注損傷具有較好的保護作用。在大鼠離體心臟灌流模型中,ANP可以增加再灌注心臟的心輸出量,減少缺血再灌注心臟的心梗面積,對急性心肌梗死患者靜脈注射ANP能減輕缺血再灌注造成的心臟損傷[1],但ANP發(fā)揮心肌保護作用的具體機制尚未清楚。線粒體膜通透性轉換孔(mitochondrial permeability transition pore,mPTP)的開放是導致缺血再灌注損傷的關鍵因素[2],防止mPTP的開放是減輕再灌注損傷的有效手段,抑制mPTP的開放是一些心臟保護類藥物,如腺苷,抗缺血再灌注損傷的共同作用機制。糖原合成酶激酶3β(glycogen synthase 3β,GSK-3β)是真核生物中普遍存在的一種多功能絲氨酸/蘇氨酸蛋白激酶,靜息時GSK-3β保持激活狀態(tài)。GSK-3β的絲氨酸(Serine,Ser9)位點磷酸化使GSK-3β活性降低。研究發(fā)現(xiàn),抑制GSK-3β的活性可以有效抑制mPTP的開放[3]。但是,ANP保護缺血再灌注損傷機制與GSK-3β活性和mPTP的開放是否有關,尚不清楚。本研究采用激光共聚焦顯微成像技術和Western blot檢測,觀察ANP是否通過降低GSK-3β的活性而抑制mPTP的開放,起到抵制缺血再灌注損傷的作用,擬探討ANP的心肌保護作用機制。
1 材料與方法
1.1實驗試劑及儀器
大鼠胚胎心臟組織來源的H9c2細胞株(美國ATCC菌種收藏中心),ANP、細胞培養(yǎng)所用的達爾伯克必需基本培養(yǎng)基、胎牛血清、0.25%胰蛋白酶等(美國Gibco公司),GSK-3β-S9A-HA(美國賓夕法尼亞大學醫(yī)學院),四甲基羅丹明乙酯(tetramethylrhodamine ethylester,TMRE)熒光染料(美國Invitrogen公司),Western blot檢測凝膠試劑盒(北京索萊寶 公 司),抗 磷酸化的 GSK-3α/β(Phospho-GSK-3α/β,Ser21-GSK-3α/Ser9-GSK-3β)抗體以及α-actin抗體(美國Cell Signaling Technology公司)。
實驗中主要儀器有FV-1000激光共聚焦顯微鏡(日本Olmpus公司),JY200C電泳系統(tǒng)(北京君意東方電泳設備有限公司),680型酶標儀(美國Bio-Red公司),ChampGel 6000凝膠成像分析系統(tǒng)(北京賽智創(chuàng)業(yè)科技有限公司),5430R臺式低溫離心機(德國Eppendorf公司)。
1.2線粒體膜電位的測定及實驗分組
TMRE熒光探針是一種帶正電荷、可透過細胞膜的無毒性熒光染料,其激發(fā)光波長為543 nm,發(fā)射波長為560 nm。在正常生理條件下,線粒體膜電位(mitochondrial membrane potential,MMP)保持內負外正的狀態(tài)。由于該電壓差使正電的TMRE可迅速地進入并聚集在線粒體內。mPTP的開放使得氫離子等進入細胞,造成MMP消失,MMP降低是mPTP開放的象征,從而導致TMRE從線粒體釋放。所以線粒體內TMRE熒光強度變化能較為準確地顯示MMP的高低和mPTP的開放。故利用激光共聚焦顯微鏡成像技術檢測線粒體內TMRE熒光強度值的變化值,可推測線粒體膜電位的變化,從而可以測定線粒體mPTP的開放。本實驗利用雙氧水H2O2誘導H9c2的缺血再灌注損傷,TMRE熒光強度減少至<50%基礎值則認為誘導缺血再灌注損傷成功。
H9c2分成7組,用H2O2(終濃度600μmol/L)在37℃孵育箱內孵育20 min,誘導H9c2氧化應激損傷。H9c2分成兩組,對照組:H2O20min+H2O220min;ANP組:ANP(終濃度 0.001、0.010、0.100、1.000、10.000和100.000nmol/L)20min+H2O220min。各組以每10 min間隔掃描圖片,并用定量分析軟件測定熒光強度值。
1.3GSK-3β質粒DNA的轉染及實驗分組
GSK-3β質粒(GSK-3β-S9A-HA)采用Fugene6轉染試劑盒進行轉染,所有實驗在轉染48 h內進行[5]。對照組:H2O 20min+H2O2(終濃度600μmol/L)20 min;ANP組:ANP(終濃度1 nmol/L)20 min+H2O220min;S9A組:轉染激活型GSK-3β質粒的H9c2細胞+H2O 20 min+H2O2(終濃度600μmol/L)20 min;S9A/ANP組:轉染激活型GSK-3β質粒的H9c2細胞+ANP(終濃度1 nmol/L)20 min+H2O220 min。各組以每10 min間隔掃描圖片,并用定量分析軟件測定熒光強度值。
1.4Western blot檢測GSK-3β磷酸化水平
采用終濃度為0.001、0.010、0.100、1.000、10.000 和100.000 nmol/L ANP預處理H9c2細胞20 min,常規(guī)Western blot檢測GSK-3β Ser9位點的磷酸化,從而觀察GSK-3β的活性。其最終數(shù)據(jù)表示為(目的蛋白/內參蛋白)/(對照組蛋白/對照組內參蛋白)×100%。
1.5統(tǒng)計學方法
采用Prism 3.0統(tǒng)計軟件進行數(shù)據(jù)處理,計量資料以均數(shù)±標準差(±s)表示,多組間均數(shù)比較用單因素方差分析(one-way ANOVA)和LSD-t檢驗,P<0.05為差異有統(tǒng)計學意義。
2 結果
2.1ANP對線粒體mPTP開放的影響
對照組利用600μmol/L H2O2處理H9c2細胞20 min后,TMRE熒光強度明顯減少至基礎值的(36.75±3.87)%,即H2O2可以明顯誘導缺血再灌注損傷。不同濃度的ANP預處理H9c2心肌細胞20min后發(fā)現(xiàn),0.01、0.10、1.00和10.00nmol/L ANP均抑制H2O2減少TMRE熒光強度的效應(P<0.05),而濃度0.001nmol/L和最高濃度100.000nmol/L ANP未能抵制H2O2對MMP的衰減作用。ANP防止mPTP開放的有效濃度范圍為0.01~10.00 nmol/L。見表1和圖1。
表1 不同濃度的ANP對TMRE熒光強度的影響(n=6±s)
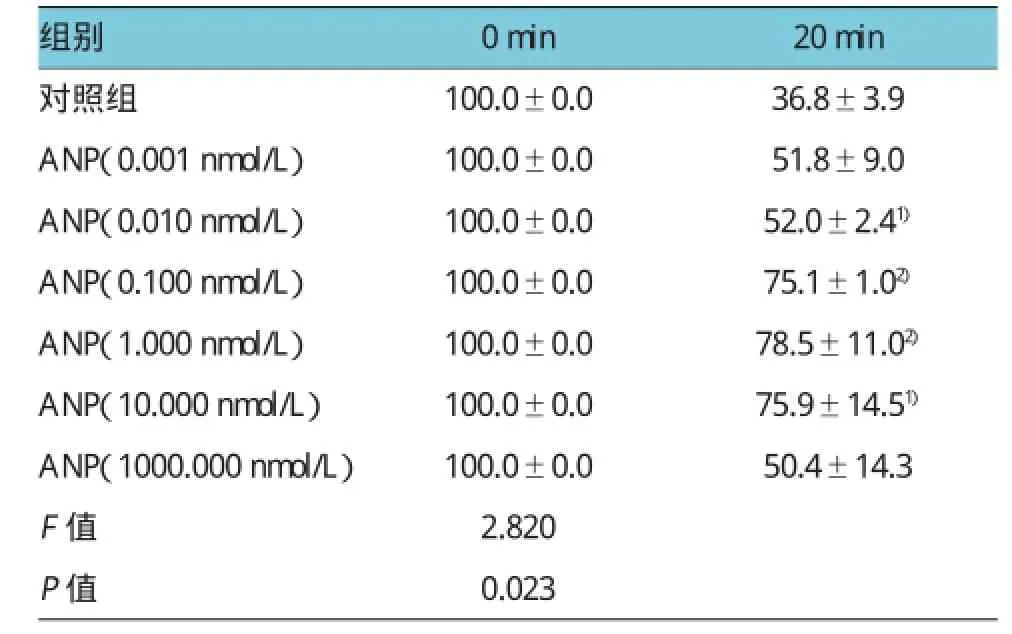
表1 不同濃度的ANP對TMRE熒光強度的影響(n=6±s)
注:1)與對照組比較,P<0.05;2)與對照組比較,P<0.01 ANP(/nmol/L)
20min對照組 100.0±0.0 36.8±3.9 ANP(0.001nmol/L) 100.0±0.0 51.8±9.0 ANP(0.010nmol/L) 100.0±0.0 52.0±2.41)ANP(0.100nmol/L) 100.0±0.0 75.1±1.02)ANP(1.000nmol/L) 100.0±0.0 78.5±11.02)ANP(10.000nmol/L) 100.0±0.0 75.9±14.51)ANP(1000.000nmol/L) 100.0±0.0 50.4±14.3 F值P值組別0min 2.820 0.023
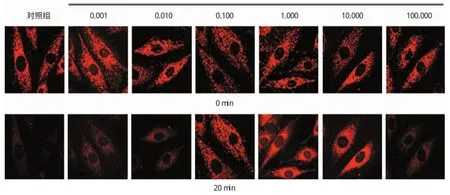
圖1 不同濃度ANP預處理后各組TMRE熒光強度比較 (×120)
2.2ANP對GSK-3β活性的影響
0.01~100.00nmol/L ANP均明顯增加GSK-3β Ser9的磷酸化水平,即可以明顯抑制GSK-3β的活性,其中1.0 nmol/L ANP效果最明顯,只有最低濃度ANP(0.001 nmol/L)對GSK-3β磷酸化沒有影響。該有效濃度范圍與ANP對mPTP抑制作用的有效濃度范圍基本一致。見圖2和表2。
2.3ANP對轉染GSK-3β質粒的H9c2細胞mPTP開放的影響
對照組、ANP組、S9A組、S9A/ANP組經(jīng)20 min H2O2處理后,各組TMRE熒光強度分別減少至基礎值的(36.75±3.87)%、(78.47±11.00)%、(35.32± 5.49)%和(39.95±4.51)%,差異有統(tǒng)計學意義(F= 8.830,P=0.000),ANP組TMRE熒光強度高于對照組、S9A組及S9A/ANP組(t=3.576、3.520和3.247,P=0.003、0.003和0.006)。而S9AANP組的TMRE熒光強度與S9A對照組比較,差異無統(tǒng)計學意義(P> 0.05)。見圖3。

圖2 不同濃度ANP對GSK-3β磷酸化的影響
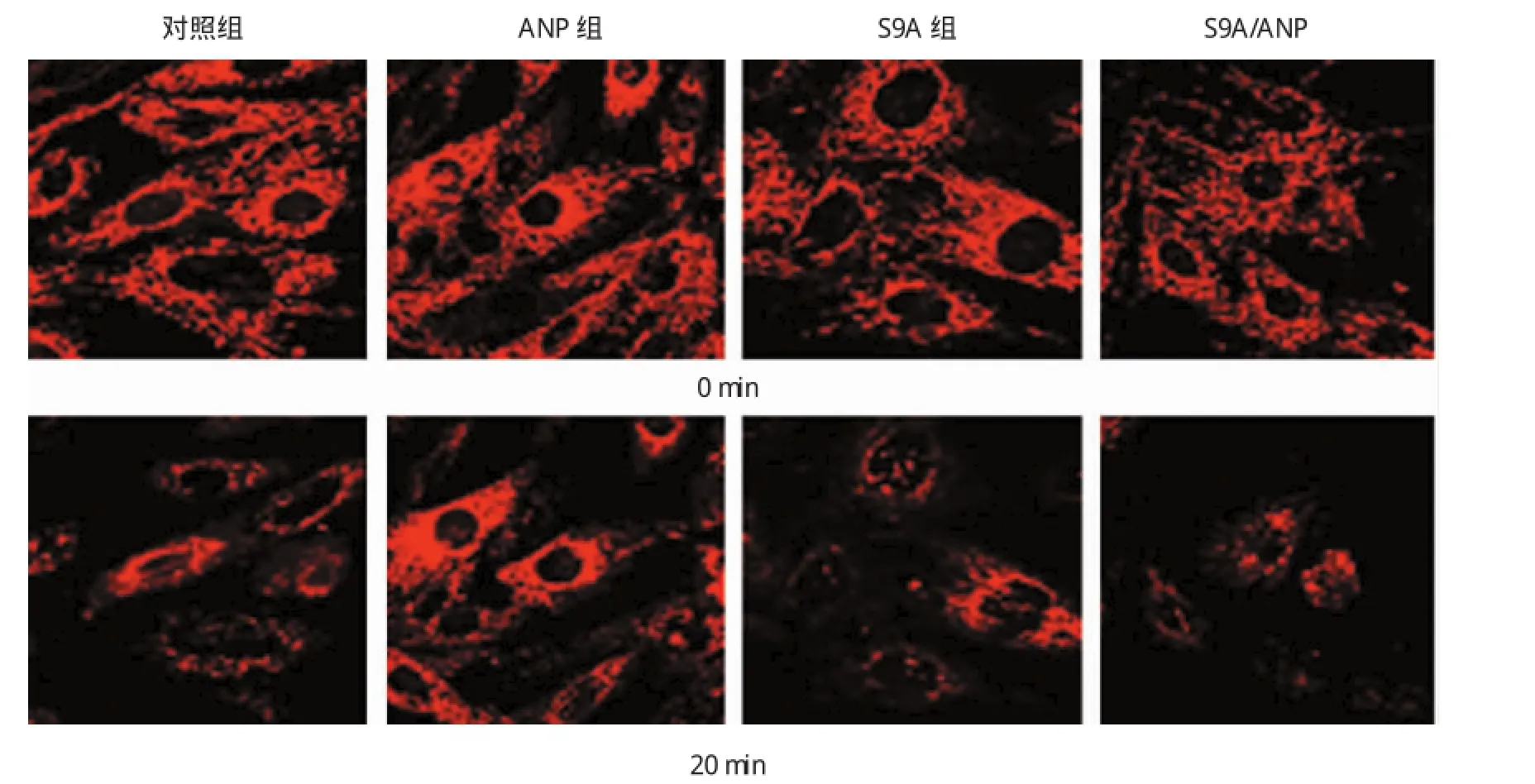
圖3 各組TMRE熒光強度比較 (×120)
表2 ANP對GSK-3β磷酸化的影響 (n=6±s)
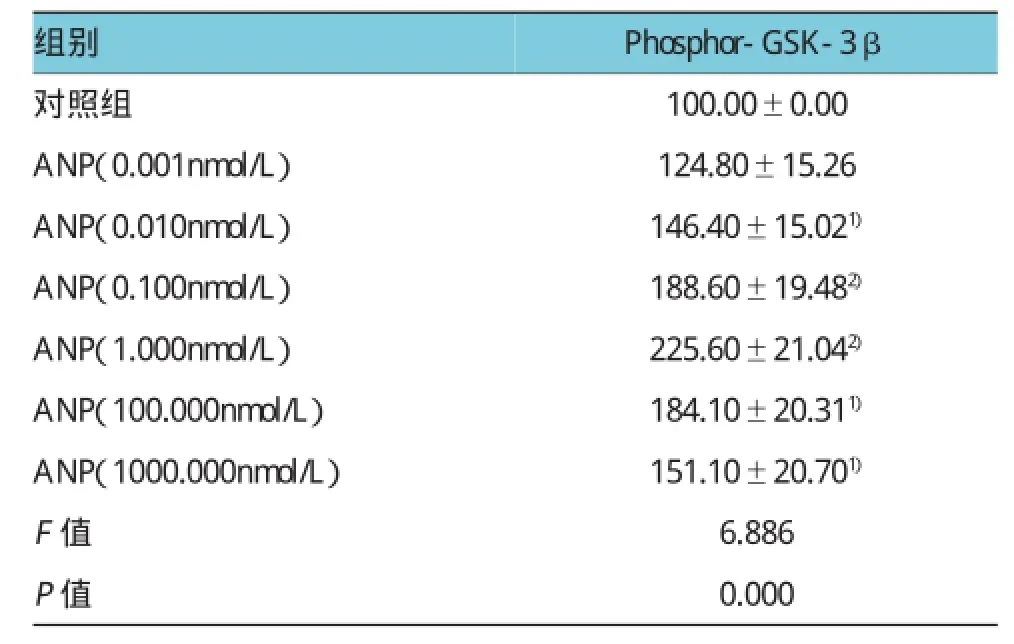
表2 ANP對GSK-3β磷酸化的影響 (n=6±s)
注:1)與對照組比較,P<0.05;2)與對照組比較,P=0.000
Phosphor-GSK-3β對照組 100.00±0.00 ANP(0.001nmol/L) 124.80±15.26 ANP(0.010nmol/L) 146.40±15.021)ANP(0.100nmol/L) 188.60±19.482)ANP(1.000nmol/L) 225.60±21.042)ANP(100.000nmol/L) 184.10±20.311)ANP(1000.000nmol/L) 151.10±20.701)F值P值組別6.886 0.000
3 討論
心肌缺血再灌注損傷是治療缺血性心臟病過程中面臨的最棘手的醫(yī)學問題[6]。雖然介入和搭橋手術等目前先進的醫(yī)療手段能夠改善缺血帶來的損傷,但由于冠狀動脈再通后容易引起再灌注損傷,急性心肌梗死的治療難度和死亡率依然很高。目前動物實驗顯示,再灌注期給予幾種藥物,如腺苷,可以改善缺血再灌注損傷,但臨床試驗結果均不理想[7],究其原因是還未完全了解保護再灌注損傷的作用機制[8]。研究認為,心肌缺血再灌注時,mPTP持續(xù)性開放是導致再灌注損傷的重要原因[2],因此抑制mPTP的開放是防止再灌注損傷的關鍵。有研究發(fā)現(xiàn),預先反復短暫缺血(缺血預處理)可以提高心肌組織對隨后持續(xù)缺血的耐受性,減少心肌梗死面積,減少心律失常發(fā)生,而缺血預處理保護心肌細胞的作用機制就是通過抑制mPTP的開放而減輕再灌注損傷[9]。
ANP最早發(fā)現(xiàn)的生物學作用是排鈉利尿,而近年來的研究證實,ANP在許多缺血缺氧相關性疾病如急性心肌梗死、充血性心力衰竭、慢性阻塞性肺疾病中保持高分泌狀態(tài),并且在該類疾病中分泌的ANP可以發(fā)揮抵制心肌肥大[10]、氧化應激[11]、保護缺血再灌注損傷等作用[12]。在本研究中,0.01、0.10、1.00、10.00 nmol/L ANP可以明顯抑制H2O2誘導的H9c2細胞mPTP開放,提示ANP可能通過抑制線粒體mPTP的開放,抵制氧化應激傷的損傷,進而保護缺血再灌注的心臟。本實驗室長期對大鼠ANP濃度測定結果顯示,大鼠心房灌流液的ANP濃度一般在50~300 pg/ml,而本實驗所用的ANP濃度已經(jīng)超出大鼠灌流液當中的ANP生理濃度。本實驗室前期研究還顯示,大鼠心房缺氧時ANP濃度明顯升高,并且升高至常氧時的5~10倍。故根據(jù)本實驗的結果推測,缺氧缺血時增高的ANP可能起到抵制缺氧缺血等的生理學作用,從而保護缺氧缺血的心臟。
防止mPTP開放可以有效抵制心肌缺血再灌注損傷。而在抑制mPTP開放的具體信號機制中,目前普遍認為GSK-3β發(fā)揮重要的作用。研究發(fā)現(xiàn),缺血預處理能夠增加GSK-3β的磷酸化,而抑制GSK-3β的活性能模擬缺血預處理的心肌保護作用[13],提示GSK-3β在心肌保護機制中發(fā)揮重要作用。JUHASZOVA等[14]認為,抑制GSK-3β的活性對阻止mPTP的開放可能發(fā)揮重要作用。在心肌細胞中,一些心臟保護類物質如腺苷[3]、酒精[15]和外源性鋅[16]均通過抑制GSK-3β的活性而阻止mPTP的開放。本實驗結果表明,ANP能夠增加GSK-3βSer9的磷酸化,表明ANP能明顯抑制GSK-3β的活性,并且有效濃度和最高效應濃度與ANP抑制mPTP開放的濃度值相吻合。進一步的實驗表明,利用GSK-3β質粒轉染的H9c2細胞(GSK-3β-S9A)觀察發(fā)現(xiàn),ANP未能抵制H2O2誘導GSK-3β-S9A的mPTP開放效應,說明ANP通過抑制GSK-3β的活性,從而抵制線粒體mPTP開放。綜上所述,ANP具有保護缺血再灌注損傷作用,其作用機制是通過抑制增加GSK-3β的磷酸化而抑制GSK-3β的活性,從而防止mPTP開放,最終起到心肌保護作用。
參考文獻:
[1]玄春花,李彥生,關立克.ANP的心臟保護作用研究[J].中國實驗診斷學,2014,18(1):156-159.
[2]MORCIANO G,GIORGI C,BONORA M,et al.Molecular identity of the mitochondrial permeability transition pore and its role in ischemia-reperfusion injury[J].J Mol Cell Cardiol,2015,78: 142-153.
[3]XI J,TIAN W,ZHANG L,et al.Morphine prevents the mitochondrial permeability transition pore opening through NO/cGMP/ PKG/Zn2+/GSK-3β signal pathway in cardiomyocytes[J].Am J Physiol Heart Circ Physiol,2010,298(2):H601-H607.
[4]JANG,Y,WANG H,XI J,et al.NO mobilizes intracellular Zn2p via cGMP/PKG signaling pathway and prevents mitochondrial oxidant damage in cardiomyocytes[J].Cardiovasc Res,2007, 75(2):426-433.
[5]CHANOIT G,LEE S,XI J,et al.Exogenous zinc protects cardiac cells from reperfusion injury by targeting mitochondrial permeability transition pore through inactivation of glycogen synthasekinase-3b[J].Am J Physiol,2008,295:H1227-H1233.
[6]李建輝.異丙酚聯(lián)合貝那普利預處理對大鼠心肌缺血再灌注損傷的保護作用[J].中國現(xiàn)代醫(yī)學雜志,2014,(8):12-16.
[7]OVIZE M,BAXTER G F,DI LISA F,et al.Postconditioning and protection from reperfusion injury:where do we stand?Position paper from the working group of cellular biology of the heart of the european society of cardiology[J].Cardiovasc Res, 2010,87:406-423.
[8]SCHWARTZ LONGACRE L,KLONER R A,ARAI A E,et al. New horizons in cardioprotection:recommendations from the 2010 national heart,lung,and blood institute workshop[J].Circulation, 2011,124(10):1172-1179.
[9]HAUSENLOY D J,ONG S B,YELLON D M.The mitochondrial permeability transition pore as a target for preconditioning and postconditioning[J].Basic Res Cardiol,2009,104:189-202.
[10]HAYASHI D,KUDOH S,SHIOJIMA I,et al.Atrial natriuretic peptide inhibits cardiomyocyte hypertrophy through mitogen-activated protein kinase phosphatase-1[J].Biochemical Biophysical Research Communications,2004,322(1):310-319.
[11]LASKOWSKI A,WOODMAN OL,CAO A H,et al.Antioxidant actions contribute to the antihypertrophic effects of atrial natriuretic peptide in neonatal rat cardiomyocytes[J].Cardiovascular Research,2006,72(1):112-123.
[12]PHILIPP S,YANG X M,CUI L,et al.Postconditioning protects rabbit hearts through a protein kinase C-adenosineA2b receptor cascade[J].Cardiovasc Res,2006,70(2):308-314.
[13]CHEN Q Q,GU E W,RU X F,et al.Suberoylanilide hydroxamic acid in the attenuation of cardioprotective effect by sufentanil postconditioning in type 2 diabetes mellitus rats[J].Acta Universitatis Medicinalis Anhui,2014,(9):1279-1283.
[14]JUHASZOVAM,ZOROVD B,YANIVY,et al.Role of Glycogen Synthase Kinase-3{beta}in Cardioprotection[J].Circ Res,2009,(104):1240-1252.
[15]ZHOU K,ZHANG L,XI J,et al.Ethanol prevents oxidant-induced mitochondrial permeability transition pore opening in cardiac cells[J].Alcohol Alcohol,2009,(44):20-24.
[16]CHANOIT G,LEE S,XI J,et al.Exogenous zinc protects cardiac cells from reperfusion injury by targeting mitochondrial permeability transition pore through inactivation of glycogen synthase kinase-3 beta[J].Am J Physiol Heart Circ Physiol,2008, 295(3):H1227-H1233.
(童穎丹編輯)
中圖分類號:R 542.2
文獻標識碼:A
DOI:10.3969/j.issn.1005-8982.2016.13.002
文章編號:1005-8982(2016)13-0007-05
收稿日期:2015-12-21
*基金項目:國家自然科學基金(No:81260035);吉林省衛(wèi)生廳科研課題基金(No:2013300-612013111)
[通信作者]金紅花,E-mail:kimflower1988@163.com;Tel:0433-2660788
Protective mechanism of ANP on mitochondria of H9c2 myocardial cells via GSK-3β*
Lan Hong1,Ying-ji Hong1,Hong-hua Jin2
(1.Department of Physiology and Pathophysiology,Medical College of Yanbian University,Yanbian,Jilin 133002,China;2.Department of Pharmacy,the Affiliated Hospital of Yanbian University,Yanbian,Jilin 133000,China)
Abstract:Objective To investigate protective mechanism of atrial natriuretic peptide(ANP)on H9c2 myocardial cell mitochondria via glycogen synthase kinase 3β(GSK-3β).Methods The change of mitochondrial membrane potential was determined using fluorescent dye tetramethylrhodamine ester(TMRE)and laser confocal microscopy imaging technique.The open degree of mitochondrial permeability transition pore(mPTP)was reflected as TMRE fluorescence intensity and the GSK-3β Ser9 phosphorylation(deactivation degree)was detected by Western blot.Then the protective effect of ANP on H9c2 cells transfected with activated GSK-3β plasmid (GSK-3β-S9A-HA)was observed.Results Compared to the control group(600 μmol/L H2O2),0.01,0.10,1.00 and 10.00 nmol/L ANP significantly inhibited attenuation effect of TMRE fluorescence intensity induced by H2O2(P <0.05);of which 1.00 nmol/L ANP had the strongest effect.It suggested that ANP may modulate the mPTP opening.Western blot result showed that 0.01,0.10,1.00,10.00 and 100.00 nmol/L ANP significantlyincreased the level of phosphorylation of GSK-3β(P<0.05);which indicated that ANP could inhibit the activity of GSK-3β;however,1.00 nmol/L ANP was not able to inhibit mPTP opening in cells of GSK-3β-S9AHA.Conclusions ANP prevents the mPTP opening by inactivating GSK-3β so as to protect H9c2 myocardial cells during ischemia-reperfusion injury.
Keywords:atrial natriuretic peptide;ischemia-reperfusion injury;mitochondrial permeability transition pore;glycogen synthase kinase 3β

