改變碳輸入對亞熱帶人工林土壤微生物生物量和群落組成的影響
萬曉華,黃志群,*,何宗明,余再鵬,王民煌,劉瑞強,鄭璐嘉
1 福建師范大學地理科學學院, 福州 350007 2 濕潤亞熱帶山地生態國家重點實驗室培育基地, 福州 350007 3 福建農林大學林學院, 福州 350002
?
改變碳輸入對亞熱帶人工林土壤微生物生物量和群落組成的影響
萬曉華1,2,黃志群1,2,*,何宗明3,余再鵬1,2,王民煌1,2,劉瑞強1,2,鄭璐嘉1,2
1 福建師范大學地理科學學院, 福州350007 2 濕潤亞熱帶山地生態國家重點實驗室培育基地, 福州350007 3 福建農林大學林學院, 福州350002
摘要:通過在亞熱帶杉木(Cunninghamia lanceolata)和米老排(Mytilaria laosensis)人工林中設置互換凋落物、去除凋落物、去除凋落物+去除根系和對照處理來分析改變地上、地下碳輸入對人工林土壤微生物生物量和群落組成的影響。結果顯示,改變地上、地下碳輸入對土壤微生物生物量碳、氮的影響因樹種而異。在米老排林中,土壤微生物生物量不受碳源的限制。而在杉木林中,加入米老排凋落物、去除凋落物和去除凋落物+去除根系3種處理中土壤微生物生物量碳、氮具有明顯增加的趨勢。磷脂脂肪酸分析結果顯示,杉木林中,添加高質量的米老排凋落物后,革蘭氏陽性細菌、陰性細菌、叢枝菌根真菌、放線菌和真菌群落生物量分別顯著增加了24%、24%、53%、25%、28%,革蘭氏陰性細菌和叢枝菌根真菌的相對豐度均有顯著增加。與對照相比,杉木林中去除凋落物后革蘭氏陽性細菌、陰性細菌、叢枝菌根真菌、放線菌和真菌群落生物量分別顯著增加了22%、29%、44%、25%、52%,真菌與細菌比值顯著增加了21%。但是,去除凋落物+去除根系處理對兩個樹種人工林土壤微生物群落組成均無顯著影響。米老排和杉木林土壤微生物生物量碳、氮的季節變化格局不同,土壤養分有效性可能是驅動土壤微生物生物量季節變化的主要因子。未來研究需要關注凋落物和根系在不同樹種人工林中對土壤微生物群落的相對貢獻。
關鍵詞:去除凋落物;去除根系;土壤微生物生物量;微生物群落組成;樹種;亞熱帶人工林
土壤微生物作為分解者,在陸地生態系統養分循環中扮演著重要的角色。微生物生物量及其群落組成是影響土壤物理、化學和生物過程的重要因子[1]。許多研究表明,樹種影響土壤微生物群落組成,不同樹種下會形成獨特的微生物群落[2],尤其是針葉樹種和闊葉樹種之間土壤微生物群落差別較大[3- 4]。樹種主要通過郁閉度、根系深度、地上地下凋落物數量和質量以及改變土壤溫度和pH值等[5- 6]影響土壤微生物群落。凋落物作為土壤有機質地上部分的主要來源,其輸入的數量和質量變化也可能改變土壤碳的積累或流失狀況[7]。例如,Leff等[8]在一個熱帶雨林中通過設置不同凋落物輸入方式研究發現,添加雙倍凋落物后土壤表層的有機碳含量增加了31%,而去除凋落物使得土壤有機碳降低了26%;不同凋落物輸入方式引起的土壤有機碳量的變化與可溶性有機質、細根生物量和土壤微生物過程等有關。Garcia-Oliva等[9]研究發現,新鮮凋落物的淋濾物質及其分解產物中含有大量的易變性有機碳,能夠為土壤微生物活動提供大量碳源。Feng等[10]在我國亞熱帶季雨林中的實驗研究發現,去除地上部分凋落物2年后降低了19.0%的土壤微生物生物量碳。根系分泌物和根系周轉也會影響土壤中微生物的生物量和活性。Kramer等[11]通過14C同位素示蹤法研究發現,在溫帶森林中來源于根系輸入的碳是微生物主要的碳源(占60%以上)。Li等[12]在熱帶松樹人工林中的研究發現,去除根系處理7年后土壤微生物生物量下降了45.4%。也有研究發現,去除根系處理只是減少了森林有機層中的真菌生物量和細菌群落結構,而對礦質層中的微生物卻無顯著影響[13- 14]。然而,目前關于樹種是如何通過凋落物、根系特性來影響土壤微生物生物量和群落組成的研究仍較少。
植物殘體的添加和去除實驗(DetritusInputandRemovalTreatment,DIRT)是通過改變地上、地下碳輸入來研究植物和土壤微生物群落之間反饋作用的有效方法[15]。例如,Wang等[16]通過DIRT實驗研究了我國亞熱帶地區針葉樹種人工林(主要樹種為杉木和馬尾松)改變地上、地下碳輸入對土壤呼吸和微生物群落組成的影響。本研究以杉木林采伐跡地上營造的19年生米老排(Mytilaria laosensis)和杉木(Cunninghamia lanceolata)人工林為研究對象,通過設置互換凋落物、去除凋落物和去除凋落物+去除根系處理來分析碳輸入方式的改變對不同樹種人工林土壤微生物生物量和群落組成的影響,旨在為森林管理中如何提高人工林土壤肥力提供參考。
1材料與方法
試驗地位于福建省南平市峽陽林場(26°48′N,117°59′E),地處武夷山脈東南側、閩江上游,海拔高度為229—246m。該區屬中亞熱帶季風氣候,年均溫20.0 ℃,年均降水量1644mm,年均蒸發量1370mm,年均相對濕度75.2%。土壤為石英黑云母片巖發育的山地紅壤。本試驗地包括19年生米老排和杉木兩個樹種人工林,均為1993年春在杉木人工林采伐跡地上營造[17],初植密度均為2500 株/hm2。其中米老排為金縷梅科米老排屬的常綠大喬木,是分布在南亞熱帶地區的主要鄉土珍貴闊葉樹種之一[18]。2011年7月樣地本底調查時,米老排平均樹高15.4m,平均胸徑14.7cm;杉木平均樹高13.8m,平均胸徑15.9cm。兩個樹種人工林凋落物和土壤基本理化性質見表1。其中,年凋落物量根據凋落物框收集法估算得出,將收集的凋落物樣品在60 ℃下烘干至恒量,粉碎后過0.15mm篩,用元素分析儀(ElementalAnalyzerVarioELIII,德國)測定其碳、氮含量;土壤樣品采集深度為0—5cm[17],全碳、全氮含量用元素分析儀(ElementalELMAXCNSanalyzer,德國)測定;土壤pH值采用土水比為1∶2.5測定。
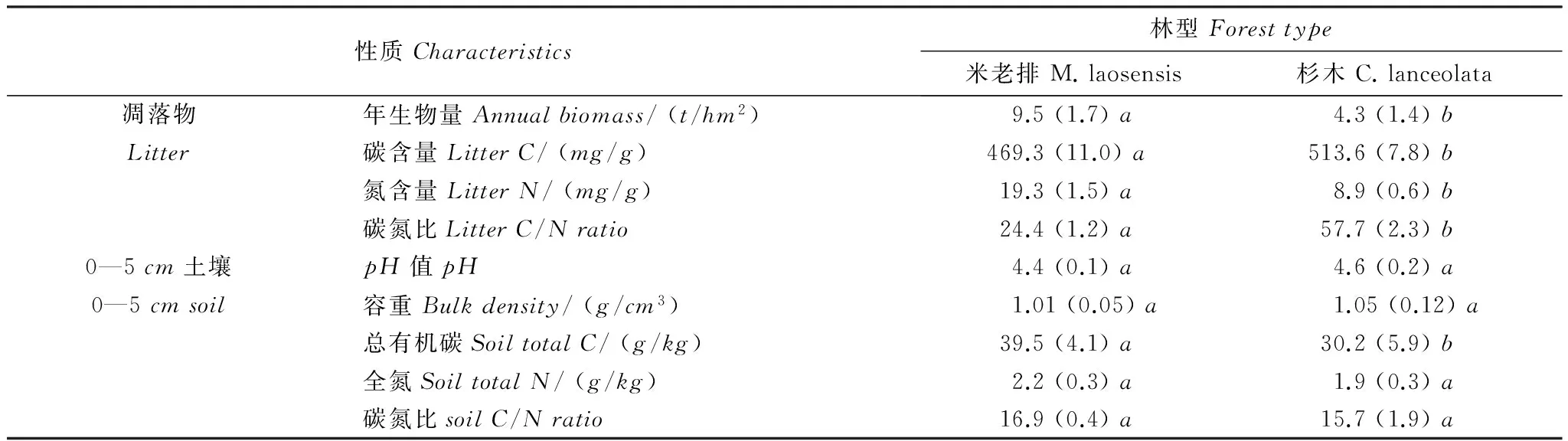
表1 米老排和杉木林的基本概況
括號中數據為標準差(n=4),同一行不同小寫字母表示兩個樹種之間差異顯著(P<0.05)
2012年1月,在米老排和杉木人工林采用完全隨機區組設計方法分別設置16個2m×2m的小區,在小區內做如下4種處理:(1)去除地上凋落物,在小區上方1m處放置孔徑為1mm的尼龍網,防止凋落物進入,同時把地表的凋落物全部去除;(2)凋落物互換,即將米老排和杉木林去除凋落物處理小區內尼龍網上截留的凋落物進行互換,原凋落物去除,每月定期交換一次;(3)去除凋落物+去除根系,去除凋落物并且挖壕溝排除小區內根系,壕溝深度為1m;(4)對照,保留原來狀態。
1.2土壤樣品采集與測定
從2012年1月開始至12月,每月定期在各小區內沿對角線等距離鉆取3個點,采集0—5cm土壤層樣品,去除砂石、可見根系后,在室內過2mm篩儲存于4 ℃冰箱中,用氯仿-熏蒸浸提法測定土壤微生物生物量碳(MBC)和氮(MBN)[19]。采集土壤樣品的同時,用數字式瞬時溫度計(AM- 11T,Avalon公司,美國)測定地下5cm處的土壤溫度(℃),采用時域反射儀(TDR)(ModelTDR300,Spectrum公司,美國)測定地下5cm處的土壤含水量(%)。
土壤微生物群落組成采用磷脂脂肪酸(PLFA)分析法,僅對2012年6月采集的土壤樣品進行了測定。磷脂脂肪酸的提取參考White等[20]方法,簡單操作步驟:稱取相當于8g干土重的鮮土,依次加入5mL磷酸緩沖液、6mL三氯甲烷、12mL甲醇,振蕩2h后離心(1000r/min,10min),轉移上層清液到分液漏斗中,向剩余土壤中再加入12mL三氯甲烷和12mL磷酸緩沖液,振蕩離心,轉移上層清液,合并兩次上清液,黑暗環境下靜置一夜;收集下層氯仿相,在氮氣下吹干,通過硅膠柱分離出磷脂,加甲醇∶甲苯(1∶1)和0.2mol/L氫氧化鉀溶液進行皂化和甲基化形成脂肪酸甲酯。每一個脂肪酸甲酯通過氣象色譜儀(Agilent6890N, 美國),根據它們的停留時間結合MIDI微生物識別系統(MIDIInc.,Newark,DE)來進行鑒定。順式異構和反式異構支鏈脂肪酸表征革蘭氏陽性細菌[21- 22];單一不飽和和環丙烷脂肪酸表征革蘭氏陰性細菌[23- 24];18∶1ω9c和18∶2ω6,9c脂肪酸表征真菌,16∶1ω5c表征叢枝菌根真菌[24];10Me16∶0、10Me17∶0、10Me18∶0表征放線菌(表2)。

表2 檢驗土壤微生物種群的脂肪酸標志物
1.3數據處理
所有數據處理和統計分析均基于Excel2003和SPSS17.0軟件進行。采用單因素方差分析(ANOVA)來確定處理對土壤微生物生物量和群落結構的影響,顯著水平設為α=0.05。采用重復測量的方差分析方法來確定樹種、取樣時間和處理對土壤微生物生物量月動態的影響。通過相關分析來確定土壤溫度、濕度與微生物生物量的相關性。
2結果與分析
2.1土壤微生物生物量碳氮及季節動態變化
2015年8月,程瀚還將150萬元交予王某某理財,約定期限為2015年9月1日至2017年9月1日,年利率24%。后來程瀚取走15萬元的利息。
通過方差分析發現,樹種和取樣時間對土壤MBC、MBN和MBC/MBN具有顯著影響,而處理對微生物生物量的影響未達到顯著水平(表3)。從年平均值來看,米老排林中,與對照相比,各處理小區土壤MBC、MBN無明顯變化。在杉木林中,雖然加入米老排凋落物、去除凋落物和去除凋落物+去除根系處理土壤MBC、MBN與對照之間的差異均未達到統計上的顯著水平(P>0.05),但3種處理中土壤MBC(17%、21%和20%)、MBN(17%、10%和17%)均有明顯增加的趨勢。
表3樹種、處理和取樣時間及其交互作用對土壤微生物生物量碳、氮及其比值影響的方差分析表
Table3Statisticalsummaryoftreespecies,treatments,samplingmonthandtheirinteractioneffectsonsoilmicrobialbiomassC(MBC)andN(MBN)andC/Nratios(MBC/MBN)
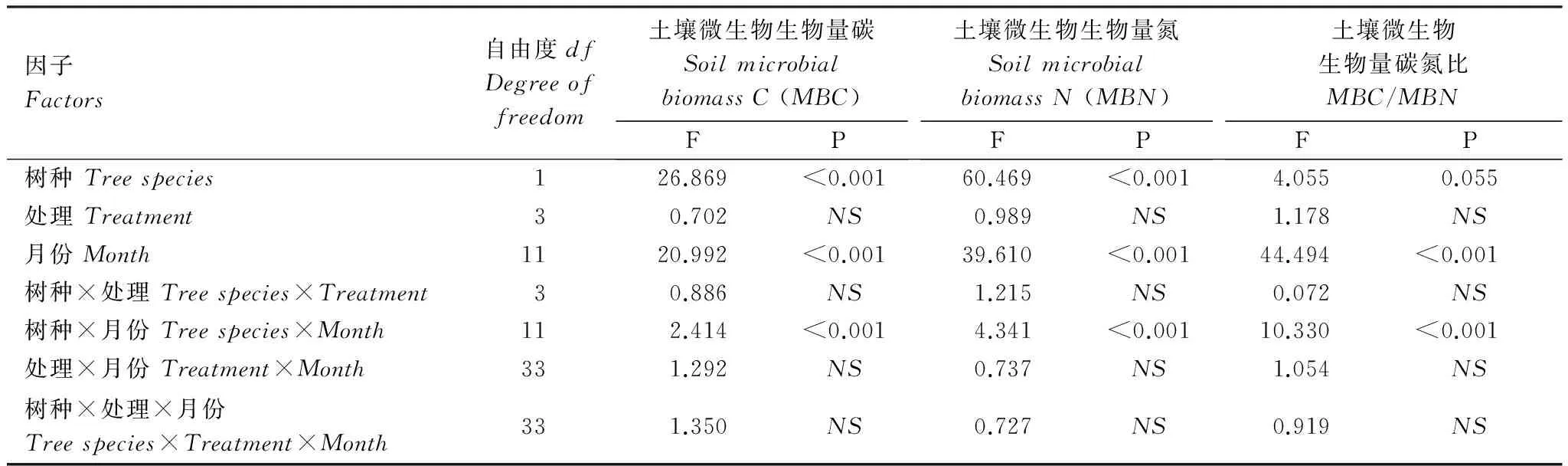
因子Factors自由度dfDegreeoffreedom土壤微生物生物量碳SoilmicrobialbiomassC(MBC)FP土壤微生物生物量氮SoilmicrobialbiomassN(MBN)FP土壤微生物生物量碳氮比MBC/MBNFP樹種Treespecies126.869<0.00160.469<0.0014.0550.055處理Treatment30.702NS0.989NS1.178NS月份Month1120.992<0.00139.610<0.00144.494<0.001樹種×處理Treespecies×Treatment30.886NS1.215NS0.072NS樹種×月份Treespecies×Month112.414<0.0014.341<0.00110.330<0.001處理×月份Treatment×Month331.292NS0.737NS1.054NS樹種×處理×月份Treespecies×Treatment×Month331.350NS0.727NS0.919NS
NS:notsignificant
從月動態來看,米老排林小區內土壤MBC變化范圍為394—990mg/kg,一年之內無明顯峰值,最低值出現在10月(圖1);土壤MBN從1—4月呈緩慢增加的趨勢,5—9月出現下降-上升-下降的趨勢,在11月出現一個峰值116mg/kg(圖1)。杉木林小區內,土壤MBC、MBN月動態變化基本一致,均呈現“M”型格局∶從1月開始,土壤微生物生物量呈現增加的趨勢,在4—9月出現下降-上升-下降的趨勢;9月之后,土壤微生物生物量又出現上升的趨勢,在11月達到1個峰值(圖1)。通過方差分析發現,樹種對土壤溫度和濕度具有顯著影響(P=0.00),而各處理之間土壤溫度和濕度無顯著差異(P>0.05)。相關分析顯示,米老排林各處理小區的土壤溫度、濕度與MBC、MBN之間均無顯著相關性;杉木林小區內,僅對照和去除凋落物+去除根系處理小區土壤溫度與MBN之間呈顯著負相關(P<0.05)。
2.2土壤微生物群落組成
從微生物群落的生物量來看,米老排林中,與對照相比,各處理中細菌、真菌和放線菌生物量均無顯著變化(表4)。而杉木林中,與對照相比,加入米老排凋落物處理中革蘭氏陽性細菌、陰性細菌、叢枝菌根真菌、放線菌和真菌生物量分別顯著增加了24%、24%、53%、25%、28%,而革蘭氏陽性細菌與陰性細菌比值、真菌與細菌比值均無顯著變化;去除凋落物處理中革蘭氏陽性細菌、陰性細菌、叢枝菌根真菌、放線菌和真菌生物量分別顯著增加了22%、29%、44%、25%、52%,革蘭氏陽性細菌與陰性細菌比值無顯著變化,而真菌與細菌比值顯著增加了21%;去除凋落物+去除根系處理中土壤各微生物種群生物量無顯著變化。
從微生物群落結構來看,米老排林中,與對照相比,加入杉木凋落物、去除凋落物、去除凋落物+去除根系處理對土壤微生物群落組成均無顯著影響。而在杉木林中,與對照相比,加入米老排凋落物處理中表征革蘭氏陰性細菌的cy17∶0、18∶1ω7c、18∶1ω5c脂肪酸以及表征叢枝菌根真菌的16∶1ω5c的相對豐度均有顯著增加(P<0.05),而去除凋落物、去除凋落物+去除根系處理對土壤微生物群落組成無顯著影響。
3討論
3.1不同樹種的凋落物和根系對土壤微生物生物量的影響
本研究結果顯示,杉木林中,加入高質量(低C/N)的米老排凋落物后土壤微生物生物量碳、氮均有明顯增加的趨勢,土壤中真菌、細菌和放線菌的生物量也顯著高于對照樣地。這與胡亞林等[25]、陳法霖等[26- 27]研究結果一致。一般來說,針葉樹種的凋落物中含有較多難以分解、疏水性芳香族化合物,而闊葉樹種的凋落物中含有較多易變、親水性低分子量化合物[28- 29]。因此,與針葉凋落物相比,闊葉凋落物的淋濾物質中含有較多的易變性有機碳(如可溶性有機碳等)組分,這些物質是土壤微生物的重要碳源[30- 31]。因此,在杉木林中,加入高質量的米老排凋落物后,為土壤微生物提供了更為有效的底物碳源。凋落物質量影響土壤微生物生物量和活性,而土壤微生物群落反過來也會影響凋落物分解速率。高質量的凋落物含有較多易被微生物降解的化學物質,而低質量的凋落物往往含有高抗性或有毒成分,不易被微生物所降解[32]。例如,Cleveland等[33]將生長在相同氣候條件下不同樹種的凋落物,在室內進行凋落物互換分解實驗研究發現,不同質量凋落物下細菌群落的差異影響凋落物分解。本研究結果表明,杉木林中添加高質量的米老排凋落物后,不僅增加了土壤微生物生物量,而且土壤微生物群落組成的改變,一定程度上也促進了凋落物的分解。
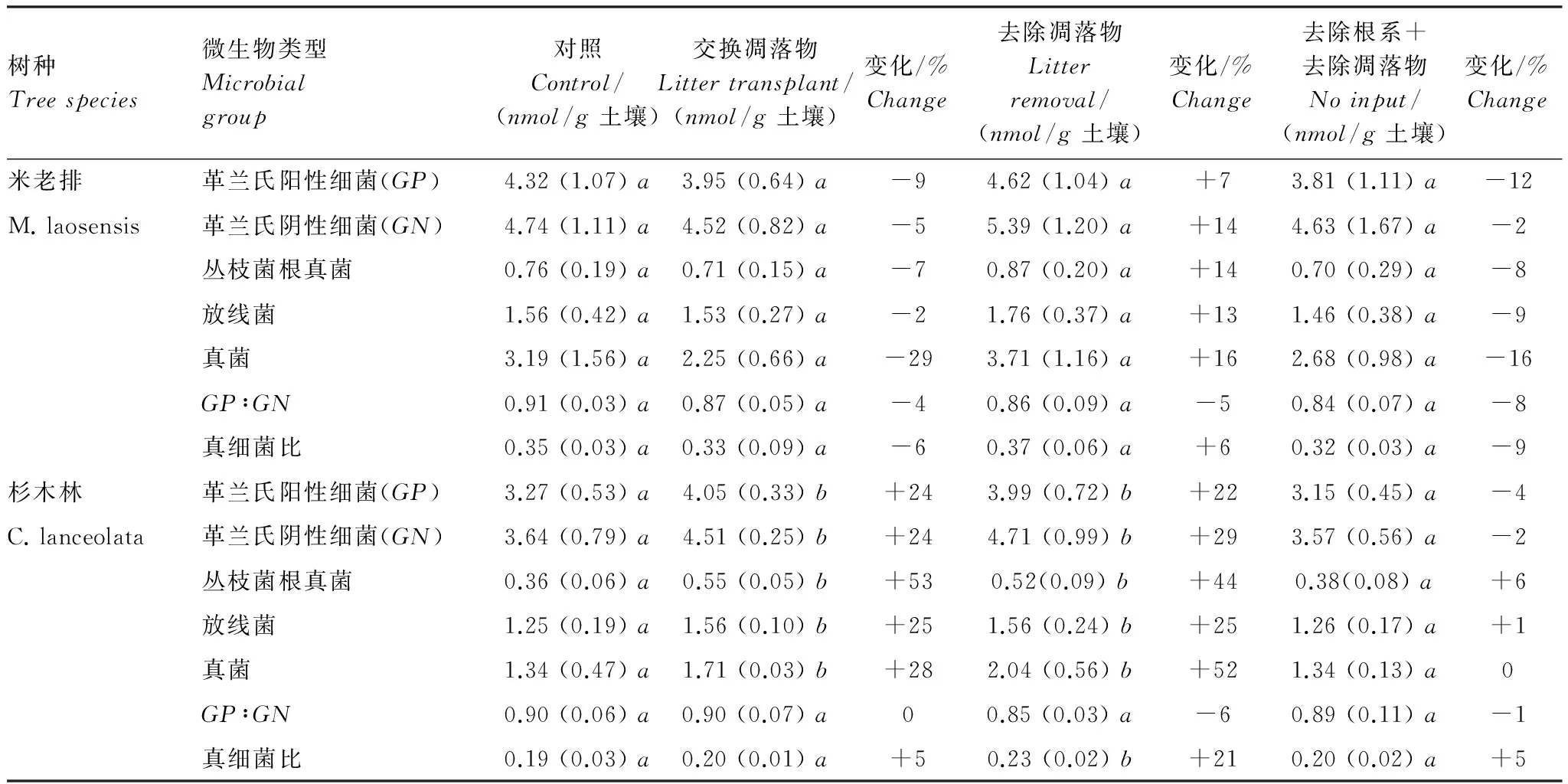
表4 米老排和杉木林中改變碳輸入方式對0—5 cm土壤層微生物群落生物量的影響
括號中數據為標準差(n=4),對于一個給定的PLFA,同一行小寫字母不同表示處理與對照之間具有顯著差異
研究發現,杉木林中,去除凋落物和去除凋落物+去除根系小區內的土壤微生物生物量與對照相比均有明顯增加的趨勢,這可能與杉木的針葉凋落物和根系性質有關。許多研究表明,杉木連栽導致土壤中化感物質(如酚醛物質等)增加,從而產生自毒作用[34- 35]。例如,陳龍池等[36]研究發現,杉木根系和凋落物分泌的香草醛等酚類化合物能夠抑制杉木生長、降低生產力。黃志群等[37]報道了,杉木根樁分解過程中釋放的酚類物質影響下一代杉木的生長。植物化感物質除了影響植物生長之外,還會影響土壤微生物生物量、群落結構和活性[38]。例如,Souto等[39]在歐洲云杉林(Picea abies (L.)Karst.)中研究發現,植物產生的酚類物質抑制土壤微生物的活性。王延平等[40]報道了楊樹(Populus euramericana)人工林中,酚酸濃度的增加,土壤中有效態氮的提取量顯著下降,脲酶和堿性磷酸酶活性顯著降低。因此,在杉木林小區內去除凋落物和根系后,土壤微生物生物量增加,可能與減少了杉木針葉分解過程中抑制微生物生長的毒性物質有關。而米老排林中,與對照相比,去除凋落物和去除凋落物+去除根系小區內土壤微生物生物量無明顯變化,這可能與礦質土壤中原有有機質含量有關。有研究表明,來源于地上部分的碳源減少后,土壤微生物會轉而利用土壤有機質中的易變性有機碳來維持自身生長[41]。在本實驗地的先前研究中發現,米老排林地土壤可溶性有機碳含量顯著高于杉木林(未發表數據)。因此,在一定時期內,米老排人工林中土壤微生物生物量不受地上、地下碳源的限制。本研究結果表明,不同樹種之間凋落物質量的差異,是影響土壤微生物生物量的主要因素。
3.2凋落物和根系對土壤微生物群落組成的影響
微生物可利用的碳源主要來自于地上凋落物及其淋濾物質、根系分泌物和土壤有機質[11, 42]。改變地上和地下碳輸入會影響土壤微生物群落組成[10, 16, 42]。例如,Brant等[43]通過長期的野外凋落物的添加和去除轉移實驗發現,溫帶森林中根系的碳輸入對土壤微生物群落的影響要遠大于地上部分凋落物的碳輸入。Wang等[16]在我國亞熱帶地區的研究也發現,杉木人工林中去除凋落物僅降低了細菌與真菌的生物量比值,去除根系則同時降低了革蘭氏陰性細菌與陽性細菌比值以及細菌與真菌比值。張偉東等[44]通過模擬實驗發現,與地上凋落物相比,杉木根系在土壤生態學過程中發揮著重要作用。與以上研究結果不同,本研究結果卻發現,來源于地上凋落物的碳輸入對土壤微生物群落的影響要顯著于地下根系。在本研究的杉木林小區內,添加高質量的米老排凋落物后,激發了土壤中革蘭氏陰性細菌和叢枝菌根真菌的生長。這個結果與Bastian等[45]和Potthast等[46]在實驗室的培養結果一致,即在農業土壤中添加高質量(低C/N)的凋落物會激發土壤中富含養分微生物群落的生長,例如革蘭氏陰性細菌。這是因為不同微生物群落種群對碳源的利用具有選擇性。在農業土壤中,革蘭氏陰性細菌會優先利用新鮮輸入的植物殘體作為碳源,而革蘭氏陽性細菌則主要利用土壤有機質中的碳源[47]。也有許多人提出假設,森林生態系統中地上部分凋落物的化學質量決定了土壤微生物的群落組成[48],因此,本研究結果在一定程度上驗證了這個假設。但是到底是哪些凋落物質量指標對土壤微生物群落有顯著影響;隨著處理時間的增加,來源于凋落物和根系的碳輸入對土壤微生物群落組成的影響是否會發生變化,這些問題還需要進一步通過長期的野外實驗數據來證明。
3.3不同樹種人工林土壤微生物生物量季節變化的調控因子
本研究中,米老排和杉木人工林不同處理樣地土壤微生物生物量碳、氮均具有明顯的季節變化模式,即在植物生長期間,土壤微生物生物量出現先上升后下降的趨勢,而在冬季,土壤微生物生物量仍回歸到一個較高的水平。這個結果與溫帶森林[49]、北亞熱帶濕潤森林[50]地區的研究結果一致。影響土壤微生物生物量季節變化的因子,主要有土壤溫度和濕度,有機質輸入的數量和質量以及土壤碳、氮動態等[10, 51- 52]。例如,Feng等[10]在亞熱帶季雨林中的研究發現,在有機層中,土壤微生物生物量碳的季節變化受土壤溫度或土壤濕度影響不顯著;而在礦質層中,則主要受土壤溫度和濕度的驅動。他們得出結論,來源于植物冠層的碳在土壤中的再分配以及原有的土壤有機質是決定礦質土壤中微生物生物量的季節變化的主要因子。本研究中,米老排和杉木林各處理小區內土壤微生物生物量碳、氮與土壤溫度和濕度之間無顯著相關性,各處理對土壤微生物生物量碳、氮無顯著影響。因此,土壤溫度和濕度以及新鮮輸入有機質的數量和質量不是調控人工林土壤微生物生物量季節變化的主要因子。土壤微生物生物量在很大程度上取決于土壤有機質的養分有效性。土壤微生物生物量減少,會引起土壤中養分的礦化;反之,則導致養分的固定[53]。例如,Chu等[54]在北極苔原景觀中研究發現,不同植被類型土壤的全碳、全氮,微生物生物量碳,可溶性有機碳、氮,礦質氮以及氮礦化潛力不同,氮礦化潛力與土壤中的有效態碳、氮呈正相關,與土壤C/N比值呈負相關。在本實驗地的先前研究中,也發現米老排和杉木林土壤的氮礦化速率和礦質氮含量與易變性有機碳、土壤C/N比值和微生物群落組成有關[19]。因此,我們推測本研究中不同樹種人工林之間土壤原有有機質的養分有效性是驅動土壤微生物生物量季節動態主要因子。
4結論
(1)凋落物和根系處理對土壤微生物生物量碳、氮的影響因樹種而異。杉木林中添加高質量的米老排凋落物、去除凋落物、去除凋落物+去除根系后土壤微生物生物量碳、氮具有明顯增加的趨勢,而米老排林土壤微生物生物量不受碳源的限制。
(2)杉木林中添加高質量的米老排凋落物后,土壤中細菌、真菌和放線菌生物量有顯著增加,且革蘭氏陰性細菌和叢枝菌根真菌的種群豐度也有顯著提高;地上部分凋落物輸入的碳對土壤微生物群落組成的影響較為顯著。
(3)米老排和杉木林土壤微生物生物量呈現明顯的季節變化格局,土壤中原有有機質的養分有效性可能是驅動土壤微生物生物量季節變化的主要因子。
致謝: 感謝福建省南平市峽陽國有林場對野外試驗樣地的維護以及對野外實驗開展的支持。
參考文獻(References):
[1]FraterrigoJM,BalserTC,TurnerMG.Microbialcommunityvariationanditsrelationshipwithnitrogenmineralizationinhistoricallyalteredforests.Ecology, 2006, 87(3): 570- 579.
[2]LejonDP,ChaussodR,RangerJ,RanjardL.Microbialcommunitystructureanddensityunderdifferenttreespeciesinanacidforestsoil(Morvan,France).MicrobialEcology, 2005, 50(4): 614- 625.
[3]UshioM,WagaiR,BalserTC,KitayamaK.Variationsinthesoilmicrobialcommunitycompositionofatropicalmontaneforestecosystem:doestreespeciesmatter?SoilBiologyandBiochemistry, 2008, 40(10): 2699- 2702.
[4]WeandMP,ArthurMA,LovettGM,McCulleyRL,WeathersKC.EffectsoftreespeciesandNadditionsonforestfloormicrobialcommunitiesandextracellularenzymeactivities.SoilBiologyandBiochemistry, 2010, 42(12): 2161- 2173.
[5]IovienoP,AlfaniA,B??thE.SoilmicrobialcommunitystructureandbiomassasaffectedbyPinus pineaplantationintwoMediterraneanareas.AppliedSoilEcology, 2010, 45(1): 56- 63.
[6]LynchHB,EppsKY,FukamiT,VitousekPM.Introducedcanopytreespecieseffectonthesoilmicrobialcommunityinamontanetropicalforest.PacificScience, 2012, 66(2): 141- 150.
[7]BooneRD,NadelhofferKJ,CanaryJD,KayeJP.Rootsexertastronginfluenceonthetemperaturesensitivityofsoilrespiration.Nature, 1998, 396(6711): 570- 572.
[8]LeffJW,WiederWR,TaylorPG,TownsendAR,NemergutDR,GrandyAS,ClevelandCC.Experimentallitterfallmanipulationdriveslargeandrapidchangesinsoilcarboncyclinginawettropicalforest.GlobalChangeBiology, 2012, 18(9): 2969- 2979.
[9]Garca-OlivaF,SveshtarovaB,OlivaM.SeasonaleffectsonsoilorganiccarbondynamicsinatropicaldeciduousforestecosysteminwesternMexico.JournalofTropicalEcology, 2003, 19(2): 179- 188.
[10]FengWT,ZouXM,SchaeferD.Above-andbelowgroundcarboninputsaffectseasonalvariationsofsoilmicrobialbiomassinasubtropicalmonsoonforestofsouthwestChina.SoilBiologyandBiochemistry, 2009, 41(5): 978- 983.
[11]KramerC,TrumboreS,Fr?bergM,CisnerosDozalLM,ZhangD,XuX,SantosGM,HansonPJ.Recent(< 4yearold)leaflitterisnotamajorsourceofmicrobialcarboninatemperateforestmineralsoil.SoilBiologyandBiochemistry, 2010, 42(7): 1028- 1037.
[12]LiYQ,XuM,SunOJ,CuiWC.EffectsofrootandlitterexclusiononsoilCO2effluxandmicrobialbiomassinwettropicalforests.SoilBiologyandBiochemistry, 2004, 36(12): 2111- 2114.
[13]SubkeJA,HahnV,BattipagliaG,LinderS,BuchmannN,CotrufoMF.Feedbackinteractionsbetweenneedlelitterdecompositionandrhizosphereactivity.Oecologia, 2004, 139(4): 551- 559.
[14]Siira-Pietik?inenA,HaimiJ,FritzeH.Organisms,decomposition,andgrowthofpineseedlingsinborealforestsoilaffectedbysodcuttingandtrenching.BiologyandFertilityofSoils, 2003, 37(3): 163- 174.
[15]CrowSE,LajthaK,FilleyTR,SwanstonCW,BowdenRD,CaldwellBA.Sourcesofplant-derivedcarbonandstabilityoforganicmatterinsoil:implicationsforglobalchange.GlobalChangeBiology, 2009, 15(8): 2003- 2019.
[16]WangQK,HeTX,WangSL,LiuL.Carboninputmanipulationaffectssoilrespirationandmicrobialcommunitycompositioninasubtropicalconiferousforest.AgriculturalandForestMeteorology, 2013, 178- 179: 152- 160.
[17]萬曉華, 黃志群, 何宗明, 胡振宏, 楊靖宇, 余再鵬, 王民煌. 闊葉和杉木人工林對土壤碳氮庫的影響比較. 應用生態學報, 2013, 24(2): 345- 350.
[18]明安剛, 賈宏炎, 陶怡, 盧立華, 蘇建苗, 史作民. 桂西南 28 年生米老排人工林生物量及其分配特征. 生態學雜志, 2011, 31(5): 1050- 1056.
[19]HuangZQ,WanXH,HeZM,YuZP,WangMW,HuZH,YangYS.Soilmicrobialbiomass,communitycompositionandsoilnitrogencyclinginrelationtotreespeciesinsubtropicalChina.SoilBiologyandBiochemistry, 2013, 62: 68- 75.
[20]WhiteD,DavisW,NickelsJ,KingJ,BobbieR.Determinationofthesedimentarymicrobialbiomassbyextractiblelipidphosphate.Oecologia, 1979, 40(1): 51- 62.
[21]DenefK,RoobroeckD,ManimelWaduMC,LootensP,BoeckxP.Microbialcommunitycompositionandrhizodeposit-carbonassimilationindifferentlymanagedtemperategrasslandsoils.SoilBiologyandBiochemistry, 2009, 41(1): 144- 153.
[22]LandesmanWJ,DightonJ.Responseofsoilmicrobialcommunitiesandtheproductionofplant-availablenitrogentoatwo-yearrainfallmanipulationintheNewJerseyPinelands.SoilBiologyandBiochemistry, 2010, 42(10): 1751- 1758.
[23]Frosteg?rd?,TunlidA,B??thE.UseandmisuseofPLFAmeasurementsinsoils.SoilBiologyandBiochemistry, 2011, 43(8): 1621- 1625.
[24]SwallowM,QuideauS,MacKenzieM,KishchukB.Microbialcommunitystructureandfunction:theeffectofsilviculturalburningandtopographicvariabilityinnorthernAlberta.SoilBiologyandBiochemistry, 2009, 41(4): 770- 777.
[25]胡亞林, 汪思龍, 黃宇, 于小軍. 凋落物化學組成對土壤微生物學性狀及土壤酶活性的影響. 生態學報, 2005, 25(10): 2662- 2668.
[26]陳法霖, 鄭華, 陽柏蘇, 歐陽志云, 張凱, 肖燚, 屠乃美. 中亞熱帶幾種針、闊葉樹種凋落物混合分解對土壤微生物群落碳代謝多樣性的影響. 生態學報, 2011, 31(11): 3027- 3035.
[27]陳法霖, 鄭華, 歐陽志云, 張凱, 屠乃美. 土壤微生物群落結構對凋落物組成變化的響應. 土壤學報, 2011, 48(3): 603- 611.
[28]KalbitzK,SchwesigD,SchmerwitzJ,KaiserK,HaumaierL,GlaserB,EllerbrockR,LeinweberP.Changesinpropertiesofsoil-deriveddissolvedorganicmatterinducedbybiodegradation.SoilBiologyandBiochemistry, 2003, 35(8): 1129- 1142.
[29]KaiserK,GuggenbergerG,HaumaierL,ZechW.Thecompositionofdissolvedorganicmatterinforestsoilsolutions:changesinducedbyseasonsandpassagethroughthemineralsoil.OrganicGeochemistry, 2002, 33(3): 307- 318.
[30]SmolanderA,KitunenV.SoilmicrobialactivitiesandcharacteristicsofdissolvedorganicCandNinrelationtotreespecies.SoilBiologyandBiochemistry, 2002, 34(5): 651- 660.
[31]NeffJC,AsnerGP.Dissolvedorganiccarboninterrestrialecosystems:synthesisandamodel.Ecosystems, 2001, 4(1): 29- 48.
[32]査同剛, 張志強, 孫閣, 王高敏, 贠小琴, 王伊琨, 劉艷. 凋落物分解主場效應及其土壤生物驅動. 生態學報, 2013, 32(24): 7991- 8000.
[33]ClevelandCC,ReedSC,KellerAB,NemergutDR,O’NeillSP,OstertagR,VitousekPM.Litterqualityversussoilmicrobialcommunitycontrolsoverdecomposition:Aquantitativeanalysis.Oecologia, 2014, 174(1): 283- 294.
[34]HuangZQ,LiaoLP,WangSL,CaoGQ.Allelopathyofphenolicsfromdecomposingstump-rootsinreplantChinesefirwoodland.JournalofChemicalEcology, 2000, 26(9): 2211- 2219.
[35]馬祥慶, 劉愛琴, 黃寶龍. 杉木人工林自毒作用研究. 南京林業大學學報: 自然科學版, 2000, 24(1): 12- 16., 2000.
[36]陳龍池, 汪思龍. 杉木根系分泌物化感作用研究. 生態學報, 2003, 23(2): 393- 398.
[37]黃志群, 廖利平, 汪思龍, 劉應迪. 杉木根樁和周圍土壤酚含量的變化及其化感效應. 應用生態學報, 2000, 11(2): 190- 192.
[38]李秋玲,肖輝林. 土壤性質及生物化學因素與植物化感作用的相互影響. 生態環境學報, 2012, 21(12): 2031- 2036.
[39]SoutoXC,ChiapusioG,PellissierF.Relationshipsbetweenphenolicsandsoilmicroorganismsinspruceforests:significancefornaturalregeneration.JournalofChemicalEcology, 2000, 26(9): 2025- 2034.
[40]王延平, 王華田, 許壇, 倪桂萍, 姜岳忠. 酚酸對楊樹人工林土壤養分有效性及酶活性的影響. 應用生態學報, 2013, 24(3): 667- 674.
[41]FengWT,SchaeferDA,ZouXM,ZhangM.ShiftingsourcesofsoillabileorganiccarbonafterterminationofplantcarboninputsinasubtropicalmoistforestofsouthwestChina.EcologicalResearch, 2011, 26(2): 437- 444.
[42]BrantJB,MyroldDD,SulzmanEW.Rootcontrolsonsoilmicrobialcommunitystructureinforestsoils.Oecologia, 2006, 148(4): 650- 659.
[43]BrantJB,SulzmanEW,MyroldDD.Microbialcommunityutilizationofaddedcarbonsubstratesinresponsetolong-termcarboninputmanipulation.SoilBiologyandBiochemistry, 2006, 38(8): 2219- 2232.
[44]張偉東, 汪思龍, 顏紹馗, 楊會俠, 徐廣標. 杉木根系和凋落物對土壤微生物學性質的影響. 應用生態學報, 2009, 20(10): 2345- 2350.
[45]BastianF,BouziriL,NicolardotB,RanjardL.Impactofwheatstrawdecompositiononsuccessionalpatternsofsoilmicrobialcommunitystructure.SoilBiologyandBiochemistry, 2009, 41(2): 262- 275.
[46]PotthastK,HamerU,MakeschinF.ImpactoflitterqualityonmineralizationprocessesinmanagedandabandonedpasturesoilsinSouthernEcuador.SoilBiologyandBiochemistry, 2010, 42(1): 56- 64.
[47]KramerC,GleixnerG.Variableuseofplant-andsoil-derivedcarbonbymicroorganismsinagriculturalsoils.SoilBiologyandBiochemistry, 2006, 38(11): 3267- 3278.
[48]LeckieSE.Methodsofmicrobialcommunityprofilingandtheirapplicationtoforestsoils.ForestEcologyandManagement, 2005, 220(1/3): 88- 106.
[49]YangK,ZhuJJ,ZhangM,YanQL,SunOJ.SoilmicrobialbiomasscarbonandnitrogeninforestecosystemsofNortheastChina:acomparisonbetweennaturalsecondaryforestandlarchplantation.JournalofPlantEcology, 2010, 3(3): 175- 182.
[50]王國兵, 阮宏華, 唐燕飛, 欒以玲, 陳月琴, 陶忠芳. 北亞熱帶次生櫟林與火炬松人工林土壤微生物生物量碳的季節動態. 應用生態學報, 2008, 19(1): 37- 42.
[51]XuZH,WardS,ChenCR,BlumfieldT,PrasolovaN,LiuJX.Soilcarbonandnutrientpools,microbialpropertiesandgrossnitrogentransformationsinadjacentnaturalforestandhooppineplantationsofsubtropicalAustralia.JournalofSoilsandSediments, 2008, 8(2): 99- 105.
[52]ChenTH,ChiuCY,TianG.Seasonaldynamicsofsoilmicrobialbiomassincoastalsandduneforest.Pedobiologia, 2005, 49(6): 645- 653.
[53]McGillW,CannonK,RobertsonJ,CookF.Dynamicsofsoilmicrobialbiomassandwater-solubleorganicCinBretonLafter50yearsofcroppingtotworotations.CanadianJournalofSoilScience, 1986, 66(1): 1- 19.
[54]ChuHY,GroganP.Soilmicrobialbiomass,nutrientavailabilityandnitrogenmineralizationpotentialamongvegetation-typesinalowarctictundralandscape.PlantandSoil, 2010, 329(1/2): 411- 420.
基金項目:國家自然科學基金項目(41371269); 教育部新世紀優秀人才支持計劃(DB-168); 福建省杰出青年科學基金項目(2060203)
收稿日期:2013- 10- 14; 網絡出版日期:2015- 10- 10
*通訊作者
Corresponding author.E-mail: zhiqunhuang@hotmail.com
DOI:10.5846/stxb201310142473
Changesofabove-andbelowgroundcarboninputaffectedsoilmicrobialbiomassandcommunitycompositionintwotreespeciesplantationsinsubtropicalChina
WANXiaohua1,2,HUANGZhiqun1,2,*,HEZongming3,YUZaipeng1,2,WANGMinhuang1,2,LIURuiqiang1,2,ZHENGLujia1,2
1 College of Geographical Science, Fujian Normal University, Fuzhou 350007, China 2 Cultivation Base of State Key Laboratory of Humid Subtropical Mountain Ecology, Fuzhou 350007, China 3 College of Forestry, Fujian Agriculture and Forestry University, Fuzhou 350002, China
Abstract:We employed Detritus Input and Removal Experiment (DIRT) to examine the effects of carbon (C) input on soil microbial biomass and community composition in 19-year-old Chinese fir (Cunninghamia lanceolata (Lamb.) Hook) and Mytilaria laosensis forests in subtropical China. The treatments included: (1) reciprocal litter transplant; (2) litter removal; (3) no inputs (litter removal+ root trenching); and (4) control. Each treatment had four 2 m×2 m plots. From January to December 2012, we collected the top 5 cm soil layer samples monthly from C. lanceolata and M. laosensis plots. Chloroform fumigation-extraction was used to determine the soil microbial biomass C and nitrogen (N) contents. Phospholipid fatty acid (PLFA) analysis was used to characterize the microbial community composition in soil samples collected in June 2012. Results suggested that the C input manipulations induced differences in soil microbial biomass and community composition were dependent on tree species. C input manipulations had no significant effects on soil microbial biomass C and N under M. laosensis. However, the concentrations of microbial biomass C and N seemed to increase under C. lanceolata. PLFA analysis showed that M. laosensis litter significantly increased the contents of bacterial PLFAs, fungal PLFAs and actinomycetes, and significantly enhanced the percent abundance of gram-negative bacteria and arbuscular mycorrhizal fungi under C. lanceolata. Litter removal significantly increased the contents of gram-positive bacteria, gram-negative bacteria, arbuscular mycorrhizal fungi, actinomycetes and fungi by 22%, 29%, 44%, 25% and 52%, respectively, and also increased the fungi to bacteria ratio by 21% compared with the control in C. lanceolata soil. However, litter removal and root trenching did not change soil microbial community composition in C. lanceolata and M. laosensis soils. Seasonal patterns of microbial biomass C and N were different between C. lanceolata and M. laosensis plantations. Nutrient availability rather than soil temperature, moisture or fresh litter input, may determine seasonal fluctuation of soil microbial biomass in this study. Our results suggested that further studies are required to confirm the relative contribution of above- and belowground C inputs in different tree species plantations in subtropical China.
Key Words:litter removal; root trenching; soil microbial biomass; microbial community composition; tree species; subtropical plantation
萬曉華,黃志群,何宗明,余再鵬,王民煌,劉瑞強,鄭璐嘉.改變碳輸入對亞熱帶人工林土壤微生物生物量和群落組成的影響.生態學報,2016,36(12):3582- 3590.
WanXH,HuangZQ,HeZM,YuZP,WangMH,LiuRQ,ZhengLJ.Changesofabove-andbelowgroundcarboninputaffectedsoilmicrobialbiomassandcommunitycompositionintwotreespeciesplantationsinsubtropicalChina.ActaEcologicaSinica,2016,36(12):3582- 3590.

