誘導子和前體協同添加對懸浮培養的雞血藤細胞產異黃酮的影響
吳桂容,曲芬霞,何彩梅,陳春嵐,陳興田
(賀州學院化學與生物工程學院,廣西 賀州 542800)
誘導子和前體協同添加對懸浮培養的雞血藤細胞產異黃酮的影響
吳桂容,曲芬霞,何彩梅,陳春嵐,陳興田
(賀州學院化學與生物工程學院,廣西 賀州 542800)
在雞血藤細胞懸浮培養的動力學基礎上,研究誘導子(茉莉酸甲酯)、前體(苯丙氨酸、乙酸鈉)以及兩者協同添加對雞血藤細胞產異黃酮的影響。結果表明:懸浮培養的雞血藤細胞的異黃酮合成與細胞生長之間存在半偶聯關系,指數生長期前期的第3 d有最大生長加速度,此時是最優添加時間。誘導子和前體單獨添加均能促進異黃酮的合成,茉莉酸甲酯、苯丙氨酸和乙酸鈉的最佳添加濃度分別為100、300、100 μmol/L,異黃酮含量分別為對照的1.34、1.83和1.57倍。誘導子和前體協同添加對異黃酮合成的促進作用強于單獨添加,茉莉酸甲酯+苯丙氨酸+乙酸鈉處理下異黃酮含量高達19.32 mg/L,為對照的3.62倍。
雞血藤;細胞懸浮培養;異黃酮;誘導子;前體;協同作用
吳桂容,曲芬霞,何彩梅,等.誘導子和前體協同添加對懸浮培養的雞血藤細胞產異黃酮的影響[J].廣東農業科學,2016,43 (5):129-134.
雞血藤是豆科植物密花豆(Spatholobus suberectus Dunn.)的干燥藤莖,主產廣西,廣東、云南等地也有分布。雞血藤是一種補血、活血的傳統大宗中藥材,具有促進造血、鎮靜催眠、抗炎、免疫調節、抗腫瘤和抗病毒等多種藥理作用[1-2]。由于長期對野生雞血藤資源的無度利用,我國野生雞血藤數量急劇減少,資源日益枯竭。目前,雖然已成功通過扦插育苗法對雞血藤進行人工栽培繁殖,但其扦插育苗在育苗材料選材上受到限制,需要由兩年生穗條扦插才可成活,其規模化應用受到限制[3]。隨著現代生物技術的發展,應用植物細胞進行懸浮培養獲得次生代謝產物得到了極大發展,如大豆異黃酮青天葵[4]、煙草[5]、大豆[6]等,目前尚未見雞血藤細胞懸浮培養的相關報道。
雞血藤成分構成復雜,其藥理作用的關鍵活性成分是異黃酮類化合物,主要包括大豆黃酮、染料木素、刺芒柄花素和美皂異黃酮4種異黃酮活性成分[7]。異黃酮類化合物對組織培養有抑制作用,應用植物細胞進行懸浮培養是大規模獲得異黃酮活性成分的有效手段[8]。目前,本課題組已成功誘導雞血藤愈傷組織[9],構建雞血藤懸浮細胞系并初步完成培養工藝初步優化,但其產量尚未達到工業化要求。在植物細胞培養中添加誘導子是提高目的化合物產量的常用方法,其中茉莉酸甲酯(methyl jasmonate,MJ)是植物細胞培養中常用的一種化學誘導子,其能有效調控次生代謝途徑,提高次生代謝產物產量[10]。此外,在植物細胞培養中加入目的化合物生物合成的前體也能大幅提高產物產量,苯丙氨酸(phenylalanine,Phe)和乙酸鈉(sodium acetate,NaAc)是植物合成異黃酮過程中的關鍵化合物[11]。本研究在雞血藤細胞懸浮培養的動力學基礎上,研究誘導子、前體和兩者協同添加對雞血藤細胞產異黃酮的影響,以期為雞血藤細胞懸浮培養產異黃酮的工業化應用提供理論基礎。
1 材料與方法
1.1 試驗材料
試驗材料為雞血藤愈傷組織,取自雞血藤嫩葉部位,以MS培養基+1.0 mg/L 6-BA(6-芐基氨基嘌呤)+ 0.5 mg/L NAA(1-萘乙酸)+30 g/L蔗糖+0.1 g/L VC誘導愈傷組織[9]。愈傷組織在25(± 1)℃、暗環境下培養,每15 d繼代一次。愈傷組織經過傳代篩選獲得淺黃色、疏松顆粒狀的愈傷組織培養系,準備接種。
1.2 細胞懸浮培養條件
將上述愈傷組織(約為5 g鮮重/瓶)接入液體MS培養基+0.5 mg/L NAA+1.0 mg/L 6-BA+30 g/L蔗糖+0.1 g/L+3 g/L水解酪蛋白中。細胞置于含100 mL培養基的300 mL三角燒瓶中進行培養,于25 (±1)℃暗環境下以100 r/min的速度搖瓶懸浮培養12 d,每個處理3次重復。
1.3 添加物質的處理
茉莉酸甲酯濃度設為25、50、75、100、125、150 μmol/L,苯丙氨酸濃度設為0、50、100、200、 300、400、500 μmol/L,乙酸鈉濃度設為0、25、50、100、150、200、250 μmol/L,將不同濃度的誘導子和前體經除菌過濾后添加細胞培養液中,添加時間由動力學研究結果確定。協同添加中將最佳濃度的誘導子和前體分別或者共同添加到細胞培養液中。
1.4 生物量測定
取雞血藤細胞培養物,2 000 r/min離心10 min,于60℃干燥至恒重,生物量為每升培養基收獲的細胞干重(g/L)。
1.5 異黃酮含量測定
將干燥細胞充分研磨后于95%乙醇冷浸24 h,超聲波處理30 min,過濾。提取3次,合并濾液,40℃下減壓濃縮,100 mL乙酸乙酯∶水(5∶1,V/V)混合溶液萃取3次。而細胞過濾發酵液經低溫冷凍濃縮后直接通過乙酸乙酯萃取抽提。合并乙酸乙酯抽提液,40℃下減壓蒸餾。甲醇溶解定容至5 mL,經0.45 μm微孔濾膜過濾后HPLC定量分析。
色譜條件:Agilent1100高效液相色譜儀,色譜柱:Purospher Star Cl8柱(4.6 mm ×250 mm,5 μm),流動相為甲醇:水:乙酸(10∶10∶1,V/V/V)溶液,柱溫25℃,進樣體積20 μL,流速1.0 mL/min,檢測波長260 nm,以外標法計算總異黃酮含量。單體標準品分別是大豆黃酮、染料木素、刺芒柄花素和美皂異黃酮(購自Sigma,純度98%)。總異黃酮含量為細胞內及發酵液上清中異黃酮含量之和,以每升培養液內4種異黃酮的總量表示(mg/L)。
用Excel 2013進行數據統計,以SPSS 19.0進行數據擬合、模型求導和多重比較分析(LSD)。
2 結果與分析
2.1 懸浮培養雞血藤細胞的生長和異黃酮合成
懸浮培養的雞血藤細胞的生長和異黃酮合成曲線如圖1所示。雞血藤細胞生長曲線呈現S形分布,其中培養0~3 d為細胞生長延滯期,生長緩慢,異黃酮合成也未開始。從培養3 d開始進入指數生長期,細胞快速生長,生物量至培養8 d達到最大(12.03 g/L),異黃酮含量也在培養4 d開始快速上升。指數生長期過后即快速進入衰亡期,穩定期較短,生物量從培養8 d開始衰減,但異黃酮合成繼續進行,異黃酮含量在培養12 d達到最大(5.34 mg/L)。異黃酮合成與細胞生長之間存在著半偶聯關系,與其他植物細胞的懸浮培養的結果類似[12]。

圖1 懸浮培養的雞血藤細胞生長和異黃酮合成曲線
2.2 懸浮培養的雞血藤細胞生長動力學
在批次培養中,一般用Logistic曲線對細胞生長曲線進行擬合。懸浮培養的雞血藤細胞生長的Logistic擬合曲線如圖2。擬合函數為y=11.18+ (2.11-11.18)/(1+(x/4.59) 6.86)(R2=0.963),表明Logistic函能較好地對細胞生長進行擬合。進一步對擬合函數進行一階和二階求導,從而得出雞血藤細胞生長的速度和加速度(圖3)。結果表明細胞生長速率先增大后減小,至培養5 d有最大生長速度(圖3A);而細胞生長加速度先增大再減小,再小幅回升,至培養3 d有最大生長加速度(圖3B)。可見細胞生長加速度最大時(通常是指數生長期的前期)是添加物質的最佳時間,此時進行處理能顯著促進植物細胞次生代謝物的合成[12-13]。因此,本研究選擇繼代培養后3 d添加誘導子和前體。

圖2 雞血藤細胞生長的Logistic擬合曲線
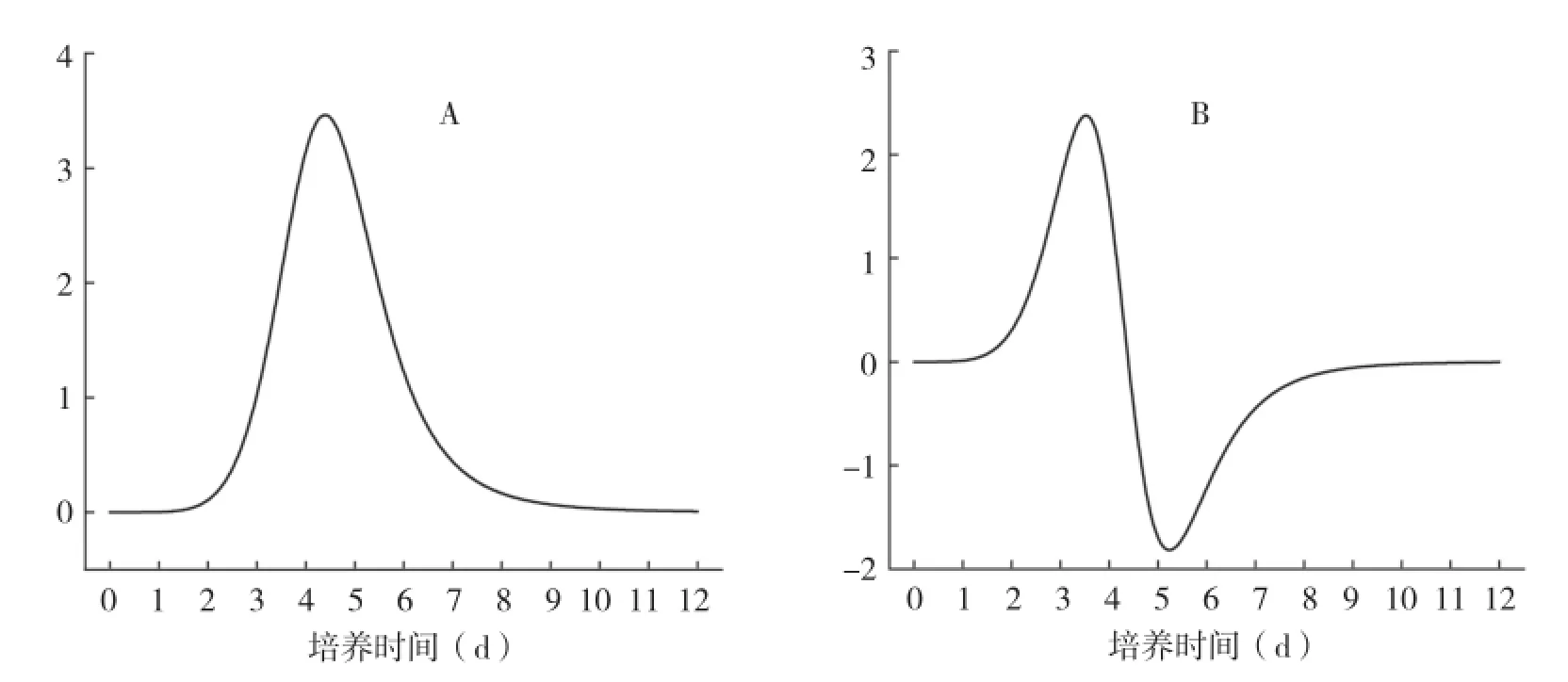
圖3 雞血藤細胞生長的Logistic函數的一階求導(A)和二階求導(B)
2.3 誘導子茉莉酸甲酯對雞血藤細胞產異黃酮的影響
本研究于繼代培養第3 d加入不同濃度茉莉酸甲酯,于第12 d收獲細胞,結果如圖4所示。隨著茉莉酸甲酯濃度的升高,雞血藤細胞生長受到的抑制作用增強,在150 μmol/L茉莉酸甲酯作用下生物量僅剩對照的55.78%。而異黃酮含量隨著茉莉酸甲酯濃度的升高先增加后減少。其中低濃度的茉莉酸甲酯(25 μmol/L)對異黃酮的合成未見顯著促進作用;在100 μmol/L茉莉酸甲酯作用下異黃酮含量達到最高、達8.21(±0.45 )mg/L(為對照組的1.34倍)。以上結果說明誘導子茉莉酸甲酯能顯著促進異黃酮的合成,其最佳添加濃度為100 μmol/L。
2.4 前體苯丙氨酸和乙酸鈉對雞血藤細胞產異黃酮的影響

圖4 不同濃度茉莉酸甲酯對雞血藤細胞產異黃酮的影響

圖5 不同濃度苯丙氨酸對雞血藤細胞產異黃酮的影響

圖6 不同濃度乙酸鈉對雞血藤細胞產異黃酮的影響
本研究對兩種前體物質苯丙氨酸和乙酸鈉分別進行研究,分別于繼代培養后3 d添加。不同濃度的前體苯丙氨酸對細胞生長和異黃酮合成的影響如圖5所示。結果顯示隨著苯丙氨酸濃度的升高,其對細胞生長的抑制作用增強,在500 μmol/L苯丙氨酸作用下生物量僅剩對照組的44.67%。苯丙氨酸的添加對異黃酮合成具有明顯的促進作用,在50~300 μmol/L苯丙氨酸作用下異黃酮含量不斷增加,隨后則開始下降。其中在300 μmol/L苯丙氨酸作用下異黃酮含量達到最高、達8.21(± 0.45)mg/L(為對照的1.83倍)。以上結果說明前體物質苯丙氨酸能顯著促進異黃酮的合成,其最佳添加濃度為300 μmol/L。
不同濃度的前體乙酸鈉對細胞生長和異黃酮合成的影響如圖6所示。在25~100 μmol/L乙酸鈉作用下,其對異黃酮合成具有促進作用,其中在100 μmol/L苯丙氨酸作用下異黃酮含量最高、達8.21(±0.45)mg/L(為對照的1.57倍)。隨著乙酸鈉濃度的升高,其對細胞生長的抑制作用增強,在250 μmol/L乙酸鈉作用下生物量僅剩對照的37.51%。說明前體物質乙酸鈉也能顯著促進異黃酮的合成,其最佳添加濃度為100 μmol/L,但其促進效果要低于苯丙氨酸。

圖7 誘導子和前體協同添加對雞血藤細胞產異黃酮的影響
2.5 誘導子和前體協同添加對雞血藤細胞產異黃酮的影響
誘導子誘導和前體喂養兩條途徑均能促進產物合成[14],為進一步研究誘導子和前體協同添加對雞血藤細胞產異黃酮的影響,于繼代培養后3 d分別將最佳濃度的誘導子茉莉酸甲酯和前體苯丙氨酸和乙酸鈉分別或協同添加于懸浮培養的雞血藤細胞培養液中,結果見圖7。誘導子和前體協同添加對細胞生長的抑制效應強于誘導子的單獨添加,但弱于兩種前體物質的協同添加。不同處理對類黃酮合成的促進作用依次為:茉莉酸甲酯+苯丙氨酸+乙酸鈉>茉莉酸甲酯+苯丙氨酸>茉莉酸甲酯+乙酸鈉>苯丙氨酸+乙酸鈉>茉莉酸甲酯>對照組。前體和誘導子對異黃酮合成表現出明顯的協同效應,茉莉酸甲酯聯合苯丙氨酸、乙酸鈉的產量〔分別為17.14(±0.45)、15.69(±0.37)mg/L〕顯著高于茉莉酸甲酯的單獨添加(8.21± 0.47 mg/L);茉莉酸甲酯+苯丙氨酸+乙酸鈉處理下異黃酮含量高達19.32 mg/L,為對照組的3.62倍。說明茉莉酸甲酯、苯丙氨酸和乙酸鈉三者的協同添加對促進異黃酮合成具有最佳促進效果。
3 結論與討論
自19世紀40年代植物細胞的實驗室培養技術建立以來,植物細胞培養快速發展,其中紅豆杉、人參、長春花、三七等珍稀藥用植物的細胞懸浮培養是國內外研究的熱門方向[15]。藥用植物的細胞懸浮培養具有生長快速、條件可控、次生代謝產物易合成的特點,是大規模獲得藥物有效成分、緩解珍稀中藥材供應緊張的重要手段,但產量過低限制了植物細胞培養的商業化推廣[15-16]。誘導子(如茉莉酸甲酯)和前體(如苯丙氨酸、乙酸鈉)的添加是提高目的次生代謝物產量的常用手段,在植物細胞培養被中廣泛使用[13,17]。
誘導子能夠選擇性地誘導植物特定基因的表達,進而促進特定的次生代謝物合成途徑,是影響植物次生代謝的有效因素[14]。研究表明,外源茉莉酸甲酯主要通過提高植物細胞的苯丙氨酸解氨酶(PAL)促進異黃酮的合成[18]。而前體主要是植物次生代謝途徑的中間產物,前體的添加能有效消除途徑中的關鍵酶或化合物的阻礙作用,從而大幅度提高次生代謝物的產量[19]。如前體苯丙氨酸是黃酮類化學物B雜環和C雜環的直接組成部分,而乙酸鈉則能為黃酮類化學物A雜環中乙酸提供來源[11,20]。誘導子和前體的作用機制并不重疊,兩者具有協同添加的基礎。曲均革等[21]研究表明,誘導子和前體具有協同作用,茉莉酸甲酯、苯丙氨酸和光照的聯合使用使葡萄細胞培養合成花青素提高了2.5~5.2倍。
本研究中,懸浮培養的雞血藤細胞的異黃酮合成與細胞生長之間存在著半偶聯關系。動力學研究表明在指數生長期前期的第3 d有最大生長加速度,適宜作為誘導子和前體添加的時間。誘導子茉莉酸甲酯的最佳添加濃度為100 μmol/L,異黃酮含量為對照的1.34倍;前體苯丙氨酸和乙酸鈉的最佳添加濃度分別為300、100 μmol/L,異黃酮含量分別為對照的1.83和1.57倍;誘導子和前體協同添加對異黃酮合成的促進作用強于單獨添加,茉莉酸甲酯+苯丙氨酸+乙酸鈉處理下異黃酮含量高達19.32 mg/L,為對照組的3.62倍。誘導子和前體的協同添加大幅度了提高異黃酮產量,為雞血藤細胞懸浮培養產異黃酮的工業化應用提供理論基礎。
[1]符影,程悅,陳建萍,等.雞血藤化學成分及藥理作用研究進展[J].中草藥,2011,42(6):1229-1234.
[2]Wang Z Y,Wang D M,Loo T Y,et al.Spatholobus suberectus inhibits cancer cell growth by inducing apoptosis and arresting cell cycle at G2/M checkpoint [J].Journal of Ethnopharmacology,2011,133(2):751-758.
[3]曲芬霞,吳桂容,李忠芳,等.雞血藤硬枝扦插繁殖技術研究[J].浙江林業科技,2010,30(6):27-30.
[4]張曉麗,梁凌玲,詹若挺,等.藥用植物青天葵的懸浮培養條件優化[J].廣東農業科學,2012,39 (16):32-35.
[5]Reuter L J,Bailey M J,Joensuu J J,et al.Scaleup of hydrophobin-assisted recombinant protein production in tobacco BY-2 suspension cells[J].Plant Biotechnology Journal,2014,12(4):402-410.
[6]Yan W,Han Y,Teng W,et al.Expression quantitative trait loci infer the regulation of isoflavone accumulation in soybean (Glycine max L.Merr.)seed.[J].BMC Genomics,2014,15(1):1-11.
[7]余彎彎,金晨,雙鵬程,等.豐城雞血藤異黃酮及黃烷類化學成分的研究[J].中國中藥雜志,2015,40 (12):2363-2366.
[8]羅建平,曹磊,潘利華,等.稀土元素對懷槐懸浮培養細胞異黃酮合成及氧化還原態的影響[J].應用與環境生物學報,2008,14(3):362-365.
[9]吳桂容,陳春嵐,曲芬霞,等.雞血藤嫩葉愈傷組織誘導最佳培養基的篩選[J].現代農業科技,2009,37(18):93-94.
[10]Gumerova E A,Akulov A N,Rumyantseva N I.Effect of methyl jasmonate on growth characteristics and accumulation of phenolic compounds in suspension culture of tartary buckwheat[J].Russian Journal of Plant Physiology,2015,62(2):195-203.
[11]康亞蘭,裴瑾,蔡文龍,等.藥用植物黃酮類化合物代謝合成途徑及相關功能基因的研究進展[J].中草藥,2014,45(9):1336-1341.
[12]陳書安,王曉東,袁曉凡,等.藏紅花細胞懸浮培養動力學研究[J].生物技術通報,2011,27(4):102-105.
[13]莫歌,黃蕾,康利平,等.不同類型誘導子對歐洲花楸懸浮細胞次生代謝的影響[J].中藥材,2014,37 (6):927-931.
[14]劉冉,王振宇,崔杰,等.前體物質和誘導子對紅松松多酚合成的影響[J].北京林業大學學報,2013,35(5):22-26.
[15]高文遠,賈偉,段宏泉,等.藥用植物發酵培養的工業化探討[J].中國中藥雜志,2003,28(5):385-390.
[16]Hu G,Jia J.Production of Useful Secondary Metabolites Through Regulation of Biosynthetic Pathway in Cell and Tissue Suspension Culture of Medicinal Plants[M].Rijeka:Intech,2012.
[17]謝騰,莫歌,張山山,等.不同誘導子對植物次生代謝的影響[J].中國實驗方劑學雜志,2015,21(7):210-215.
[18]馬君蘭,趙越.外源茉莉酸甲酯(MeJA)對大豆異黃酮合成途徑的影響[J].東北農業大學學報,2011,42(5):14-18.
[19]Moscatiello R,Baldan B,Navazio L.Plant cell suspension cultures[J].Methods in Molecular Biology,2013,953(953):77-93.
[20]Nguyen T X,方升佐,Nguyen Q H,等.培養基和植物生長調節劑對青錢柳懸浮細胞三萜產量的影響[J].西南林業大學學報,2015,35(1):6-11.
[21]曲均革,虞星炬,張衛,等.前體飼喂、誘導子和光照聯合使用對葡萄細胞培養合成花青素的影響[J].生物工程學報,2006,22(2):299-305.
(責任編輯 白雪娜)
Synergistic effects of elicitors and precursors on the synthesis of isoflavones in cell suspension culture of Spatholobus suberectus Dunn.
WU Gui-rong,QU Fen-xia,HE Cai-mei,CHEN Chun-lan,CHEN Xing-tian
(College of Chemical and Biological Engineering,Hezhou University,Hezhou 542800,China)
The study investigated the effects of elicitors (methyl jasmonate,MJ),precursors (phenylalanine,Phe and sodium acetate,NaAc) and their synergistic effects on the synthesis of isoflavones in cell suspension culture of Spatholobus suberectus Dunn.,based on the result of kinetics research.The results showed that a semi-coupling relationship existed between cell growth of S.suberectus and isoflavone synthesis.At the 3rd d,the maximum acceleration of growth was found,indicating that it's suitable adding time for elicitors and precursors could promote the isoflavone synthesis,as the best added concentration for MJ,Phe and NaAc were 100 μmol/L,300 μmol/L and 100 μmol /L,which were 1.34,1.83 and 1.57 times to the control,respectively.The synergistic addition of elicitors and precursors significantly promoted isoflavone synthesis,with isoflavone content up to 19.32 mg/L in MJ+Phe+NaAc treatment (as 3.62 times to the control).This study provided the theory basis for scale amplification in suspension cell culture of S.suberectus.
Spatholobus suberectus Dunn.;cell suspension culture;isoflavone;elicitors;precursors;synergistic effect
Q814
A
1004-874X(2016)05-0129-06
10.16768/j.issn.1004-874X.2016.05.025
2016-01-18

