高脂高嘌呤飲食聯合氧嗪酸鉀誘導鵪鶉糖脂代謝紊亂及其并發癥
張 燕,馬菱蔓,Sarah Wambui Amadi,巫冠中
(中國藥科大學藥理教研室,南京 210009)
?
高脂高嘌呤飲食聯合氧嗪酸鉀誘導鵪鶉糖脂代謝紊亂及其并發癥
張燕,馬菱蔓,Sarah Wambui Amadi,巫冠中
(中國藥科大學藥理教研室,南京210009)
【摘要】目的旨在建立一種實用的動物慢性代謝疾病模型,探討高尿酸血癥與糖脂代謝的相關性,以及其病理損傷機制。方法采用高脂高次黃嘌呤飲食+氧嗪酸鉀聯合造模,檢測鵪鶉血清尿酸和甘油三酯動態含量變化,并在實驗結束后測定血清中各相關指標,并對肝、腎、主動脈進行病理檢測。結果高脂高次黃嘌呤飼料+氧嗪酸鉀誘導可以明顯升高鵪鶉血清尿酸和甘油三酯含量。糖耐量實驗表明,聯合造模組鵪鶉血糖峰值較高,血糖變化曲線下面積均大于其他各組,胰島素水平也明顯較其他組高。聯合造模組還能升高血清谷草轉氨酶、谷丙轉氨酶活力及尿素氮、肌酐含量,對肝臟、主動脈和腎臟具有明顯的損傷作用,這些損傷作用能被苯扎貝特和非布索坦不同程度緩解。結論高脂高次黃嘌呤食餌+氧嗪酸鉀聯合誘導可以建立一種簡便、穩定、持久的動物慢性代謝疾病模型。
【關鍵詞】高尿酸血癥;鵪鶉;高脂血癥;高胰島素血癥
代謝綜合征(metabolic syndrome,MS)是由胰島素抵抗引發的一系列生化、體液代謝失常, 從而引起多種物質代謝異常的綜合征,常包括高血壓、高血糖、胰島素抵抗、血脂異常、肥胖等[1-2]。高尿酸血癥屬于嘌呤代謝障礙性疾病,是代謝綜合征各組分(高血壓、心血管疾病和糖尿病等)的預測因子。研究發現,血尿酸水平與尿素氮、甘油三酯、空腹胰島素水平等呈正相關,而與高密度脂蛋白膽固醇(high-density lipoprotein cholesterol,HDL-C)負相關[3]。動物實驗研究也表明,降低血尿酸水平能夠預防甚至逆轉代謝綜合征的發展進程,與之相關的可能機制是尿酸和胰島素之間的相互作用。升高的血尿酸使內皮功能受損,減弱一氧化氮(nitric oxide,NO)的生物利用度,導致高胰島素血癥,高胰島素血癥反過來降低腎近曲小管對尿酸的排泄,導致尿酸在體內的進一步積聚[4]。Nakagawa等[5]研究發現尿酸可劑量依賴性地抑制血管內皮功能,其能夠通過黃嘌呤氧化酶系統激活氧化應激反應誘發動脈粥樣硬化。
目前高尿酸模型的建立方法雖然很多,但是仍存在不足。靈長類動物缺乏尿酸酶[6],而大多數動物(如大、小鼠)體內依然存在尿酸酶,其可將體內尿酸進一步分解為水溶性極好的尿囊素[7],不易積蓄,且腎臟排泄能力強大。這些也是小鼠血尿酸水平在高尿酸形成后,繼續給造模劑血尿酸反而降低的原因,其大大限制了大、小鼠在高尿酸血癥造模方面的應用[8]。通過實驗手段破壞尿酸酶基因或采用基因重組法制備高尿酸血癥模型,往往僅依賴于遺傳因素,忽略環境的影響,且過程復雜,成本高[9]。禽類由于缺乏尿酸酶,體內尿酸能以原形排出體外,其嘌呤核苷酸的代謝途徑與人相似,故選用禽類作為高尿酸血癥動物模型能較確切反映體內嘌呤核苷酸的代謝水平,且具有高尿酸血癥水平持續穩定的優點[10]。
本課題主要研究高尿酸與MS之間的相關關系,以鵪鶉作為研究對象,采用高嘌呤飼料喂飼為基礎造模方法,輔以尿酸酶抑制劑-氧嗪酸鉀以提高成模效果;并進一步結合高脂飲食處理,擬在高尿酸基礎上建立脂代謝紊亂或胰島素抵抗的復合模型。高嘌呤食餌類似于人類的高蛋白飲食,其易導致嘌呤核苷酸代謝紊亂誘發高尿酸血癥,氧嗪酸鉀是尿酸的類似物,作為化學誘導劑可抑制尿酸分解代謝,增加體內血清尿酸水平[11],而高油脂食餌類似于人類的肥甘飲食,其易導致機體血脂代謝紊亂誘發高脂血癥和胰島素抵抗,二者結合,建立的糖、脂代謝紊亂模型穩定,重現性好,且該模型簡便、持續時間長,與代謝綜合癥病理特征類似,利于觀察藥物對高尿酸血癥誘發MS的治療作用,并進一步探討疾病發生的機制。
1材料和方法
1.1實驗動物
中國白羽鵪鶉,5周齡,40只,雌雄各半,體重85~100 g,購自:安徽蕪湖市偉業鵪鶉養殖場。飼養條件:室溫20~24℃,相對濕度45%~65%,明暗周期12 h/12 h。
1.2試劑與儀器
氧嗪酸鉀、次黃嘌呤購自合肥博美生物科技有限責任公司;尿酸購自國藥集團化學試劑有限公司;四氧嘧啶(Alloxan Monohdrate)購自Sigma公司;苯扎貝特購自江蘇天士力帝益藥業有限公司;非布索坦原料藥由中國藥科大學應用化學研究所提供。尿酸(uric acid,UA)、甘油三酯(triglyceride,TG)、葡萄糖(glucose)試劑盒購自中生北控生物科技股份有限公司;黃嘌呤氧化酶(xanthine oxidase,XOD)、胰島素(insulin,INS)放免、脂肪酶(lipase,LPS)、谷草轉氨酶(aspartate aminotransferase,AST)、谷丙轉氨酶(alanine aminotransferase,ALT)、肌酐(creatinine,Cr)、尿素氮(blood urea nitrogen,BUN)測定試劑盒購自南京建成生物工程研究所;BS1072(Col4A1(G46))、BS6005(VCAM-1一抗)、BS2980(ICAM-1一抗)、BSxxx(PAI-1一抗)購自武漢博士德生物工程有限公司;其他試劑均為市售分析純。鵪鶉飼料為本實驗室自制,配方如下:正常飼料總熱量約為354 kcal 100 g,分別含黃豆粉(418 kcal/100 g)15%,玉米粉(341 kcal/100 g)50%,面粉(344 kcal/100 g)35%;單純高脂飼料總熱量約為423 kcal/100 g,分別為黃豆粉8.5%,玉米粉50%,面粉16.5%,熟豬油(897 kcal/100 g)10%,膽固醇(715 kcal/100 g)1%,全蛋粉(545 kcal/100 g)5%,糖(400 kcal/100 g)9%。高脂高次黃嘌呤飼料總熱量約為419 kcal/100 g,分別為黃豆粉8%,玉米粉50%,面粉16%,熟豬油10%,膽固醇1%,全蛋粉5%,糖9%,次黃嘌呤1%。
1.3實驗動物分組及造模方法
為探討高脂高嘌呤飲食聯合氧嗪酸鉀誘導鵪鶉糖脂代謝紊亂情況,設普通飼料對照組(A組),單純高脂飼料對照組(B組),高脂高嘌呤飲食聯合氧嗪酸鉀誘導組(C組),以及苯扎貝特和非布索坦干預組(D組和E組)。具體方法如下:40只鵪鶉隨機分為5組,每組8只,普通飼料適應飼養5 d后,A組繼續飼喂普通飼料,其余4組換為高脂飼料飼喂,2周后改用高次黃嘌呤飼料飼喂,第五周開始進行分組處理:A組仍給予普通飼料,B組單純高脂飼料,C組高脂高次黃嘌呤飼料+氧嗪酸鉀200 mg/kg, 皮下注射(sc),D組高脂高次黃嘌呤飼料+氧嗪酸鉀200 mg/kg, sc+苯扎貝特100 mg/kg, 灌胃(ig),E組高脂高次黃嘌呤飼料+氧嗪酸鉀200 mg/kg, sc+非布索坦5 mg/kg, ig,連續處理9周。
1.4鵪鶉血清指標的測定
實驗期間鵪鶉于翼下靜脈叢采集空腹血樣(禁食不禁水12 h),離心(3000 r/min),分離血清,前8周,每兩周測定空腹血清UA和TG含量1次;后6周,每周均測定空腹血清UA和TG含量的變化情況。末次給藥后2 h斷頭取血,分離血清測定XOD、LPS活性,INS含量,以及肝功能指標血清AST和ALT的含量,腎功能指標血清BUN和Cr的含量。
1.5鵪鶉糖耐量試驗
第13周后(即63 d后),鵪鶉經12 h禁食不禁水后,翅靜脈叢取血,采集空腹血樣后灌服糖負荷2 g/kg,并于服糖后0.5 h、1 h、2 h取血,測定各時間點鵪鶉血糖含量。
1.6組織病理學檢測
收集各組鵪鶉心臟主動脈弓、肝臟、右腎經10 % 甲醛溶液固定,進行HE染色[12],步驟如下:1)取材組織塊,經固定后,常規石蠟包埋,4 μm切片;2)切片經二甲苯脫蠟(2次,每次5~10 min),經各級乙醇至水洗(100%乙醇2 min、95%的乙醇1 min、80%乙醇1 min、75%乙醇1 min、蒸餾水洗2 min);3)蘇木素染色5 min,自來水沖洗;4)鹽酸乙醇分化30 s;5)自來水浸泡15 min;6)置伊紅液染色2 min;7)常規脫水,透明,封片(95%乙醇2次、100%乙醇2次1 min,每次1~2 min;二甲苯-苯酚(3:1)5 min;二甲苯2次,每次3~4 min;中性樹脂封固)。在光學顯微鏡下觀察分析各組鵪鶉組織病理學結果。
1.7統計學處理
2結果
2.1空腹血清UA和TG動態變化
由圖1A中可看出,鵪鶉飼喂高脂飼料以后,血清UA含量即開始上升。而自第5周加入高尿酸造模劑處理后,模型組(C組)UA水平上升最明顯(P<0.05),且維持峰值時間達4周,其次為苯扎貝特組(P<0.05或P<0.01),E組由于降尿酸藥非布索坦的干預,UA水平與單純高脂飼料組相似。圖1B顯示在高尿酸造模劑加入前,各組鵪鶉血清TG含量相近且水平較低。自第5周起加入高尿酸造模劑后,造模劑處理組鵪鶉TG水平即開始上升,以模型組(C)上升最明顯(P<0.05),其次為非布索坦組(E)。第10周時,各組鵪鶉血清TG達到峰值(高脂飼料組除外),后逐漸呈下降趨勢。
2.2單次口服葡萄糖耐量(oral glucose tolerance test,OGTT)實驗中血糖的變化情況
與普通飼料對照組相比,高脂高嘌呤飲食+氧嗪酸鉀模型組在葡萄糖負荷后1 h、2 h血糖水平高于對照組(P<0.05),其余各組血糖變化水平差異無統計學意義(見表1)。
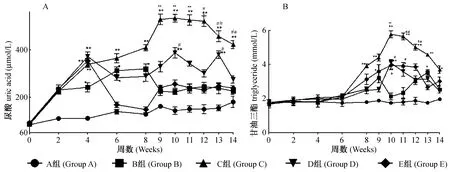
注:與A相比*P<0.05,**P<0.01;與B相比#P<0.05,# #P<0.01。(A)UA水平變化;(B)TG水平變化。A組:正常對照組;B組:高脂飼料組;C組:高脂高次黃嘌呤+氧嗪酸鉀組;D組:高脂高次黃嘌呤+氧嗪酸鉀+苯扎貝特組;E:組高脂高次黃嘌呤+氧嗪酸鉀組+非布索坦組。圖1 鵪鶉空腹血清UA和TG水平變化Note:*P<0.05,**P<0.01 vs group A; #P<0.05,# #P<0.01 vs group B. (A) Serum UA levels; (B) Serum TG levels.Group A: normal control; Group B: high fat diet; Group C: high fat purine diet + oteracil potassium (model group); Group D: modeling quail treated with bezafibrate; Group E: modeling quail treated with febuxostat.Fig.1 Quail fasting serum UA and TG levels.
Tab.1Quails glucose tolerance test

組別(Groups)葡萄糖Glucose(mmol/L)0h0.5h1h2hA組(GroupA)10.1±0.725.9±1.013.6±1.510.6±1.2B組(GroupB)12.1±0.625.0±1.814.5±1.413.8±0.6C組(GroupC)13.9±1.030.3±2.020.4±3.4*18.1±2.6*D組(GroupD)13.9±1.425.5±3.016.1±2.116.0±1.2E組(GroupE)14.8±1.023.1±2.818.8±2.215.8±0.7
注:與對照組(A組)比較*P<0.05。
Note:*P<0.05 vs group A.
Tab.2Effects of high fat purine diet on quails serum XOD, INS, LPS and prameters related to liver and kidney functions
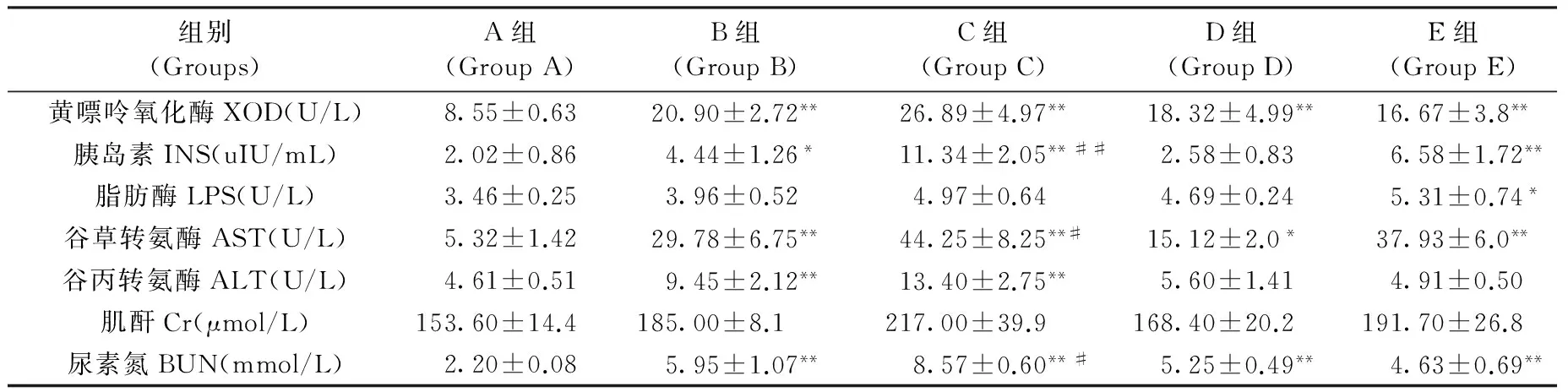
組別(Groups)A組(GroupA)B組(GroupB)C組(GroupC)D組(GroupD)E組(GroupE)黃嘌呤氧化酶XOD(U/L)8.55±0.6320.90±2.72**26.89±4.97**18.32±4.99**16.67±3.8**胰島素INS(uIU/mL)2.02±0.864.44±1.26*11.34±2.05**##2.58±0.836.58±1.72**脂肪酶LPS(U/L)3.46±0.253.96±0.524.97±0.644.69±0.245.31±0.74*谷草轉氨酶AST(U/L)5.32±1.4229.78±6.75**44.25±8.25**#15.12±2.0*37.93±6.0**谷丙轉氨酶ALT(U/L)4.61±0.519.45±2.12**13.40±2.75**5.60±1.414.91±0.50肌酐Cr(μmol/L)153.60±14.4185.00±8.1217.00±39.9168.40±20.2191.70±26.8尿素氮BUN(mmol/L)2.20±0.085.95±1.07**8.57±0.60**#5.25±0.49**4.63±0.69**
注:與對照組(A組)比較*P<0.05,**P<0.01;與高脂飼料組(B組)比較#P<0.05,##P<0.01。
Note:*P<0.05,**P<0.01 vs group A;#P<0.05,##P<0.01 vs group B.
2.3各組鵪鶉血清指標
與普通飼料對照組相比,單純高脂飲食與高脂高嘌呤飲食+氧嗪酸鉀誘導均能使血清XOD活力明顯升高(P<0.01);但對LPS活性影響較小。胰島素水平在高脂高嘌呤飲食+氧嗪酸鉀誘導組尤為突出(與正常對照組和高脂對照組相比均P<0.01),非布索坦對血清INS水平表現出一定的降低作用。同時,高脂或高脂高嘌呤+氧嗪酸鉀刺激也均能導致血清AST和ALT活力的明顯升高(P<0.01),其中以高脂高嘌呤+氧嗪酸鉀(C)誘導最明顯(P<0.01),苯扎貝特(D)能明顯降低AST含量,苯扎貝特(D)和非布索坦(E)均能明顯降低ALT活力。與普通飼料對照組相比,高脂高嘌呤飲食誘導下,血清BUN及Cr含量均升高(其中BUN升高水平尤為明顯,P<0.05),非布索坦能降低血清BUN的含量。苯扎貝特對BUN和Cr的影響作用并不明顯。結果見表2。
2.4組織病理學檢查
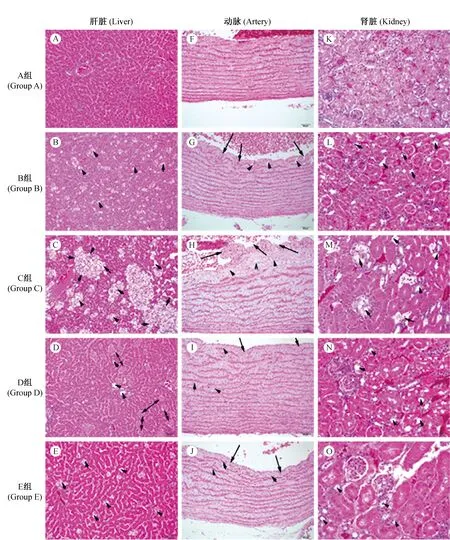
注:(A-E)肝細胞脂變(短箭頭所示),肝細胞壞死(雙向箭頭所示);(F-J)主動脈壁脂質沉積(短箭頭所示),有斑塊形成及血管壁突起(長箭頭所示);(K-O)腎小球內有脂質沉積(短箭頭所示),腎小管空泡變性。圖2 各組鵪鶉肝臟、腎臟及動脈病變(HE染色×200)Note. (A-E) Short arrows show fatty degeneration of liver cells and double arrows show necrosis in liver; (F-J) Short arrows show aortic wall lipid deposition, and long arrows show plaque formation and vessel wall projections in artery; (K-O) Short arrows show glomerular lipid deposition and renal tubular degeneration in kidney.Fig.2 Histopathology of liver, artery and kidney (HE staining,×200)
病理學檢查結果顯示:普通飼料對照組(A)鵪鶉除肝細胞出現微小的脂質小泡外,腎臟和動脈均未觀察到明顯病變;在單純高脂飼料喂飼組(B),腎臟病變及其輕微,動脈病變與E組相似;在所有組別中,高脂高嘌呤飼料+氧嗪酸鉀模型組(C)的病變最為明顯,尤其以腎臟組織病變為主,腎臟病變的主要表現為:腎小球內有脂質沉積,腎小管空泡變性(如圖2所示);使用苯扎貝特(D)和非布索坦(E)干預后,腎臟病變程度有所減輕。在高脂飼料作用下,B、C、D和E組的肝細胞脂質變性的程度嚴重于正常對照組,以C組最甚。動脈病變主要表現為主動脈壁脂質沉積,有斑塊形成,C組的病變程度最嚴重,B、E組動脈病變的程度相似,與C組比較明顯減輕。
3討論
以高血糖、胰島素抵抗、高血壓和血脂代謝紊亂為主要病理特征的MS與多種致死性疾病,如冠心病、動脈粥樣硬化等密切相關[13]。已有研究充分表明糖脂代謝紊亂、中心性肥胖及糖尿病是MS的傳統危險組分[14]。近年來,隨著國內外學者對MS的研究進一步深入,發現高尿酸血癥(HUA)也與MS的發生及其并發癥密切相關。有學者認為,HUA可能是MS的組成成分之一[15]。MS各組分之間存在復雜的相互關系,由MS造成的高甘油三酯血癥常伴有脂蛋白脂酶活性降低,功能異常的脂蛋白脂酶導致血尿酸的清除障礙,而體內尿酸水平的升高可進一步促進脂蛋白脂酶活性降低,加重脂代謝異常。有研究表明,高尿酸血癥是血脂異常的一種表現,高尿酸水平與體重指數(body mass index, BMI)、血清總膽固醇、低密度脂蛋白膽固醇(low-density lipoprotein cholesterol, LDL-C)和TG的升高密切相關[16]。在本課題研究中,我們選用缺乏尿酸酶,且尿酸代謝途徑與人類相似的鵪鶉為研究對象[17]。為證實MS模型制備的成功與否,采用了療效較為確切的苯扎貝特和非布索坦作為陽性對照藥[18-19]。
高尿酸血癥主要以血清UA濃度升高及血清XOD活力增強為主要表現。高甘油三脂血癥是高脂血癥主要臨床表現之一。空腹INS水平和血清TC、TG含量等均可作為胰島素抵抗的指標。本研究中,高脂飼料飼養初期,鵪鶉血清尿酸水平即開始升高,當結合高嘌呤飲食和氧嗪酸鉀造模后,尿酸達峰值并能維持4周,苯扎貝特降脂藥干預組能降低造模鵪鶉尿酸水平,而非布索坦的降尿酸作用更為明顯,甚至接近正常水平,而單純高脂飼料組并未能持續升高尿酸水平且在第8周后有下降趨勢。也就是說高脂飼料可升高正常鵪鶉體內尿酸水平,但一段時間后尿酸水平可能恢復,而高嘌呤飲食與氧嗪酸鉀可快速升高并維持高尿酸水平,同時除對照組外各組鵪鶉血清中XOD活性明顯升高,尤以造模組為最高。在血清TG 的變化中可以看出,高尿酸造模組TG高于單純高脂組,且降尿酸藥物能顯著降低TG的水平,這可能是由于體內尿酸積聚,影響TG代謝所導致的。當加入高尿酸造模劑后,TG迅速升高,且峰值遠高于單純高脂組,說明短期的高脂飼料飼養并不能造成鵪鶉高甘油三酯血癥,結合高尿酸造模劑反而能有效、迅速地升高血清TG水平。高尿酸造模劑不僅能造成尿酸水平的升高,并能導致脂代謝的紊亂。OGTT實驗表明,高尿酸造模組血糖峰值高,各時間點血糖均明顯高于對照組,且血清中胰島素水平遠高于對照組,由此可見造模組還可能導致糖代謝的紊亂和胰島素抵抗。以上結果表明高脂高嘌呤飲食聯合氧嗪酸鉀能導致尿酸、脂、糖代謝的紊亂,造成類似于人類慢性代謝疾病的病理狀態。
肝、腎相關酶活性測定結果表明,除對照組外各組AST水平顯著提高,高脂組和高脂+造模組ALT水平也明顯升高,但能被苯扎貝特和非布索坦緩解。各組Cr水平無明顯差異,而高脂組和高脂+造模組BUN顯著升高,且藥物干預未能緩解。即造模劑對鵪鶉肝、腎存在一定損傷作用。一般代謝綜合征模型雖然也能造成血脂紊亂,但血管損傷程度較輕[20],其他器官損傷亦不明顯。而本文HE染色結果顯示:肝細胞脂變,腎小球脂質沉積、腎小管空泡變性,主動脈壁脂質沉積,有斑塊形成。以上病變皆與脂質沉積、變性有關,提示尿酸對臟器的損傷很大程度來自于其對脂質代謝的影響,而其中腎臟、動脈損傷明顯。采用苯扎貝特或非布索坦干預后,腎臟病變明顯減輕。苯扎貝特對肝臟和動脈病變的改善作用不明顯。非布索坦干預下,動脈和腎臟的病變得到明顯改善,表明非布索坦具有潛在的動脈和腎保護作用。
本研究采用高脂高嘌呤飲食+ 200 mg/kg氧嗪酸鉀聯合誘導建立了一種簡便、穩定、持久的近似慢性代謝綜合征動物模型,為研究高尿酸與高糖脂血癥的相互關系和代謝綜合癥的新藥開發提供了基礎。但由于鵪鶉血壓難以測定,因此,建立更為全面的代謝綜合癥模型還需進一步完善。
參考文獻:
[1]Alberti KG, Zimmet P, Shaw J. Metabolic syndrome—a new world-wide definition. A Consensus Statement from the International Diabetes Federation [J]. Diabetic medicine : a journal of the British Diabetic Association, 2006,23(5):469-480.
[2]牛利, 韓德五, 許瑞齡, 等. 高糖高脂飲食誘導大鼠代謝綜合征模型并發阿爾茨海默樣變 [J]. 中國比較醫學雜志, 2015,25(8):27-30.
[3]Zhang Q, Zhang C, Song X,etal. A longitudinal cohort based association study between uric acid level and metabolic syndrome in Chinese Han urban male population [J]. BMC public health, 2012,12(1):419.
[4]Li C, Hsieh MC, Chang SJ. Metabolic syndrome, diabetes, and hyperuricemia [J]. Current opinion in rheumatology, 2013,25(2):210-216.
[5]Nakagawa T, Hu H, Zharikov S,etal. A causal role for uric acid in fructose-induced metabolic syndrome [J]. American Journal of Physiology-Renal Physiology, 2006,290(3):F625-F631.
[6]Wu X, Muzny DM, Lee CC,etal. Two independent mutational events in the loss of urate oxidase during hominoid evolution [J]. Journal of molecular evolution, 1992,34(1):78-84.
[7]徐立, 時樂. 小鼠代謝性高尿酸血癥模型的復制方法初探 [J]. 中國比較醫學雜志, 2006,16(1):1-4.
[8]Vaziri N, Freel RW, Hatch M. Effect of chronic experimental renal insufficiency on urate metabolism [J]. Journal of the American Society of Nephrology, 1995,6(4):1313-1317.
[9]胡健萍, 閆熙, 楊志偉, 等. 飲食誘導代謝綜合征小鼠模型的建立 [J]. 中國比較醫學雜志, 2009,19(6):34-38,插34.
[10]張冰. 鵪鶉高尿酸血癥模型建立初探 [J]. 中國病理生理雜志, 2001,17(10):1038-1040.
[11]牛艷芬, 高麗輝, 劉旭, 等. 芒果苷對氧嗪酸鉀所致慢性高尿酸血癥大鼠尿酸及肝腎功能的影響 [J]. 中國藥理學通報, 2012, 28(11):1578-1581.
[12]Panchal SK, Poudyal H, Iyer A,etal. High-carbohydrate high-fat diet-induced metabolic syndrome and cardiovascular remodeling in rats [J]. Journal of cardiovascular pharmacology, 2011,57(1):51-64.
[13]Goodman CC, Fuller KS,Pathology:Implicationsforthephysicaltherapist. 2013: Elsevier Health Sciences.
[14]Kassi E, Pervanidou P, Kaltsas G,etal. Metabolic syndrome: definitions and controversies [J]. BMC medicine, 2011,9(1):48.
[15]Ito H, Abe M, Mifune M,etal. Hyperuricemia is independently associated with coronary heart disease and renal dysfunction in patients with type 2 diabetes mellitus [J]. PloS one, 2011,6(11):e27817.
[16]Yang T, Chu C-H, Bai C-H,etal. Uric acid level as a risk marker for metabolic syndrome: a Chinese cohort study [J]. Atherosclerosis, 2012,220(2):525-531.
[17]TSUDZUKI M. Excalfactoria quail as a new laboratory research animal [J]. Poultry science, 1994,73(6):763-768.
[18]Ohta Y, Kawano Y, Iwashima Y,etal. Effect of bezafibrate on office, home and ambulatory blood pressure in hypertensive patients with dyslipidemia [J]. Journal of Human Hypertension, 2013,27(7):417-420.
[19]Keenan RT, Pillinger M. Febuxostat: a new agent for lowering serum urate [J]. Drugs of today (Barcelona, Spain: 1998), 2009,45(4):247-260.
[20]楊麗霞, 黃宗濤, 劉銅華, 等. 代謝性疾病實驗動物模型的建立與評價 [J]. 中國實驗動物學報, 2009,17(04):318-320.
〔修回日期〕2015-12-25
[作者簡介]張燕(1990-),女,碩士生,專業:藥理學。 [通訊作者]巫冠中(1956-),男,教授,研究方向:內分泌藥理。E-mail: wwbsabc@163.com。
【中圖分類號】R-332
【文獻標識碼】A
【文章編號】1671-7856(2016) 01-0058-07
doi:10.3969.j.issn.1671.7856. 2016.001.011
High fat high purine diet combined oteracil potassium induced quail glucose and lipid metabolic disorders and complications
ZHANG Yan, MA Ling-man, Sarah Wambui Amadi, WU Guan-zhong
(Department of Pharmacology, China Pharmaceutical University, Nanjing 210009, China)
【Abstract】ObjectiveTo establish a practical animal model of chronic metabolic syndrome (MS) and to investigate the correlation and pathological mechanism between hyperuricemia and glucose/lipid metabolism. Methods High fat purine diet + oteracil potassium were used to establish the MS model. Quail serum uric acid and triglyceride were tested every one/two weeks and other parameters were determined at the end of the procedure along with histopathology examination. ResultsUric acid and triglyceride levels in serum were markedly enhanced by the long-term stimulation of high fat purine diet + oteracil potassium. Glucose tolerance test showed that the peak value of glucose and the area under curve in model group were higher than the others, as well as the insulin levels. Meanwhile, the modeling agents increased aspartate aminotransferase, alanine aminotransferase, blood urea nitrogen, creatinine and induced liver, kidney and artery injuries. These injuries were partially alleviated by bezafibrate or febuxostat. ConclusionsThe results of the present study suggest that high fat purine diet + oteracil potassium could induce a simple, stable and durable animal model of chronic metabolic disorders.
【Key words】Hyperuricemia; Quail; Hyperlipidemia; Hyperinsulinemia

