基于c-Met激酶的小分子抑制劑研究進展
李麗麗, 艾曉杰
(1.上海交通大學農業與生物學院,上海市獸醫生物技術重點實驗室,上海 200240;2.上海美迪西生物醫藥股份有限公司,上海 201299)
?
基于c-Met激酶的小分子抑制劑研究進展
李麗麗1,2, 艾曉杰1*
(1.上海交通大學農業與生物學院,上海市獸醫生物技術重點實驗室,上海 200240;2.上海美迪西生物醫藥股份有限公司,上海 201299)
摘要HGF/c-Met信號通路在腫瘤的發生、發展和轉移中起著重要的調節作用,成為抗腫瘤藥物研發的熱門靶點。介紹了c-Met 信號通路的作用機制以及c-Met 抑制劑的研究進展,以期能夠找到一類腫瘤抑制活性高、選擇性好、副作用小的抑制劑,為癌癥治療提供新的途徑。
關鍵詞受體酪氨酸激酶;c-Met;小分子抑制劑;抗腫瘤
據世界衛生組織統計,2012年全球癌癥新發生病例約為1 400萬,預計未來20年將升至2 200萬/a,估計死亡數由820萬/a上升到1 300萬/a。近年來,酪氨酸激酶家族在癌癥研究中受到更多的關注,HGF/c-Met 信號通路在胚胎形成、創傷愈合以及組織再生中起重要作用,但在多種癌癥中,c-Met 顯示出異常的活性,并與基因突變、擴增和重組相伴發生。高表達的c-Met 還與腫瘤治療的耐藥性、愈后情況差以及癌細胞的轉移密切相關。因此,c-Met 抑制劑研究已成為腫瘤治療領域的熱門靶點。筆者簡要介紹了HGF/c-met信號通路的作用機制以及c-Met小分子抑制劑的研究進展,以期能夠找到一類腫瘤抑制活性高、選擇性好、副作用小的抑制劑,為癌癥治療提供新的途徑。
1HGF/c-Met的結構特點
1.1蛋白激酶(Protein Kinases)蛋白激酶是體內調節細胞生長和分化、器官形成和形態功能發生、心血管生長、組織修復和再生等的一組酶。蛋白激酶通過催化蛋白質的磷酸化,進而調節細胞活性,來完成生理功能[1]。目前,由人類基因編碼的蛋白激酶超過518種,它們大多與癌癥密切相關[2]。
1.2受體型酪氨酸激酶(RTKs)蛋白激酶可分為受體型和非受體型。受體型酪氨酸激酶(RTKs)結構包含胞外部分、跨膜區域和胞內部分,而非受體型酪氨酸激酶只有胞內部分。c-Met、Ron和Sea,是受體酪氨酸激酶[2]。非受體酪氨酸激酶也有很多亞型,包括Src、Btk、Abl、Fak和Jak等[4]。其中,c-Met作為受體酪氨酸激酶不僅在惡性腫瘤中高表達,與腫瘤細胞的生長、侵襲、轉移和凋亡相關,而且還與多種膜受體相互作用,影響信號通路,因此,c-Met激酶作為抗腫瘤藥物的靶點研究備受關注。
1.3受體酪氨酸激酶c-Met的結構c-Met激酶是由50 ku的α鏈和145 ku的β鏈通過二硫鍵連接,組成異質二聚體,分為胞外域、跨膜螺旋結構區和胞內域(圖1a)。胞外域包含3個不同的功能區:覆蓋整個α鏈和部分β鏈的N-端sema區(氨基酸殘基25~514),有4個二硫鍵的胱氨酸富集域(PSI)(氨基酸殘基515~561)和4個免疫球蛋白區域(IPT,氨基酸殘基562~922)。在螺旋結構的跨膜區域(氨基酸殘基923~956)之后,胞內域(氨基酸殘基957~1 390)也由3個調控區組成,包括有Tyr1003磷酸位點(下調激酶活性)的近膜結構域,有Tyr1234和Tyr1235磷酸化位點(活化激酶活性)的催化結構域,以及有Tyr1349和Tyr1356的C-末端多功能結合區域(向下游募集信號轉導)[5]。
1.4肝細胞生長因子(HGF)肝細胞生長因子也被稱作分散因子(SF),是唯一已知高親和性的c-Met配體。前HGF(pro-HGF)在間質細胞源中合成,呈單鏈的非活性結構,在絲氨酸蛋白酶催化下,pro-HGF會轉變成二硫鍵相連的α-β雙鏈異質二聚體結構的HGF。活化的HGF會被抑制因子HAI1和HAI2抑制,從而處于平衡狀態。HGF分子結構包含6個區域,分別是N-末端區(Hairpin loop),α鏈上的4個環狀結構區(K1~K4),β鏈上的絲氨酸蛋白同化區(SPH)[6](圖1b)。
2HGF/c-Met信號通路的作用機制
HGF在細胞外域與c-Met結合后,誘導c-Met發生二聚化,進而在催化結構域的Tyr1234和Tyr1235 2個位點發生磷酸化,刺激C-末端多功能結合區域的Tyr1349和Tyr1356自動磷酸化,從而募集多種細胞間質因子,如GAB1、GAB2、PLC和SRC,進一步吸引SHP2、PI3K、CRKL等對接分子,由此激活RAS/MAPK、PI3K/ALK、JAK/STAT等信號通路,從而調控細胞的生長、增殖、遷移、存活和凋亡[7](圖2)。
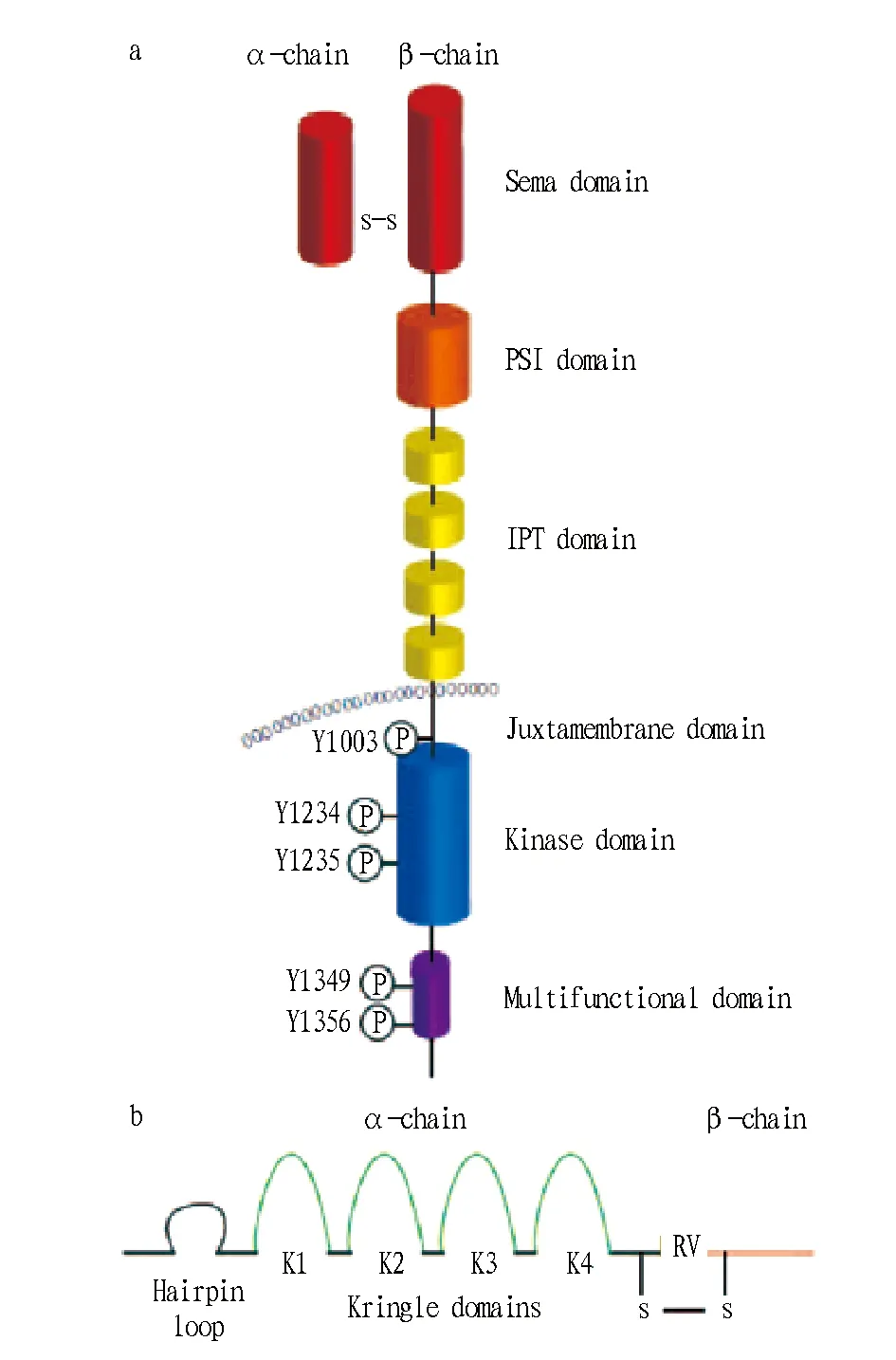
圖1 受體酷氨酸激酶c-Met的結構(a)和肝細胞生長因子的結構(b)Fig.1 Structures of receptor tyrosine kinase c-Met (a) and hepatocyte growth factor (b)
在生理環境下,細胞表面的Met通過胞外脫落、胞內清除和泛素介導的降解等調節方式有效得到控制,發揮正常的生理功能,避免過度表達[8]。但在多種惡性腫瘤中均發現Met激酶的異常激活。Met的過度活化,不僅引起腫瘤的發生、發展和轉移,還與抗腫瘤治療的耐藥性緊密相關,因此,對HGF/c-Met信號通路抑制劑的研究具有重要意義。
3小分子c-Met抑制劑的類型
基于HGF/c-Met信號通路的抑制劑,根據作用機制和結構不同,包括以下4類:HGF拮抗劑(NK2和NK4)、抗HGF抗體(Ficlatuzumab(AV-299),Rilotumumab(AMG102),TAK701(HuL2G7))、抗c-Met單克隆抗體(Onartuzumab (OA5D5) )和小分子c-Met抑制劑。根據化學結構和與激酶對接的作用位點不同,小分子c-Met抑制劑分為三大類。
3.1選擇性c-Met抑制劑該類c-Met抑制劑在激酶口袋中與c-Met的結合呈U型構象,包圍Met1121殘基,結合在鉸鏈區。由于該類抑制劑的結構與激酶構象吻合度高,對其他酪氨酸激酶靶點抑制作用較小,故其選擇性較好。
選擇性抑制劑中,克唑替尼(Crizotinib,PF02341066)是目前唯一已上市的針對c-Met和ALK的靶點藥物,由Pfizer公司研發,IC50分別是11和24 nmol/L。體外試驗表明,克唑替尼能有效地抑制Met激酶的磷酸化,進而抑制Met依賴的腫瘤細胞的增殖、遷移和侵襲[9]。2013年11月20日,FDA批準了其用于淋巴瘤激酶陽性的晚期和轉移的非小細胞肺癌的治療。
Capmatinib(INCB28060)是由Novartis/Incyte公司研發的ATP競爭性c-Met抑制劑,IC50=0.13 nmol/L,對RONβ、EGFR和HER-3無活性,用于多種實體瘤的治療,已完成Ⅱ期臨床試驗[10]。
Amgen 公司研發的化合物AMG-208對c-Met具有高度選擇性,IC50為9 nmol/L,計算機模擬結果顯示,三唑并噠嗪環與Met的Tyr1230相互作用,喹啉環以及連接臂中的氧原子與蛋白形成氫鍵作用。AMG-208處于Ⅰ期臨床試驗中[11]。
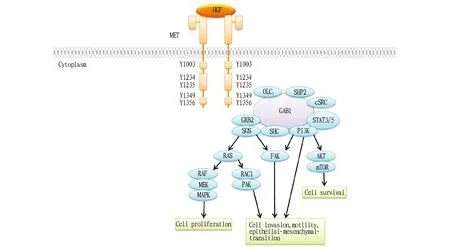
圖2 HGF/c-Met信號通路的作用機制Fig.2 HGF/c-Met signaling pathway and action mechanism
在AMG-208結構的基礎上,Amgen公司根據電子等排原理,進一步研發出化合物AMG-337。將連接臂中的氧原子換成氮原子,喹啉環替換成[1,5]二氮雜萘,使之形成分子內氫鍵,很好地解決了分子對CYP3A4酶的時間依賴性抑制問題。同時,將苯環替換成噻唑環,改善了整個分子的成藥性。該化合物目前處于臨床Ⅱ期研究中,主要用于治療胃癌和食道癌[12]。
另外,化合物PF-04217903和PF-04254644均是由Pfizer公司研發的選擇性c-Met激酶抑制劑,Ki分別是5.0 和10.3 nmol/L。體外對208種不同激酶進行篩選,2個化合物均表現出高度選擇性,體內試驗也證明,這2個化合物能有效地抑制腫瘤的生長,且口服的PK數據良好。但化合物PF-04254644是強烈的磷酸二酯酶抑制劑,大鼠試驗結果表明,該化合物會導致心率加快,心輸出量增加,收縮性指數降低和心肌變性。由此,其在Ⅰ期臨床試驗中被終止[13]。
類似的2種化合物,JNJ-38877605(IC50=4.0 nmol/L)和SGX-523[14](Ki=2.7 nmol/L)體外試驗也表現出很好的激酶活性,但在Ⅰ期臨床試驗中,化合物JNJ-38877605藥效較差,且在患者體內發現肌酐水平增加,化合物SGX-523出現腎臟毒性,因此,這2個化合物也終止了臨床研究。
3.2非選擇性c-Met抑制劑非選擇性c-Met抑制劑可作用于多個靶點,選擇性較差,但作用范圍更廣。從結構上看也更為舒展,基本呈長鏈狀,分子量較大,疏水性強。
由Exelixis公司研發的Cabozantinib(XL184)是目前唯一上市的非選擇性抑制劑,對c-Met、VEGFR-2、Ret、Kit、AXL等多種激酶有抑制作用,c-Met激酶的IC50為1.3 nmol/L,VEGFR-2的IC50為0.035 nmol/L。體內試驗表明,該化合物能有效地抑制c-Met和VEGFR-2的磷酸化,從而達到治療腫瘤轉移和抗血管生成的目的。2012年11月29日, FDA批準Cabozantinib用于不可手術切除的惡性局部晚期或轉移性甲狀腺髓樣癌的治療[15]。
Exelixis公司還開發了針對多種激酶有抑制作用的Foretinib,c-Met激酶的IC50為0.4 nmol/L,VEGFR-2的IC50為0.86 nmol/L。和激酶的共晶模型顯示,化合物與激酶結合緊密,占據了ATP口袋和疏水空腔,環丙基二酰胺側鏈上的2個氧原子分別與Lys1110和Asp1222形成氫鍵[16]。目前,該化合物處于臨床Ⅱ期試驗中,主要針對乳腺癌和胃癌的治療。
與以上結構類似,日本衛材公司研發的化合物Golvatinib(E7050),c-Met激酶的IC50為14 nmol/L,VEGFR-2的IC50為16 nmol/L[17],目前正處于Ⅰ期/Ⅱ期臨床階段。MethylGene公司研發的化合物MGCD-265,能有效地抑制c-Met、VEGFR-2和RON,IC50分別是1、3、2 nmol/L[18],目前處于Ⅰ期/Ⅱ期臨床階段。
在保留二酰胺結構的基礎上,引入并環,Bristol-Myers-Squibb公司得到化合物BMS-777607(c-Met的IC50為3.9 nmol/L)[19],目前處于Ⅱ期臨床階段。Lilly公司研發的化合物LY-2801653對c-Met的Ki為2 nmol/L[20],處于Ⅱ期臨床試驗階段。
3.3其他結構的c-Met抑制劑Tivantinib(ARQ-197)是由美國ArQule公司與日本第一三共制藥聯合研發,屬于非ATP競爭的新型小分子c-Met激酶抑制劑,對c-Met具有高度選擇性,而對Ron幾乎無活性,對EGFR、InsR、PDGFRα和FGFR1/4無抑制作用。在MDA-MB-231和NCI-H411細胞系中,對HGF誘導的c-Met磷酸化有較強抑制作用,IC50為100~300 nmol/L。另外,Tivantinib對微管蛋白聚合有抑制作用,擾亂微管蛋白代謝,延長G2/M 期,增加細胞凋亡[21]。
Merck公司研發的全新結構的多靶點激酶抑制劑MK-2461,屬于ATP競爭性抑制劑,對c-Met、RON、FLT1/3/4、FGFR1/2/3、VEGFR2和TRKA/B等激酶均具有抑制活性[22]。其中,對c-Met的IC50為2 nmol/L,目前已完成Ⅰ期臨床試驗,主要針對晚期實體瘤的治療。
4結論
HGF/c-Met信號通路在腫瘤的生長、侵襲、轉移和凋亡中起重要作用,隨著研究的不斷深入,人們對該信號通路致病機制的認識也愈加清晰,同時一批作用于該信號通路的化學藥物和生物藥物也正于研發之中,且已經有2個小分子c-Met 抑制劑成功上市并應用于臨床,顯示HGF/c-Met信號通路具有良好的開發價值和市場潛力。c-Met靶點也面臨著一些問題,如c-Met基因突變和基因擴增的發生頻率相對較低,c-Met抑制劑只能對部分患者產生應答,腫瘤治療中的耐藥性與c-Met活化之間的關系,c-Met抑制劑和其他激酶抑制劑聯合用藥的問題,c-Met抑制劑聯合化療和放療用藥的問題。隨著HGF/c-Met信號通路的不斷研究,一定能夠找到一類腫瘤抑制活性高、選擇性好、副作用小的抑制劑,以期為癌癥治療提供新的途徑。
參考文獻
[1] BLUME-JENSEN P,HUNTER T.Oncogenic kinase signaling[J].Nature,2001,411(6835):355-365.
[2] MANNING G,WHYTE D B,MARTINEZ R,et al.The protein kinase complement of the human genome[J].Science,2002,298(5600):1912-1934.
[3] LEMMON M A,SCHLESSINGER J.Cell signaling by receptor tyrosine kinases[J].Cell,2010,141(7):1117-1134.
[4] BOLEN J B.Nonreceptor tyrosine protein kinases[J].Oncogene,1993,8(8):2025-2031.
[5] GHERARDI E,YOULES M E,MIGUEL R N,et al.Functional map and domain structure of MET,the product of the MET proto-oncogene and receptor for hepatocyte growth factor/scatter factor[J].Proc Nati Acad Sci USA,2003,100(21):12039-12044.
[6] BASILICO C,ARNESANO A,GALLUZZO M,et al.A high affinity hepatocyte growth factor-binding site in the immunoglobulin-like region of MET[J].J Biol Chem,2008,283(30):21267-21277.
[7] EDER J P,VANDE WOUDE G F,BOERNER S A,et al.Novel therapeutic inhibitors of the c-Met signaling pathway in cancer[J].Clin Cancer Res,2009,15(7):2207-2214.
[8] MOSESSON Y,MILLS G B,YARDEN Y.Derailed endocytosis:An emerging feature of cancer[J].Nat Rev Cancer,2008,8(11):835-850.
[9] CUI J J,TRAN-DUBEé M,SHEN H,et al.Structure based drug design of crizotinib (PF-02341066),a potent and selective dual inhibitor ofmesenchymal-epithelial transition factor (MET) kinase and anaplastic lymphoma kinase (ALK)[J].J Med Chem,2011,54(18):6342-6363.
[10] LIU X,WANG Q,YANG G,et al.A novel kinase inhibitor,INCB28060,blocks MET-dependent signaling,neoplastic activities,and cross-talk with EGFR and HER-3[J].Clin Cancer Res,2011,17(22):7127-7138.
[11] ALBRECHT B K,HARMANGE J C,BAUER D,et al.Discovery and optimization of triazolo- pyridazines as potent and selective inhibitors of the MET kinase[J].J Med Chem,2008,51(10):2879-2882.
[12] BOEZIO A A,BERRY L,ALBRECHT B K,et al.Discovery and optimization of potent and selective triazolopyridazine series of MET inhibitors[J].Bioorg Med Chem Lett,2009,19(22):6307-6312.
[13] CUI J J,SHEN,H,TRAN-DUBEé M,et al.Lessons from (S)-6-(1-(6-(1-methyl-1H pyrazol-4-yl)-[1,2,4]triazolo[4,3-b]pyridazin-3-yl)ethyl)quinoline (PF-04254644),an inhibitor of receptor tyrosine kinase c-Met with high protein kinase selectivity but broad phosphodiesterase family inhibition leading to myocardial degeneration in rats[J].J Med Chem,2013,56(17):6651-6665.
[14] BUCHANAN S G,HENDLE J,LEE P S,et al.SGX523 is an exquisitely selective,ATP competitive inhibitor of the MET receptor tyrosine kinase with antitumor activity in vivo[J].Mol Cancer Ther,2009,8(12):3181-3190.
[15] FUJIWARA Y,MIWA A,NAKAMURA K,et al.Quinoline derivative and quinazoline derivative inhibiting self-phosphorylation of hepatocytus proliferator receptor,and medicinal composition containing the same:US,8324245B2[P].2012-12-04.
[16] QIAN F,ENGST S,YAMAGUCHI K,et al.Inhibition of tumor cell growth,invasion,and metastasis by EXEL-2880 (XL880,GSK1363089),a novel inhibitor of HGF and VEGF receptor tyrosine kinases[J].Cancer Res,2009,69(20):8009-8016.
[17] NAKAGAWA T,TOHYAMA O,YAMAGUCHI A,et al.E7050:A dual MET and VEGFR-2 tyrosine kinase inhibitor promotes tumor regression and prolongs survival in mouse xenograft models[J].Cancer Sci,2010,101(1):210-215.
[18] BONFILS C,BEAULIEU N,FOURNEL M,et al.The combination of MGCD265,a MET/VEGFR inhibitor in clinical development,and erlotinib potently inhibits tumor growth by altering multiple pathways including glycolysis[J].Cancer Res,2012,72:1790.
[19] SCHROEDER G M,AN Y,CAI Z W,et al.Discovery of N-(4-(2-amino-3-chloro-pyridine- 4-yloxy)-3-fluorophenyl)-4-ethoxy-1-(4-fluorophenyl)-2-oxo-1,2-dihydro-pyridine-3-carboxamide(BMS-777607),a selective and orally efficacious inhibitor of the MET kinase superfamily[J].J Med Chem,2009,52(5):1251-1254.
[20] YAN S B,VICTORIA L P,ROSE A,et al.LY2801653 is an orally bioavailable Multi-kinase inhibitor with potent activity against MET,MST1R,and other oncoproteins,and displays anti-tumor activities in mouse xenograft models[J].Invest New Drugs,2013,31(4):833-844.
[21] BASILICO C,PENNACCHIETTI S,VIGNA E,et al.Tivantinib(ARQ197) displays cytotoxic activity that is independent of its ability to bind MET[J].Clin Cancer Res,2013,19(15):2381-2392.
[22] PAN B S,CHAN G K,CHENARD M,et al.MK-2461,a novel multitargeted kinase inhibitor,preferentially inhibits the activated MET receptor[J].Cancer Res,2010,70(4):1524-1533.
作者簡介李麗麗(1985- ),女,廣東云浮人,助理實驗師,從事抗腫瘤藥效研究。*通訊作者,副教授,從事實驗動物模型研究。
收稿日期2016-03-21
中圖分類號R 979.1
文獻標識碼A
文章編號0517-6611(2016)13-153-04
Research Progress of Small Molecule Inhibitor Based on c-Met Kinase
LI Lili1,2, AI Xiao-jie1*
(1.College of Agriculture and Biology Science, Shanghai Jiao Tong University/Shanghai Key Laboratory of Veterinary Biotechnology, Shanghai 200240:2.Shanghai Medicilon Bio-pharmaceutical Co., Ltd., Shanghai 201299)
AbstractThe HGF/c-Met signaling pathway plays important regulating roles in tumorigenesis, tumor development and transfer, which has become the popular target for the research on antitumor drug.We reviewed the research progress of the action mechanism of c-Met signaling pathway and the c-Met inhibitor, aiming at finding an inhibitor with high activity, good selectivity and small side effect, and offering new approach for cancer therapy.
Key wordsReceptor tyrosine kinases (RTKs):c-Met:Small molecule inhibitor:Anti-tumor

