大孔吸附樹脂-聚酰胺聯(lián)用純化茅巖莓總黃酮工藝優(yōu)化
金慧鳴,郭紅英,譚興和*,劉夢浩,王 鋒,蔡 文,張 喻,鄧潔紅(湖南農(nóng)業(yè)大學(xué)食品科技學(xué)院,食品科學(xué)與生物技術(shù)湖南省重點(diǎn)實(shí)驗(yàn)室,湖南 長沙 410128)
?
大孔吸附樹脂-聚酰胺聯(lián)用純化茅巖莓總黃酮工藝優(yōu)化
金慧鳴,郭紅英,譚興和*,劉夢浩,王 鋒,蔡 文,張 喻,鄧潔紅
(湖南農(nóng)業(yè)大學(xué)食品科技學(xué)院,食品科學(xué)與生物技術(shù)湖南省重點(diǎn)實(shí)驗(yàn)室,湖南 長沙410128)
摘 要:為純化茅巖莓總黃酮,先用HPD-100型大孔吸附樹脂(macroporous adsorption resin,MAR)層析柱進(jìn)行初步純化,再用聚酰胺(polyamide,PA)層析柱進(jìn)行第2次純化,得到的HPD-100型MAR最適宜吸附工藝參數(shù)為上樣液總黃酮質(zhì)量濃度6 mg/mL、上樣流速1 mL/min、上樣液體積130 mL,在此條件下吸附率為97.14%;最適宜解吸工藝參數(shù)為洗脫液乙醇體積分?jǐn)?shù)70%、洗脫流速1 mL/min、洗脫液體積40 mL,在此條件下解吸率為94.10%。經(jīng)HPD-100型MAR純化后的總黃酮純度從55.00%提高到了72.25%。PA的最適宜吸附工藝參數(shù)為上樣液總黃酮質(zhì)量濃度6 mg/mL、上樣流速2 mL/min,在此條件下吸附率為99.57%;最適宜解吸工藝參數(shù)為洗脫液乙醇體積分?jǐn)?shù)70%、洗脫流速1 mL/min、洗脫液體積55 mL,在此條件下解吸率為76.50%。經(jīng)PA純化后總黃酮純度從72.25%提高到了80.75%。該方法為茅巖莓黃酮的純化提供了一種更高效的方法,具有良好的應(yīng)用前景。
關(guān)鍵詞:茅巖莓;總黃酮;大孔吸附樹脂;聚酰胺;純化
引文格式:
金慧鳴, 郭紅英, 譚興和, 等. 大孔吸附樹脂-聚酰胺聯(lián)用純化茅巖莓總黃酮[J]. 食品科學(xué), 2016, 37(12): 13-18.
JIN Huiming, GUO Hongying, TAN Xinghe, et al. Purification of total flavonoids from Ampelopsis grossedentata by combined use of macroporous adsorption resin and polyamide[J]. Food Science, 2016, 37(12): 13-18. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201612003. http://www.spkx.net.cn
茅巖莓,學(xué)名顯齒蛇葡萄(Ampelopsis grossedentata),系葡萄科蛇葡萄屬的一種野生藤本植物,其干燥的葉片黃酮類化合物含量極高,最高可達(dá)干質(zhì)量的45%左右,具有抗氧化、抑菌、降血糖、降血脂、保肝護(hù)肝的功效[1-4]。其中,總黃酮中含量最高的是二氫楊梅素,最新研究證明其具有抑制乳腺癌細(xì)胞和前列腺癌細(xì)胞增殖的作用[5-7]。隨著人們對黃酮保健作用認(rèn)識的加強(qiáng),茅巖莓黃酮的利用越來越得到重視。
近年來,大孔吸附樹脂(macroporous adsorption resin,MAR)被廣泛用于化學(xué)和醫(yī)藥行業(yè)中,尤其是植物粗提物中生物活性物質(zhì)的提取純化分離,它具有操作成本低、溶劑耗費(fèi)少、工作強(qiáng)度小、容易再生等優(yōu)點(diǎn)[8-11]。聚酰胺(polyamide,PA)是一種以酰胺鍵聚合形成的高分子化合物,主要通過氫鍵之間相互作用的親和力進(jìn)行吸附[12-13],其對黃酮化合物有很強(qiáng)的吸附性能,且分離和脫色效果好,可以彌補(bǔ)MAR的一些不足。本研究試圖通過MAR與PA聯(lián)用,確定純化茅巖莓總黃酮的工藝參數(shù),旨在為茅巖莓總黃酮的純化提供一種更高效的方法。
1 材料與方法
1.1材料與試劑
干茅巖莓葉(用中藥粉碎機(jī)將其粉碎,過120 目篩,裝入密封袋備用)張家界茅巖莓公司;二氫楊梅素標(biāo)準(zhǔn)品(色譜級,純度≥99%)成都曼思特生物科技有限公司;HPD-100型MAR鄭州勤實(shí)科技有限公司;PA粉(80~100 目)、無水乙醇(分析純)、三氯化鋁(分析純)國藥集團(tuán)化學(xué)試劑有限公司;氫氧化鈉(分析純)天津市風(fēng)船化學(xué)試劑科技有限公司;鹽酸(分析純)衡陽市凱倍化工試劑有限公司。
1.2儀器與設(shè)備
FW177中草藥粉碎機(jī)天津市泰斯特儀器有限公司;KQ-250DE超聲波清洗器昆山市超聲儀器有限公司;RE-2000B旋轉(zhuǎn)蒸發(fā)器、SHZ-D(Ⅲ)循環(huán)水式真空泵鞏義市予華儀器有限公司;FD-1B真空冷凍干燥機(jī)北京博醫(yī)康實(shí)驗(yàn)儀器有限公司;SKY-200B氣浴搖床上海蘇坤實(shí)業(yè)有限公司;UV-2450紫外-可見分光光度儀、ATX224電子分析天平日本島津公司;DENVER電子天平北京賽多利斯儀器有限公司;100、1 000、5 000 μL移液槍艾本德(中國)有限公司。
1.3方法
1.3.1茅巖莓黃酮含量的測定
采用紫外分光光度法[14]并做適當(dāng)改進(jìn)。精密稱取1.8 mg二氫楊梅素標(biāo)準(zhǔn)品于10 mL容量瓶里,用95%乙醇溶液定容;再從中準(zhǔn)確吸取0、0.4、0.8、1.2、1.6、2.0、2.4 mL于25 mL容量瓶中,分別加入3 mL質(zhì)量分?jǐn)?shù)5%的AlCl3溶液,用95%乙醇溶液定容到刻度,搖勻,配制成質(zhì)量濃度分別為0、0.002 88、0.005 76、0.008 64、0.011 52、0.014 40、0.017 28 mg/mL的二氫楊梅素標(biāo)準(zhǔn)溶液,在室溫放置40 min,于紫外分光光度計(jì)296 nm波長處測定吸光度。以二氫楊梅素質(zhì)量濃度C為橫坐標(biāo)、吸光度A為縱坐標(biāo)繪制茅巖莓總黃酮標(biāo)準(zhǔn)曲線,并通過線性回歸得到回歸方程:A=48.090 3C-0.000 8,R2=0.999 8。
1.3.2MAR的預(yù)處理
按照文獻(xiàn)[15]進(jìn)行預(yù)處理,處理完后置于蒸餾水中備用。
1.3.3PA的預(yù)處理
按照文獻(xiàn)[16]進(jìn)行預(yù)處理,處理完后置于蒸餾水中備用。
1.3.4MAR上樣液的制備
上樣液制備流程:茅巖莓粉→加入乙醇溶液→超聲波輔助乙醇法提取→過濾→旋轉(zhuǎn)蒸發(fā)成浸膏狀→冷凍干燥→加蒸餾水配制成不同質(zhì)量濃度總黃酮溶液(超聲波助溶)→備用。
提取條件為:乙醇體積分?jǐn)?shù)67%、超聲波處理溫度58 ℃、超聲波處理時(shí)間28 min、液料比22.5∶1(mL/g)[17]。
1.3.5MAR動(dòng)態(tài)吸附與解吸工藝參數(shù)的確定
取2 0 m L已處理好的M A R濕法裝入層析柱(Φ18 mm×300 mm)中,再將茅巖莓總黃酮溶液上柱,待總黃酮溶液通過樹脂柱后,用大約4~5 BV (1 BV=20 mL)蒸餾水沖洗樹脂柱,最后用乙醇溶液進(jìn)行洗脫。通過測定吸附液和洗脫液中總黃酮質(zhì)量濃度并計(jì)算吸附率和解吸率,考察上樣液總黃酮質(zhì)量濃度、上樣流速、上樣液體積以及洗脫液體積分?jǐn)?shù)、洗脫流速、洗脫液體積對MAR性能的影響,確定最適宜工藝參數(shù)。
1.3.6PA動(dòng)態(tài)吸附與解吸工藝參數(shù)的確定
取經(jīng)MAR最適宜工藝參數(shù)吸附和洗脫處理的總黃酮溶液,測得洗脫液中總黃酮的質(zhì)量,通過旋轉(zhuǎn)蒸發(fā)儀去除有機(jī)溶劑,再加入水溶液配制成不同總黃酮質(zhì)量濃度的溶液作為上樣液,備用。量取20 mL已處理好的PA濕法裝入層析柱(Φ18 mm×300 mm)中,將上樣液通過PA柱進(jìn)行吸附,考察上樣液總黃酮質(zhì)量濃度和上樣流速對PA性能的影響,再用4~5 BV蒸餾水沖洗,然后分別用體積分?jǐn)?shù)為30%、50%、70%、90%的乙醇溶液以1 mL/min進(jìn)行洗脫,每流出5 mL流出液收集并測定總黃酮質(zhì)量濃度,并以洗脫液體積為橫坐標(biāo)、流出液中總黃酮質(zhì)量濃度為縱坐標(biāo)繪制動(dòng)態(tài)洗脫曲線,從而確定最適宜的洗脫液體積和乙醇體積分?jǐn)?shù)。最后考察不同洗脫流速對PA性能的影響。
1.3.7吸附率和解吸率的計(jì)算
通過測定上樣液、吸附液和洗脫液中總黃酮的質(zhì)量濃度來計(jì)算吸附率和解吸率,如式(1)、(2)所示:


式中:C0為上樣液總黃酮質(zhì)量濃度/(mg/mL);C1為吸附液總黃酮質(zhì)量濃度/(mg/mL);C2為洗脫液總黃酮質(zhì)量濃度/(mg/mL);V1為上樣液體積/mL;V2為洗脫液體積/mL。
1.3.8總黃酮純度的測定
分別將MAR和PA的洗脫液置于旋轉(zhuǎn)蒸發(fā)儀中濃縮成浸膏狀,再冷凍干燥成粉末。準(zhǔn)確稱取適量總黃酮粉,用95%乙醇溶液溶解,用1.3.1節(jié)方法測定溶液中總黃酮質(zhì)量濃度,從而計(jì)算樣品中黃酮純度,如式(3)所示:

式中:C為溶液中總黃酮質(zhì)量濃度/(mg/mL);V為溶解總黃酮粉所用的乙醇溶液體積/mL;m為稱取的總黃酮粉質(zhì)量/g。
2 結(jié)果與分析
2.1MAR動(dòng)態(tài)吸附與解吸工藝參數(shù)的確定
2.1.1上樣液總黃酮質(zhì)量濃度對吸附效果的影響
一是著力加強(qiáng)供應(yīng)環(huán)節(jié)管理。建立科學(xué)有效的比價(jià)采購機(jī)制,力求質(zhì)優(yōu)價(jià)廉;建立農(nóng)資品質(zhì)監(jiān)控體系,對采購農(nóng)用物資的名稱、產(chǎn)地、商標(biāo)、數(shù)量等進(jìn)行驗(yàn)證,并委托相關(guān)部門檢驗(yàn)合格后,方可大面積使用;加強(qiáng)采購合同管理和大隊(duì)庫存農(nóng)資的管理。
分別取50 mL總黃酮質(zhì)量濃度為2、4、6、8 mg/mL的上樣液,以上樣流速1 mL/min通過已處理好的MAR,收集吸附后的流出液,測定其總黃酮質(zhì)量濃度并計(jì)算吸附率。

圖1 上樣液總黃酮質(zhì)量濃度對吸附效果的影響Fig. 1 Effect of total flavonoids concentration in sample on the adsorption efficiency
由圖1可知,上樣液總黃酮質(zhì)量濃度較小時(shí)吸附率也較低,2~6 mg/mL范圍內(nèi),吸附率隨著質(zhì)量濃度的增加而增加,上樣液總黃酮質(zhì)量濃度為6 mg/mL時(shí),吸附率達(dá)到最大,繼而又隨著質(zhì)量濃度的增加而降低。這是由于上樣液總黃酮質(zhì)量濃度越高,單位表面積內(nèi)的總黃酮與MAR接觸量越多,吸附量也就越多大[18]。但如果上樣質(zhì)量濃度太大,可能不僅使總黃酮在樹脂中擴(kuò)散能力下降,而且與總黃酮競爭吸附的雜質(zhì)量也隨之增大[19],MAR更容易達(dá)到飽和,使得總黃酮得不到充分吸附,易造成能源浪費(fèi)。所以,最適宜的上樣液總黃酮質(zhì)量濃度為6 mg/mL。
2.1.2上樣流速對吸附效果的影響
取50 mL總黃酮質(zhì)量濃度為6 mg/mL的上樣液分別以上樣流速0.5、1.0、1.5、2.0 mL/min通過已處理好的MAR柱,收集吸附后的流出液,測定其總黃酮質(zhì)量濃度并計(jì)算吸附率。

圖2 上樣流速對吸附效果的影響Fig. 2 Effect of sample flow rate on the adsorption efficiency
由圖2可知,吸附率隨著上樣流速的增加而逐漸下降,但下降趨勢較緩慢。因?yàn)樯蠘右毫魉龠^快,目標(biāo)物來不及被樹脂充分吸附就會(huì)開始泄漏;而上樣流速過慢,目標(biāo)物與樹脂接觸越充分,從而提高M(jìn)AR的吸附量,但會(huì)降低吸附效率[19-20],因此在不影響吸附效率的情況下選擇合適的上樣流速非常重要。綜合考慮吸附效果與工作效率兩個(gè)因素,選擇1 mL/min為最適宜的上樣流速。
2.1.3上樣液體積對吸附效果的影響
取150 mL總黃酮質(zhì)量濃度為6 mg/mL的上樣液分別以上樣流速1 mL/min通過 已處理好的MAR柱,以5 mL為一個(gè)體積單位收集流出液,測定其總黃酮質(zhì)量濃度,并以上樣液體積為橫坐標(biāo)、流出液總黃酮質(zhì)量濃度為縱坐標(biāo)繪制動(dòng)態(tài)吸附曲線,考察上樣液體積對吸附效果的影響。

圖3 動(dòng)態(tài)吸附曲線Fig. 3 Dynamic adsorption curve
從圖3可以看出,上樣液體積0~125 mL時(shí),流出液總黃酮質(zhì)量濃度很低,且基本處于穩(wěn)定平緩的趨勢;當(dāng)上樣液體積繼續(xù)增加到130 mL時(shí),質(zhì)量濃度開始明顯上升;當(dāng)上樣液體積達(dá)到135 mL時(shí),流出液總黃酮質(zhì)量濃度為0.911 mg/mL,已經(jīng)超過上樣液總黃酮質(zhì)量濃度的1/10,故視130 mL為泄漏點(diǎn)[16]。因此,確定上樣液體積為130 mL,經(jīng)計(jì)算吸附率達(dá)97.14%。
取130 mL總黃酮質(zhì)量濃度為6 mg/mL的上樣液以上樣流速1 mL/min通過已處理好的MAR柱,再用4~5 BV蒸餾水以1 mL/min的流速?zèng)_洗MAR柱使流出液為無色透明。分別用50 mL體積分?jǐn)?shù)為30%、50%、70%、90%的乙醇溶液作為洗脫液在1 mL/min的流速條件下進(jìn)行洗脫,收集洗脫液,測定其總黃酮質(zhì)量濃度并計(jì)算解吸率。

圖4 洗脫液體積分?jǐn)?shù)對解吸效果的影響Fig. 4 Effect of eluent concentration on the desorption efficiency
考慮茅巖莓黃酮基本用于食品及醫(yī)藥領(lǐng)域,因此選擇相對安全性較高的乙醇作為洗脫液。由圖4可知,乙醇體積分?jǐn)?shù)30%~70%,解吸率隨著乙醇體積分?jǐn)?shù)的增大而增大;乙醇體積分?jǐn)?shù)為70%時(shí),解吸率最高;之后再增加乙醇體積分?jǐn)?shù),解吸率又隨之降低。這是因?yàn)橐掖俭w積分?jǐn)?shù)不同,極性大小也不同,而黃酮與MAR之間存在著一定的范德華力,兩物質(zhì)的極性越相近則范德華力越大[21]。可能由于70%乙醇溶液與茅巖莓黃酮的極性更為接近,因此最容易被洗脫下來,故選擇70%為最適宜的洗脫液乙醇體積分?jǐn)?shù)。
2.1.5洗脫流速對解吸效果的影響

圖5 洗脫流速對解吸效果的影響Fig. 5 Effect of elution velocity on the desorption efficiency
取130 mL總黃酮質(zhì)量濃度為6 mg/mL的上樣液,以上樣流速1 mL/min通過已處理好的MAR柱,再用4~5 BV蒸餾水以1 mL/min的流速?zèng)_洗MAR柱使流出液為無色透明。用50 mL 70%乙醇溶液作為洗脫劑分別在0.5、1.0、1.5、2.0 mL/min的流速 條件下進(jìn)行洗脫,收集洗脫液,測定其總黃酮質(zhì)量濃度并計(jì)算解吸率。
由圖5可知,當(dāng)洗脫流速為0.5~1 mL/min時(shí),解吸率隨著洗脫流速的增加而逐漸增加;流速為1 mL/min時(shí),解吸率達(dá)到最高;之后解吸率又隨著流速進(jìn)一步增加而逐漸降低,這可能是因?yàn)榱魉龠^快縮短了MAR表面活性部位與總黃酮相互作用的時(shí)間[22]。因此,洗脫流速以1 mL/min為宜。
2.1.6洗脫液體積對解吸效果的影響
取130 mL總黃酮質(zhì)量濃度為6 mg/mL的上樣液,以上樣流速1 mL/min通過已處理好的MAR柱,再用4~5 BV蒸餾水以1 mL/min的流速?zèng)_洗MAR柱使流出液為無色透明。用50 mL 70%乙醇溶液作為洗脫劑在1 mL/min的流速條件下進(jìn)行洗脫,以5 mL為一個(gè)體積單位收集流出液,測定其總黃酮質(zhì)量濃度,并以洗脫液體積為橫坐標(biāo)、流出液總黃酮質(zhì)量濃度為縱坐標(biāo)繪制動(dòng)態(tài)洗脫曲線,考察洗脫液體積對解吸效果的影響。

圖6 動(dòng)態(tài)洗脫曲線Fig. 6 Dynamic desorption curve
由圖6可知,當(dāng)洗脫液體積為5 mL時(shí),流出液中總黃酮質(zhì)量濃度相對較小,隨后急劇上升,洗脫液體積為15 mL時(shí),總黃酮質(zhì)量濃度達(dá)到最大值,為65.465 mg/mL;當(dāng)洗脫液體積達(dá)到45 mL時(shí),總黃酮質(zhì)量濃度只有0.052 mg/mL。因此,選擇40 mL為最適宜的洗脫液體積,此時(shí),解吸率為94.10%。從該洗脫曲線可以看出,40 mL的洗脫液可以把茅巖莓總黃酮基本洗脫完全,且峰形較對稱,無拖尾。
2.2PA動(dòng)態(tài)吸附與解吸工藝參數(shù)的確定
2.2.1上樣液總黃酮質(zhì)量濃度對吸附效果的影響
分別將已去除有機(jī)溶劑的MAR解吸液(總黃酮含量為702 mg)加入一定量水溶液配制成總黃酮質(zhì)量濃度為3、4、5、6 mg/mL的溶液,以上樣流速1 mL/min通過已處理好的PA柱,收集吸附后的流出液,測定其總黃酮質(zhì)量濃度并計(jì)算吸附率。
由圖7可知,上樣液總黃酮質(zhì)量濃度在3、4、5、6 mg/mL時(shí),吸附率分別為99.57%、99.71%、99.59%、99.87%,差別非常小,均在99%以上。說明在此范圍內(nèi),總黃酮質(zhì)量濃度對吸附效果影響非常小,且吸附效果非常好。因上樣液總黃酮質(zhì)量已固定,考慮到上樣液總黃酮質(zhì)量濃度越高,上樣液體積越小,吸附時(shí)間則越短,所以選擇6 mg/mL為最適宜的上樣液總黃酮質(zhì)量濃度,此時(shí),上樣液體積為117 mL。
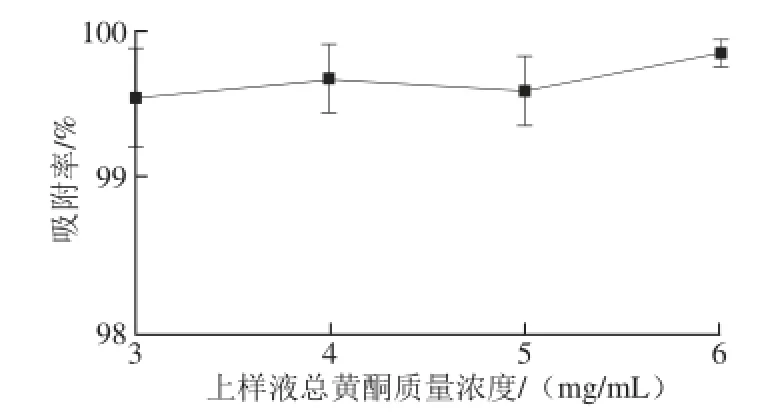
圖7 上樣液總黃酮質(zhì)量濃度對吸附效果的影響Fig. 7 Effect of total flavonoids concentration in sample on the adsorption efficiency
2.2.2上樣流速對吸附效果的影響
將已去除有機(jī)溶劑的MAR解吸液(總黃酮含量為702 mg),配制成總黃酮質(zhì)量濃度為6 mg/mL的溶液,分別以上樣流速0.5、1.0、1.5、2.0 mL/min通過已處理好的PA柱,收集吸附后的流出液,測定其總黃酮質(zhì)量濃度并計(jì)算吸附率。

圖8 上樣流速對吸附效果的影響Fig. 8 Effect of sample flow rate on the adsorption efficiency
由圖8可知,上樣流速在0.5~2 mL/min之間時(shí),吸附率分別為99.83%、99.65%、99.58%、99.57%,仍然都在99%以上。因此,為提高效率,選擇2 mL/min為最適宜上樣流速。
2.2.3不同洗脫液體積分?jǐn)?shù)的動(dòng)態(tài)洗脫曲線

圖9 洗脫液體積分?jǐn)?shù)對解吸效果的影響Fig. 9 Effect of eluant concentration on the desorption efficiency
將吸附好的PA用4~5 BV蒸餾水沖洗,再分別用體積分?jǐn)?shù)為30%、50%、70%、90%的乙醇溶液以1 mL/min流速進(jìn)行洗脫,每流出5 mL流出液收集并測定總黃酮質(zhì)量濃度,并以洗脫液體積為橫坐標(biāo),總黃酮質(zhì)量濃度為縱坐標(biāo)繪制動(dòng)態(tài)洗脫曲線,考察洗脫液體積分?jǐn)?shù)和洗脫液體積對解吸效果的影響。
由圖9可知,體積分?jǐn)?shù)為30%的乙醇溶液洗脫下來總黃酮較少,且峰形不集中,拖尾非常嚴(yán)重,這種拖尾現(xiàn)象導(dǎo)致了洗脫時(shí)間的延長和洗脫液體積的增大,當(dāng)洗脫液體積達(dá)到200 mL時(shí),流出液總黃酮質(zhì)量濃度仍有0.260 mg/mL,此時(shí)解吸率只有55.9%。這可能是因?yàn)?0%的乙醇溶液洗脫能力較弱,而一些黃酮化合物與PA形成較多氫鍵,結(jié)合力大,使得不易被洗脫[23]。50%乙醇溶液動(dòng)態(tài)洗脫曲線峰形相對集中,稍有拖尾,55 mL的洗脫液能基本把黃酮洗脫下來,解吸率為72.88%。用70%乙醇溶液洗脫,洗脫液為20 mL時(shí),流出液總黃酮質(zhì)量濃度達(dá)到最高值,出峰較早,洗脫液為30 mL時(shí),又出現(xiàn)一個(gè)峰值。這可能是由于PA的柱層析作用,根據(jù)吸附物質(zhì)與PA結(jié)合力不同所以會(huì)被分開洗脫下來,不同的峰代表不同物質(zhì)[24]。此時(shí),洗脫液體積為55 mL,解吸率為77.77%,可能是70%的乙醇溶液能最大程度地降低PA和總黃酮的氫鍵作用。90%乙醇溶液動(dòng)態(tài)洗脫曲線峰形較對稱集中,較70%乙醇溶液洗脫曲線出峰晚,且需65 mL乙醇溶液才能基本洗脫完全,此時(shí)解吸率為74.23%。因此,選擇55 mL、70%為最適宜的洗脫液體積和洗脫液體積分?jǐn)?shù)。
2.2.4洗脫流速對解吸效果的影響
將吸附好的PA用4~5 BV蒸餾水沖洗,再用55 mL 70%乙醇溶液分別在0.5、1.0、1.5、2.0 mL/min的流速條件下進(jìn)行洗脫,收集洗脫液,測定其總黃酮質(zhì)量濃度并計(jì)算解吸 率。

圖10 洗脫流速對解吸效果的影響Fig. 10 Effect of eluent flow rate on the desorption efficiency
由圖10可知,解吸率在洗脫流速為0.5 mL/min時(shí)很低,之后隨著流速的加快解吸率迅速上升;流速為1 mL/min時(shí),解吸率達(dá)到最大;流速從1~2 mL/min時(shí),解吸率又隨著流速的加快而降低。因此,選擇1 mL/min為最適宜的洗脫流速,此時(shí),解吸率為76.50%。
2.3總黃酮純度的測定結(jié)果
分別準(zhǔn)確稱取20 mg純化前、經(jīng)MAR純化后、經(jīng)PA純化后的黃酮粉,精密加入5 mL 95%乙醇溶液進(jìn)行溶解。測定溶液中總黃酮含量分別為2.20、2.89、3.23 mg/mL。再通過1.3.8節(jié)的公式計(jì)算出純度分別為55.00%、72.25%、80.75%。可見經(jīng)MAR純化后純度提高了17.25%,純化效果較好。經(jīng)PA化后的總黃酮雖然純度只提高了8.5%,但黃酮顏色由黃土赭色變成了象牙白,說明PA脫色效果較好。茅巖莓總黃酮用MAR與PA聯(lián)用法,純度提高了25.75%,說明此方法有一定的可行性。
3 結(jié) 論
本研究確定了MAR對茅巖莓總黃酮進(jìn)行初步純化的最適宜工藝參數(shù)為:上樣液總黃酮質(zhì)量濃度6 mg/mL、上樣液流速1 mL/min、上樣液體積130 mL;洗脫液乙醇體積分?jǐn)?shù)70%、洗脫流速1 mL/min、洗脫液體積40 mL。在此條件下,茅巖莓總黃酮純度從55.00%提高到了72.25%。確定了PA對茅巖莓總黃酮第2次純化的最適宜工藝參數(shù)為:上樣液總黃酮質(zhì)量濃度6 mg/mL、上樣液流速2 mL/min;洗脫液乙醇體積分?jǐn)?shù)70%、洗脫流速1 mL/min、洗脫液體積55 mL。在此條件下,總黃酮純度提高到了80.75%。用MAR與PA聯(lián)用法純化茅巖莓總黃酮,純度提高了25.75%,而MAR法[25]純化茅巖莓總黃酮純度只提高了14.65%。因此MAR-PA聯(lián)用法達(dá)到了較好的純化目的,并使PA彌補(bǔ)了MAR在純化工藝上的不足,具有良好的應(yīng)用前景,為實(shí)際生產(chǎn)提供了有效依據(jù)。
參考文獻(xiàn):
[1] YE Liyun, WANG Hengjian, DUNCAN S E, et al. Antioxidant activities of vine tea (Ampelopsis grossedentata) extract and its major component dihydromyricetin in soybean oil and cooked ground beef[J]. Food Chemistry, 2015, 172: 416-422. DOI:10.1016/ j.foodchem.2014.09.090.
[2] 何桂霞, 何群, 裴剛, 等. 瑤族藤茶中總黃酮類成分的含量測定[J].中醫(yī)藥導(dǎo)報(bào), 1999(12): 30-31.
[3] 羅祖友, 付曉芳, 吳謀成. 藤茶的研究進(jìn)展[J]. 食品科學(xué), 2005, 26(8): 513-517. DOI:10.3321/j.issn:1002-6630.2005.08.133.
[4] 肖曉瑩, 陳繼承, 龐杰. 藤茶的功能性及黃酮類化合物提取研究進(jìn)展[J]. 熱帶作物學(xué)報(bào), 2 012(8): 1522-1527. DOI:10.3969/ j.issn.1000-2561.2012.08.036.
[5] ZHOU Yong, SHU Furong, LIANG Xinyu, et al. Ampelopsin induces cell growth inhibition and apoptosis in breast cancer cells through ROS generation and endoplasmic reticulum stress pathway[J]. PloS One, 2014, 9(2): e89021. DOI:10.1371/journal.pone.0089021.
[6] NI Feng, GONG Yi, LI Linglin, et al. Flavonoid ampelopsin inhibits the growth and metastasis of prostate cancer in vitro and in mice[J]. PloS One, 2012, 7(6): 1398-1408. DOI:10.1371/journal.pone.0038802.
[7] 許利嘉, 馬培, 肖偉, 等. 別樣茶-藤茶的古今應(yīng)用歷史初步調(diào)查[J]. 中國現(xiàn)代中藥, 2012, 14(4): 62-66. DOI:10.3969/ j.issn.1673-4890.2012.04.019.
[6] GAO Jianhua, LIU Benguo, NING Zhengxiang, et al. Characterization and antioxidant activity of flavonoid-rich extracts from leaves of Ampelopsis grossedentata[J]. Journal of Food Biochemistry, 2009, 33(6): 808-820. DOI:10.1111/j.1745-4514.2009.00253.x.
[8] JIA Guangtao, LU Xiuyang. Enrichment and purification of madecassoside and asiaticoside from centella asiatica extracts with macroporous resins[J]. Journal of Chromatography A, 2008, 1193(1/2): 136-141. DOI:10.1016/j.chroma.2008.04.024.
[9] MA Chaoyang, TAO Guangjun, TANG Jian, et al. Preparative separation and purification of rosavin in rhodiola rosea by macroporous adsorption resins[J]. Separation and Purification Technology, 2009, 69(1): 22-28. DOI:10.1016/j.seppur.2009.06.002.
[10] DONG Yi, ZHAO Mouming, SUN Dongxiao, et al. Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L. leaf on macroporous adsorption resins[J]. Food Chemistry, 2015, 168: 538-545. DOI:10.1016/j.foodchem.2014.07.109.
[11] FU Boqiang, LIU Jie, LI Huan, et al. The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid[J]. Journal of Chromatography A, 2005, 1089(1/2): 18-24. DOI:10.1016/ j.chroma.2005.06.051.
[12] 馮彬彬. 蓮房原花青素提純分離工藝條件及優(yōu)化研究[D]. 鄭州: 鄭州大學(xué), 2014.
[13] ZHANG Jing, HAYAT K, ZHANG Xiaoming, et al. Separation and purification of flavonoid from ginkgo extract by polyamide resin[J]. Separation Science and Technology, 2010, 45(16): 2413-2419. DOI:10.1080/01496395.2010.487844.
[14] 何桂霞, 裴剛, 周天達(dá). 顯齒蛇葡萄中總黃酮和二氫楊梅素的含量測定[J]. 中國中藥雜志, 2000, 25(7): 423-425. DOI:10.3321/ j.issn:1001-5302.2000.07.013.
[15] 張家瑞. 大孔樹脂純化覆盆子黃酮的研究[J]. 現(xiàn)代食品科技, 2013, 29(4): 817-821.
[16] RUAN Xiao, ZHAN Limei, GAO Xingxing, et al. Separation and purification of flavonoid from taxus remainder extracts free of taxoids using polystyrene and polyamide resin[J]. Journal of Separation Science, 2013, 36(12): 1925-1934. DOI:10.1002/jssc.201201189.
[17] 金慧鳴, 譚興和, 蔡文, 等. 響應(yīng)面法優(yōu)化藤茶總黃酮的提取工藝[J].食品安全質(zhì)量檢測學(xué)報(bào), 2015, 6(5): 1575-1582.
[18] 吳海霞, 吳彩娥, 李婷婷, 等. 大孔樹脂純化銀杏葉黃酮的研究[J].現(xiàn)代食品科技, 2013, 29(12): 2964-2969.
[19] 王若蘭, 田志琴, 孔祥剛, 等. 大孔吸附樹脂純化小米酚類化合物的工藝條件研究[J]. 中國糧油學(xué)報(bào), 2011, 26(10): 35-39.
[20] 曾超珍, 劉志祥, 韓磊. 大孔樹脂法純化柑橘皮中的橙皮甙及其油脂抗氧化活性研究[J]. 中國食品學(xué)報(bào), 2012, 12(3): 119-124. DOI:10.3969/j.issn.1009-7848.2012.03.017.
[21] 駱黨委, 葉靜, 黃雅燕, 等. AB-8大孔吸附樹脂精制蘆柑皮總黃酮及黃酮類化合物的分離[J]. 食品科學(xué), 2014, 35(6): 30-35. DOI:10.7506/spkx1002-6630-201406006.
[22] WAN Pengfei, SHENG Zunlai, HAN Qiang, et al. Enrichment and purification of total flavonoids from flos populi extracts with macroporous resins and evaluation of antioxidant activities in vitro[J]. Journal of Chromatography B Analytical Technologies in the Biomedical and Life Sciences, 2013, 945/946(2): 68-74. DOI:10.1016/ j.jchromb.2013.11.033.
[23] 張靜. 銀杏黃酮純化及生物活性的研究[D]. 無錫: 江南大學(xué), 2010.
[24] 何錦風(fēng), 陳天鵬, 劉海杰, 等. 大孔樹脂對漢麻籽殼抗氧化多酚的吸附純化作用[J]. 中國食品學(xué)報(bào), 2013, 13(6): 77-87.
[25] 易海燕, 何桂霞, 歐陽文, 等. 大孔吸附樹脂分離純化藤茶總黃酮的研究[J]. 中草藥, 2011, 42(1): 74-77.
Purification of Total Flavonoids from Ampelopsis grossedentata by Combined Use of Macroporous Adsorption Resin and Polyamide
JIN Huiming, GUO Hongying, TAN Xinghe*, LIU Menghao, WANG Feng, CAI Wen, ZHANG Yu, DENG Jiehong
(Key L aboratory for Food Science and Bio-Technology of Hunan Province, College of Food Science and Technology, Hunan Agricultural University, Changsha410128, China)
Abstract:Sequential column chromatographies on HPD-100 macroporous adsorption resin (MAR) and polyamide (PA) were used to purify total flavonoids from Ampelopsis grossedentata. The optimum adsorption parameters for HPD-100 MAR were determined as follows: sample concentration, 6 mg/mL; sample flow rate, 1 mL/min; and sample volume, 130 mL. Under these conditions, the percentage adsorption was 97.14%. The optimum desorption parameters were established as follows: eluent concentration, aqueous ethanol (70:30, V/V); eluent volume, 40 mL; and flow rate, 1 mL/min. Under these conditions, the percentage desorption was 94.10%. After the treatment with HPD-100 MAR, the purity of total flavonoids was inc reased from 55.00% to 72.25%. The optimum adsorption parameters for PA were determined as follows: sample concentration, 6 mg/mL; and flow rate, 2 mL/min. Under these conditions, the percentage adsorption was 99.57%. The optimum desorption parameters were determined as follows: 70% ethanol in water (V/V) as the eluent; eluent volume, 55 mL; and flow rate, 1 mL/min. Under these conditions, the percentage desorption was 76.50%. After the treatment with PA, the purity of total flavonoids was further increased to 80.75%. The method presented in this study can provided a promising approach for the efficiency purification of total flavonoids from Ampelopsis grossedentata.
Key words:Ampelopsis grossedentata; total flavonoids; macroporous adsorption resin; polyamide; purification
收稿日期:2015-10-14
基金項(xiàng)目:國家自然科學(xué)基金面上項(xiàng)目(31371817);湖南省自然科學(xué)基金項(xiàng)目(2015JJ3076)
作者簡介:金慧鳴(1990—),女,碩士研究生,研究方向?yàn)檗r(nóng)產(chǎn)品加工技術(shù)。E-mail:279697317@qq.com
*通信作者:譚興和(1959—),男,教授,博士,研究方向?yàn)檗r(nóng)產(chǎn)品加工技術(shù)。E-mail:xinghetan@163.com
DOI:10.7506/spkx1002-6630-201612003 10.7506/spkx1002-6630-201612003. http://www.spkx.net.cn
中圖分類號:TS201.1
文獻(xiàn)標(biāo)志碼:A
文章編號:1002-6630(2016)12-0013-06

