紡織品中雙酚A的表面等離子體共振輔助檢測方法
臧佳鑫, 劉 芳, 魏孟媛, 薛文良,, 鐘成宗
(1. 東華大學 紡織面料技術教育部重點實驗室, 上海 201620; 2. 上海出入境檢驗檢疫局,上海 200120; 3. 佛山市南海南方技術創新中心有限公司, 廣東 佛山 528000)
紡織品中雙酚A的表面等離子體共振輔助檢測方法
臧佳鑫1, 劉 芳2, 魏孟媛2, 薛文良1,3, 鐘成宗3
(1. 東華大學 紡織面料技術教育部重點實驗室, 上海 201620; 2. 上海出入境檢驗檢疫局,上海 200120; 3. 佛山市南海南方技術創新中心有限公司, 廣東 佛山 528000)
鑒于雙酚A(BPA)能夠干擾生物的內分泌功能,引起各種生殖異常,威脅著嬰幼兒的健康,甚至有致癌的危險等生物危害性,采用表面等離子體共振技術(SPR)對BPA進行定性定量檢測。從傳感芯片的修飾、BPA-BSA溶液最佳質量濃度的確定、不同質量濃度BPA的響應情況以及紡織品中BPA的萃取等4個方面出發,探索了SPR技術檢測紡織品中BPA的實用性。結果表明,BPA的SPR檢測法具有檢測速度快、對樣品要求低、檢測針對性強、檢測靈敏度高等優點,適合檢測領域的廣泛應用,可應用于紡織品中雙酚A含量的測定。
表面等離子體共振;全反射;生物傳感器;雙酚A;紡織品檢測
在經濟全球化各國間貿易往來頻繁的大環境下,進出口消費品的檢測備受關注,在傳統檢測技術基礎上,新興檢測技術也在蓬勃發展,表面等離子體共振(surface plasmon resonance,SPR)技術作為新興檢測技術之一,過去的二十幾年中,在醫藥方面有了長足的發展。在其他檢測領域,SPR技術也在不斷突破,在與其他檢測技術聯用方面也取得了一定的成效。
SPR技術起源于1902年,Wood首次觀測到連續光譜的偏振光照射金屬光柵時出現的衍射現象,即SPR現象[1]。1941年,Fano解釋了SPR現象。1968年,Otto首先設計了Otto型棱鏡SPR傳感系統;1971年,Krestchmann對Otto型SPR傳感系統進行了改進[1]。1983年,Liedberg首次采用SPR技術測試抗原抗體的相互作用[2]。1990年,瑞典Biacore公司生產出世界上第一臺SPR儀[3],開創了SPR技術在檢測領域的新篇章。
雙酚A(BPA)是生產聚碳酸酯塑料和環氧樹脂的重要原料,也可用于生產各種紡織品染整助劑,如增塑劑、阻燃劑、抗氧化劑等[4]。在紡織生產中,BPA最典型的應用是變色功能紡織品上的熱敏變色印花的顯色劑[5],但是BPA被認定是一種環境激素,能夠干擾多種生物的內分泌功能,導致生殖功能下降,引起各種生殖異常,還能使免疫力降低[6];同時,BPA還具有一定的胚胎毒性和致畸性,威脅胎兒和兒童的健康,有致癌的危險[5]。癌癥和新陳代謝紊亂所導致的肥胖也被認為與BPA有關。歐盟認為含雙酚A奶瓶會誘發性早熟,從2011年3月2日起,禁止生產含BPA的嬰兒奶瓶。本文以雙酚A(BPA)為檢測對象,采用表面等離子體共振技術,探索紡織品中BPA的SPR檢測方法。
1 SPR方法的工作原理
表面等離子體共振是一種物理化學現象。當一束光線從折射率高的介質射入折射率低的介質時,若入射角大于臨界角(折射角達到90°時的入射角),入射光線形成全反射現象[7]。當偏振光在玻璃和金屬薄膜的界面上發生全內反射時,會產生漸逝波,從而引發金屬薄膜中的自由電子產生表面等離子體,在入射角達到某一特定值時,這些表面等離子體就會與漸逝波發生共振[8],即SPR現象。
SPR分析儀利用SPR現象,通過在金膜表面修飾與目標物能夠特異性結合的物質,當目標物流過金膜表面時,形成特異性吸附[9],而使反射光光譜產生變化,用光學信號的變化反映分子質量的變化,從而實現傳感檢測。基于這種原理研究紡織品中危害因子SPR法檢測的可行性。由于紡織品中有毒有害殘留大都是一些小分子物質,將對目標危害因子有特異性吸附作用的配體(識別因子)固定在芯片表面,當目標危害因子和識別因子特異性吸附時,引起折射率變化[10],實現定性定量檢測。
SPR分析儀的核心部件是芯片,由金屬薄膜和玻璃片復合而成。金屬薄膜最常采用的材料是純金[11]。基于金的化學惰性較強,在修飾芯片時,要選用一定的方法將配體修飾在金膜表面。
SPR檢測分析方法分為直接法和間接法。直接法是指將抗體修飾在金膜表面,通過目標物與抗體結合引發共振信號的改變來達到檢測目的。這種方法操作簡單,但僅適用于大分子的檢測,檢出限也比較高。間接法的核心在于提高信號強度,用于小分子的濃度測定或動力學研究。目前最常用的間接分析方法有信號增強法、競爭結合法和競爭抑制法。
2 試驗樣品準備
2.1 儀 器
SPR-Navi表面等離子體共振儀(溫度控制在比室溫略低1~2 ℃);傳感芯片:裸金芯片,羧甲基葡聚糖組裝(CMD)芯片;超聲波發生器:工作頻率為40 kHz;立式高壓滅菌器(110 ℃)。
2.2 溶液配方
2.2.1 芯片修飾溶液
11-巰基十一烷酸(11-MUA)的乙醇溶液:將0.109 g的11-MUA溶于100 mL的無水乙醇中制得。
2-嗎啉乙磺酸溶液:將1.95 g 2-嗎啉乙磺酸(MES)溶于100 mL滅菌水中,用氫氧化鈉(NaOH)溶液調節pH值至5.0。
1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽溶液:將0.077 5 g 1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽(EDC)溶于1 mL的MES溶液制得。
N-羥基琥珀酰亞胺溶液:將0.021 7 g N-羥基琥珀酰亞胺(NHS)溶于1 mL的MES溶液制得。
三羥甲基氨基甲烷-鹽酸溶液: 將0.605 5 g三羥甲基氨基甲烷(Tris)溶于100 mL滅菌水,用鹽酸(HCl)溶液調節pH至6.0。
雙酚A 單克隆抗體(BPA-6C6)溶液:用Tris-HCl溶液將其稀釋至2×10-4μg/mL。
乙醇胺鹽酸鹽溶液:將0.975 4 g乙醇胺鹽酸鹽溶于10 mL滅菌水,用NaOH 溶液調節pH值至8.5。
2.2.2 測試溶液
磷酸鹽(PBS)緩沖溶液:將8 g 氯化鈉(NaCl)、1.44 g磷酸氫二鈉(Na2HPO4)、0.2 g氯化鉀(KCl)和0.24 g磷酸二氫鉀(KH2PO4)溶于800 mL純水中,用HCl 溶液調節pH值至7.4,再定容至1 L。
雙酚A-牛血清白蛋白(BPA-BSA)溶液:由于不同批次購買的BPA-BSA溶液濃度不一,先用PBS溶液將BPA-BSA溶液稀釋至1×10-4μg/mL備用,根據試驗要求的質量濃度用PBS溶液進行稀釋。
甘氨酸-鹽酸溶液:50 mL 0.2 mol/L的甘氨酸溶液與40 mL 0.2 mol/L的HCl溶液混合,加滅菌水稀釋至200 mL,用HCl 溶液調節pH值至2.2。
BPA溶液:1 mg BPA溶于10 mL PBS溶液,配成1×10-4μg/mL備用。根據試驗要求的質量濃度用PBS溶液進行稀釋,并與相應質量濃度BPA-BSA溶液混合。
3 試驗方案
3.1.1 裸金片修飾方法
1)取一片全新裸金片,用1 mmol/L的11-巰基十一烷酸(MUA)浸沒,4 ℃浸泡過夜;2)將浸泡過夜的芯片用滅菌水清洗,用N2吹干;3)在芯片表面先滴加150 μL的EDC溶液,再滴加150 μL的NHS溶液,于室溫下靜置1 h;4)將芯片水洗吹干,在表面滴加200 μL的BPS-6C6溶液,置于37 ℃恒溫箱中3 h;5)將芯片水洗吹干,在芯片表面滴加200 μL 1 mol/L 的乙醇胺鹽酸鹽溶液,室溫靜置1 h;6)將芯片洗凈吹干備用,或放置于PBS溶液中,4 ℃貯存。
3.1.2 CMD芯片修飾方法
由于CMD芯片表面已經修飾上羧甲基葡聚糖,存在Au-S鍵,因此,在芯片修飾時,僅需進行3.1.1中的2)~6)步,且方法相同。
3.2 測試方法
3.2.1 不同質量濃度的BPA-BSA溶液測試曲線
“一帶一路”建設中的廣西保險業創新路徑 ………………………………………………………………… 吳望春 李春華(5/44)
將修飾過的芯片放入SPR儀,調節儀器溫度使之低于室溫1~2 ℃,調節流速為30 μL/min,待曲線穩定后開始試驗。試驗的緩沖溶液為PBS溶液,再生溶液為pH=2.2的甘氨酸-鹽酸溶液。試驗中,進樣均為注射進樣,具體步驟如下。
1)通入PBS緩沖溶液,待基線趨于穩定。
2)進某一質量濃度的BPA-BSA溶液,反應 6 min左右。
3)進PBS緩沖溶液清洗芯片約8 min。
4)進再生溶液,再生時間應控制在6 min內,以免破壞芯片的修飾層。
5)進PBS緩沖溶液,洗去再生溶液。
圖1示出質量濃度為3×10-4μg/mL的BPA-BSA溶液的響應曲線。該質量濃度下所對應的響應值(RU值)變化量為②段與①段的RU值之差;不同質量濃度的BPA-BSA溶液的響應曲線走勢基本一致,而響應強度不同。
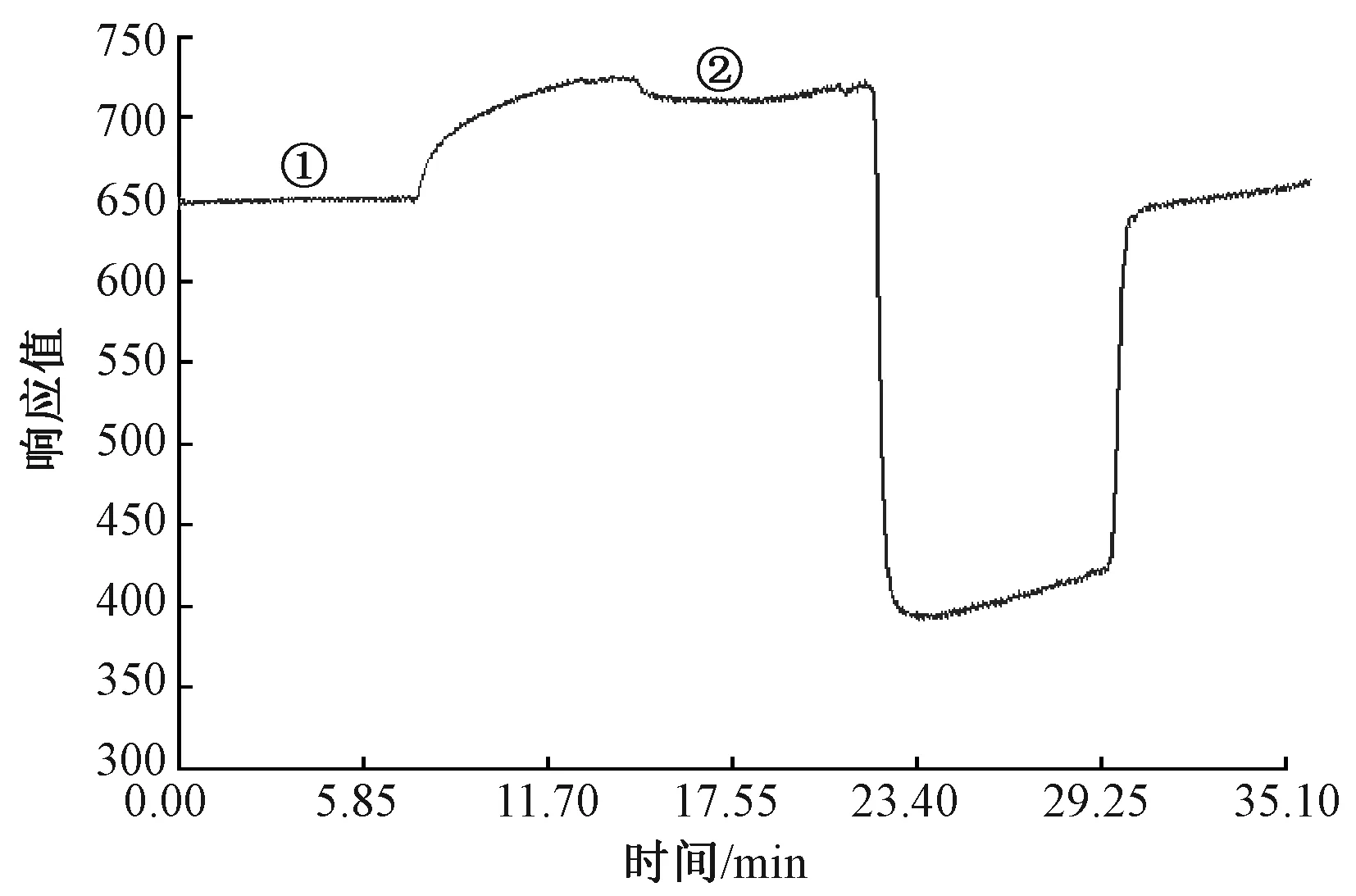
圖1 質量濃度為3×10-4 μg/mL的 BPA-BSA溶液的響應曲線Fig.1 Response curve of 3×10-4 μg/mL BPA-BSA
3.2.2 最優的BPA-BSA溶液質量濃度
由于芯片對于不同質量濃度的BPA-BSA溶液的響應有極限值,當質量濃度足夠大時,RU值變化量幾乎不再隨質量濃度的增加而增大,因此,找到質量濃度的臨界值是探索方法的關鍵,臨界質量濃度不僅可保證芯片對BPA-BSA的響應達到最明顯,也可有效節約成本。此臨界質量濃度即為最優BPA-BSA溶液質量濃度。
采用Fixed Angle模式,在固定角條件下進行試驗,步驟如3.2.1中所介紹,BPA-BSA溶液的質量濃度范圍設定為0~7×10-5μg/mL。圖2示出不同質量濃度BPA-BSA溶液所對應RU值變化量曲線。
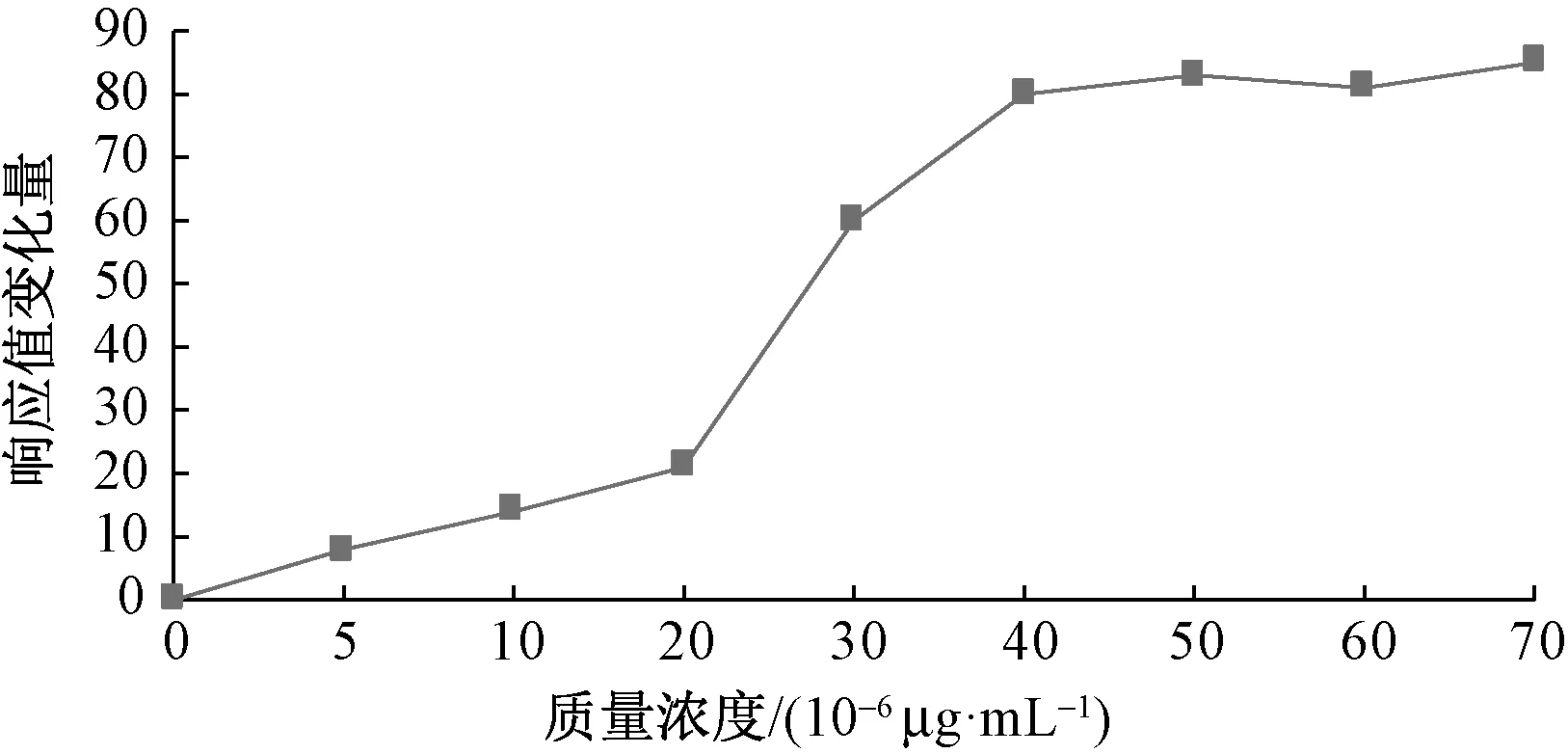
圖2 不同質量濃度的BPA-BSA溶液所對應的RU值變化量Fig.2 RU value change of BPA-BSA with different concentrations
由圖2可知:當BPA-BSA溶液質量濃度低于2×10-5μg/mL時,隨質量濃度的升高,RU值變化量的增大比較緩慢;當BPA-BSA溶液質量濃度在2×10-5~4×10-5μg/mL時,RU值變化量隨質量濃度的升高而迅速增大,有明顯的增長,增幅近倍;而當BPA-BSA溶液質量濃度高于4×10-5μg/mL時,盡管質量濃度不斷升高,但RU值變化量幾乎不變,保持在一個非常穩定的范圍內。由此可見,BPA-BSA溶液的最優質量濃度可確定為4×10-5μg/mL。
3.2.3 不同質量濃度的BPA溶液響應測試
采用Angular Scan模式,在角范圍條件下進行試驗,此模式下的RU值響應要高于Fixed Angle模式,而RU值的變化量也相應高于Fixed Angle模式,利于比較芯片對質量濃度接近的BPA溶液的響應情況。
在BPA-BSA溶液的最優質量濃度進行試驗,樣品為4×10-5μg/mL的BPA-BSA與x×10-6μg/mL的BPA混合溶液(x=5n,n∈[0,9]),緩沖溶液為PBS溶液,再生溶液為pH=2.2的甘氨酸-鹽酸溶液。
將修飾過的芯片放入SPR儀,調節儀器溫度使之低于室溫1~2 ℃,調節流速為30 μL/min,待曲線穩定后開始試驗。試驗中,進樣均為注射進樣,具體步驟如下。
1)通入PBS緩沖溶液,待基線趨于穩定。
2)進4×10-5μg/mL的BPA-BSA與x×10-6μg/mL的BPA混合溶液,反應6 min左右。
3)進PBS緩沖溶液清洗芯片約8 min。
4)進再生溶液,再生時間應控制在6 min內。
5)進PBS緩沖溶液,洗去再生溶液。
圖3示出不同質量濃度BPA與4×10-5μg/mL BPA-BSA混合溶液所對應RU值變化量。

圖3 不同質量濃度的BPA與4×10-5 μg/mL BPA-BSA的 混合溶液所對應的RU值變化量Fig.3 Change of RU value of 4×10-5 μg/mL BPA-BSA and BPA with different concentrations
由圖3可知,在BPA-BSA溶液質量濃度為4×10-5μg/mL(處于最優溶濃度)條件下,剛開始形成4×10-5μg/mL BPA-BSA + 5×10-6μg/mL BPA混合液時,RU值變化量有明顯下降。當BPA質量濃度在5~3×10-5μg/mL范圍內時,RU值變化量與BPA質量濃度之間的線性關系良好,穩步下降;RU值變化量與BPA質量濃度的線性方程為y=-27.06x+922.67,相關系數R2=0.995 9。而BPA質量濃度在3.5×10-5~4.5×10-5μg/mL時,由于接近BPA-BSA質量濃度,RU值變化量很低,已接近0。
對于線性情況良好的5×10-6~3×10-5μg/mL段,這一質量濃度范圍內所對應的RU值變化量符合方程y=-27.06x+922.67,其中x代表質量濃度,y代表RU值變化量。定量準確,可用于測定紡織品中的BPA的定量檢測,檢出限為1×10-6μg/mL。
表1示出雙酚A的加標回收率。根據表1可知,在5×10-6~3×10-5μg/mL范圍內時,雙酚A的平均加標回收率約92%~104%,重現性良好。
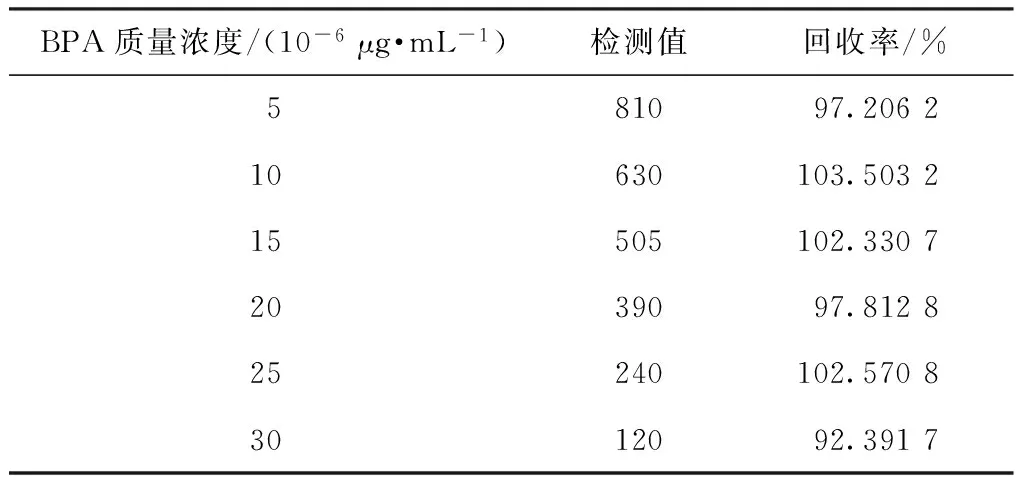
表1 雙酚A的加標回收率Tab.1 Recovery of bisphenol A
4 與傳統檢測方法的比較
目前,雙酚A的檢測還處于新興階段,應用較多的檢測方法還是比較傳統的液相、氣相檢測法。主要有高效液相色譜法[12]、高效液相色譜-質譜法[13]、氣相色譜質譜法[14]、衍生化氣相色譜質譜法[15]、熒光法[16]等。參考精度較高的氣相色譜質譜法,該方法檢出限為1×10-6μg/mL,定量限為4×10-6μg/mL。樣品平均回收率在90%~120%[14]。相比之下,SPR檢測法的檢出限也為1×10-6μg/mL,但回收率范圍更精準,精度和準確度較氣相色譜質譜法更優。
5 紡織品檢測中的實用性
BPA作為紡織品的助劑(增塑劑、阻燃劑等),應用于紡織面料、服裝的生產過程中,BPA溶于甲醇、乙醇、異丙醇、丁醇、丙酮、醚、苯、醋酸和堿性溶液,微溶于四氯化碳,難溶于水。將BPA的SPR檢測法有效應用于紡織品檢測中,必須要解決的問題是如何將紡織品中的BPA盡可能地完全分離出來。考慮到丙酮、醚、苯等的揮發性、生物毒性等因素,確定用醇作為萃取液,其中,甲醇和乙醇的萃取效果較好。
以選用甲醇作為萃取液為例,萃取方法如下:1)稱取1.0 g待測樣品,剪碎,置于反應器中;2)加入10 mL甲醇,確保樣品完全浸沒在甲醇中,超聲萃取30 min;3)將萃取液用聚四氟乙烯微孔濾膜過濾器過濾,經水浴氮吹儀濃縮,定容至1 mL,備用;4)采用SPR檢測法檢測BPA的含量,選用甲醇或乙醇對紡織品中的BPA進行萃取,可有效地將BPA分離出來,操作簡單快捷,且試驗成本較低,可應用于大批量的紡織品中BPA的檢測。
6 結 論
本文建立了測定紡織品中BPA的SPR檢測法,該方法檢出限為1×10-6μg/mL,樣品的平均加標回收率約為92%~104%,在5×10-6~3×10-5μg/mL范圍內線性關系良好,相關系數R2=0.995 9。該方法具有檢測速度快(檢測時間至少可縮短一半以上),對樣品要求低,可在渾濁樣品中進行檢測,特異性識別度高,一臺儀器便可完成對無機類危害因子和有機類危害因子的檢測等傳統紡織品檢測方法所不能匹敵的優點;同時,制樣簡便快捷,適合檢測領域的廣泛應用,可應用于紡織品中雙酚A含量的測定。
FZXB
[ 1] 王穎娜,常麗萍,郭淑琴. SPR傳感器的應用及其發展[J]. 材料導報,2012,26(5):32-36. WANG Yingna,CHANG Liping,GUO Shuqin. Development and application of SPR sensor[J]. Materials Review,2012,26(5):32-36.
[ 2] 王佳,周建. SPR生物傳感器的應用現狀與發展趨勢[J]. 傳感器與微系統,2011,30(4):1-4. WANG Jia,ZHOU Jian. Status in quo of application and development trend of SPR biosensors[J]. Transducer and Microsystem Technologies,2011,30(4):1-4.
[ 3] 王曉萍,洪夏云,詹舒越. 表面等離子體共振傳感技術和生物分析儀[J]. 化學進展,2014,26(7):1143-1159. WANG Xiaoping,HONG Xiayun,ZHAN Shuyue. Surface plasmon resonance sensing technology and bioanalytical instrument[J]. Progeress in Chemistry,2014,26(7):1143-1159.
[ 4] 馬強,白樺,王超,等. 液相色譜-串聯質譜法同時測定紡織品和食品包裝材料中的壬基酚、辛基酚和雙酚A[J]. 分析化學,2010,38(2):197-201. MA Qiang,BAI Hua,WANG Chao,et al. Simultaneous determination of nonylphenol, octylphenoland bisphenol a in textiles and food packaging materials by liquid chromatography tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry,2010,38(2):197-201.
[ 5] 江春,劉芳,劉敏華. 紡織品中雙酚A 的檢測方法研究[J]. 上海紡織科技,2014,42(7):57-59. JIANG Chun,LIU Fang,LIU Minhua. Study on the testing method of bisphenol a in textiles [J]. Shanghai Textile Science & Technology,2014,42(7):57-59.
[ 6] 葉偉瑩. 雙酚A 毒理效應研究進展[J]. 廣東化工,2015,42(2):87-94. YE Weiying. Summary on the toxicological effect of bisphonel A[J]. Guangdong Chemical Industry,2015,42(2):87-94.
[ 7] 張延彪,徐超,姚輝,等. 表面等離子體共振生物傳感器及其應用[J]. 分析科學學報,2012,28(1):126-132. ZHANG Yanbiao,XU Chao,YAO Hui,et al. Surface plasmon resonance biosensor and its application[J]. Journal of Analytical Science,2012,28(1):126-132.
[ 8] 張微微,陳宇春,王菊英,等. 表面等離子體共振技術在環境污染物分析中研究[J]. 環境科學與技術,2007,30(5):95-97. ZHANG Weiwei,CHEN Yuchun,WANG Juying,et al. Development of surface plasmon resonance technique in the analysis of environment pollution[J]. Environmental Science & Technology,2007,30(5):95-97.
[ 9] 羅鴻斌. 生物傳感器在環境監測中的應用發展[J]. 東莞理工學院學報,2014,21(5):78-82. LUO Hongbin. Application progress of biosensor on environmental monitoring[J]. Journal of Dongguan University Technology,2014,21(5):78-82.
[10] 林釗,劉霞,李迎. 表面等離子體共振技術在農藥殘留檢測研究中的應用[J]. 食品科學,2011,32(5):342-350. LIN Zhao,LIU Xia,LI Ying. Recent advances in application of surface plasmon resonance in determining pesticide residues[J]. Food Science,2011,32(5):342-350.
[11] ZDZISLAW S,MACLEOD H A,GORDON T. Coupled plasmon-waveguide resonators: a new spectroscopic tool for probing proteolipid film structure and properties[J]. Biophysical Journal,1997,73:2791-2797.
[12] 江明,林怡,張江華,等. 高效液相色譜法測定環境水中超痕量雙酚A[J]. 分析化學,2006,34(10):1419-1422. JIANG Ming,LIN Yi,ZHANG Jianghua,et al. Determination of ultra-trace bisphenol a in water samples by chromatography with large volume direct injection[J]. Chinese Journal of Analytical Chemistry,2006,34(10):1419-1422.
[13] 張巖,馬曉斐,呂品,等. 液相色譜-串聯質譜法測定小型家用電器塑料部件中雙酚A[J]. 色譜,2012,30(1):95 -98. ZHANG Yan,MA Xiaofei,Lü Pin,et al. Determination of bisphenol A in plastic parts of small household appliances by liquid chromatography-tandem mass spectrometry [J]. Chinese Journal of Chromatography,2012,30(1):95 -98.
[14] 江春,劉芳,劉敏華. 紡織品中雙酚A的檢測方法研究[J]. 上海紡織科技,2014,42(7):57-59. JIANG Chun,LIU Fang,LIU Minhua. Study on the testing method of bisphenol a in textiles[J]. Shanghai Textile Science & Technology,2014,42(7):57-59.
[15] 高永剛,張艷艷,高建國,等. 衍生化氣相色譜-質譜法測定玩具和食品接觸材料中雙酚A[J]. 色譜,2012,30(10):1017-1020. GAO Yonggang,ZHANG Yanyan,GAO Jianguo,et al. Determination of bisphenol A from toys and food contact materials by derivatization and gas chromatography-mass spectrometry[J]. Chinese Journal of Chromatography,2012,30(10):1017-1020.
[16] 余宇燕,莊惠生,沙玫,等. 熒光法測定食品包裝材料中的雙酚A[J]. 分析測試學報,2006,25(5):99-101. YU Yuyan,ZHUANG Huisheng,SHA Mei,et al. Fluorescence spectrophotometric determination of bisphenol A in food packing materials[J]. Journal of Instrumental Analysis,2006,25(5):99-101.
Detection methods of bisphenol A in textile based on surface plasmon resonance
ZANG Jiaxin1, LIU Fang2, WEI Mengyuan2, XUE Wenliang1,3, ZHONG Chengzong3
(1.KeyLaboratoryofTexileScience&Technology,MinistryofEducation,DonghuaUniversity,Shanghai201620,China; 2.ShanghaiEntry-ExitInspectionandQuarantineBureau,Shanghai200120,China; 3.FoshanNanhaiSouthernTechnologyInnovationCenterCo.,Ltd.,Foshan,Guangdong528000,China)
Since Bisphenol A (BPA) can interfere with the endocrine function of the organism, causing all kinds of reproductive abnormalities. At the same time, BPA also has a certain embryonic toxicity and produce teratogenetic and carcinogenic effects, threatening the health of the fetus. It is necessary to test BPA in textiles. BPA is used as the dyeing and finishing auxiliaries in the textiles, and has certain harm to the health of textile users. In the light of the biological hazards of BPA in textiles, it adopts surface plasmon resonance (SPR) to perform the qualitative and quantitative detection of BPA. The practicability of SPR technology in the detection of BPA was explored from four aspects, such as chip modification, determination of the optimum concentration of BPA-BSA solution, the response of BPA with different concentrations and the extraction of BPA in textiles. SPR detection method of BPA has advantages of high detection speed, strong pertinence and high detection sensitivity and low requirements on the sample, is applicable in the detection field, and can be used in the determination of the biphenol A content in textiles.
surface plasmon resonance; total reflection; biological sensor; bisphenol A; textile testing
10.13475/j.fzxb.20150602306
2015-06-10
2015-11-16
國家質檢總局科技計劃項目(2015IK239)
臧佳鑫(1991—),女,碩士生。主要研究方向為紡織材料與紡織品設計。薛文良,通信作者,E-mail:xwl@dhu.edu.cn。
TS 157
A

