甘蔗環斑病菌鑒定及其生物學特性分析
汪全偉 吳偉懷 兀旭輝 梁艷瓊 董俊葉 賀春萍


摘 要 甘蔗環斑病是甘蔗較為常見的一種真菌性病害。針對海南昌江十月田甘蔗種植地出現一種嚴重危害疑似環斑病的葉斑病,本文通過對其病原菌的形態學特征觀察,并結合ITS序列系統聚類分析,將葉斑病病菌鑒定為引起環斑病的甘蔗小球腔菌Leptosphaeria sacchari。生物學特性分析結果表明:適宜該菌生長的溫度為13~30 ℃,最適溫度為 25 ℃;適宜菌絲體生長的pH為4~11,最適pH為5,全黑暗有利于菌絲體的生長;適宜生長的碳源為麥芽糖和葡萄糖、氮源為硝酸鈉和L-絲氨酸。采用生長速率法對6種殺菌劑敏感性進行了測定,結果揭示咪鮮胺、丙環唑、多菌靈、腈菌唑等4種藥劑對甘蔗環斑病菌具有顯著的抑制效果,其EC50值分別為0.397 6、2.251 9、2.163 4、4.827 3 μg/mL。
關鍵詞 甘蔗環斑病;小球腔菌;生物學特性
中圖分類號 S435.661 文獻標識碼 A
甘蔗環斑病(Sugarcane ring spot)又名輪斑病,是甘蔗上較常見的一種真菌性病害。自1890年印度尼西亞爪哇首次報道該病以來,迄今幾乎所有植蔗國家都有發生。此病多危害糖蔗老葉,當條件適宜時,也可為害葉鞘和蔗莖。嚴重時,該病使葉片提早枯死,直接影響甘蔗的產量與含糖量。此外,環斑病也能危害果蔗,且該病在果蔗上具有感病快、傳染快,連作地易發病等特點[1]。目前該病在中國蔗區普遍發生[2-8]。然而,針對此病的相關研究比較少。目前關于甘蔗環斑病的研究僅限于病害調查及大田防控試驗。貴州果蔗病害重災區的調查結果表明,環斑病是危害果蔗的主要病害之一,該病可導致果蔗的產量和品質受到嚴重影響[9];李向勇與易代勇則對黔糖3號環斑病作了田間藥效防控試驗[9]。
2015年7月本課題組在對海南甘蔗種植區進行病害調查時發現,海南昌江十月田甘蔗種植地出現一種疑似甘蔗環斑病的葉斑病,嚴重影響其甘蔗產量。為了明確其病原菌,以及掌握該病的發生與流行條件,本研究對采集的典型病樣進行了分離與鑒定,并進一步對其生物學特性分析和防治藥劑的篩選,以期為掌握該病的病菌流行規律以及預測預報奠定基礎。
1 材料與方法
1.1 材料
1.1.1 供試樣品 病葉樣品采自海南昌江十月田甘蔗種植地。
1.1.2 供試培養基 供試馬鈴薯葡萄糖(Potato Dextrose Agar,PDA)培養基按如下配方進行配制:馬鈴薯200 g、葡萄糖16 g、瓊脂粉20 g、蒸餾水定容至1 000 mL;而Czapek基礎培養基配制為:硝酸鈉2.00 g、磷酸二氫鉀1.00 g、氯化鉀0.50 g、七水硫酸鎂0.50 g、硫酸鐵0.01 g、蔗糖30.00 g、瓊脂粉20 g、蒸餾水定容至1 000 mL。上述培養基均于121 ℃高壓滅菌20 min后備用。
1.1.3 試劑、引物及菌株 真菌DNA小量提取試劑盒購自OMEGA公司。rDNA-ITS通用引物ITS1/ ITS4序列[10],由英濰捷基(上海)貿易有限公司采用普通脫鹽方式合成;大腸桿菌Trans-T1感受態細胞由北京全式金生物技術有限公司提供,其它試劑均為國產分析純。
1.2 方法
1.2.1 病原菌的分離與形態觀察 利用常規組織分離法,對具有典型癥狀的甘蔗葉片進行病原菌分離培養。記錄病原菌在PDA培養基上的菌落形態與菌絲體顏色,并于顯微鏡下對分生孢子器及分生孢子的形態、顏色、大小等進行觀察。
1.2.2 病原菌致病性測定 利用柯赫氏法對分離物進行致病性測定。將分離物在PDA培養基上預培養6 d左右。采用菌餅法,利用健康新臺糖22號甘蔗離體葉片接種,保濕,5 d后觀察其是否發病,并從病部對病原菌進行再分離,觀察所分離物是否與原分離物的形態特征一致。
1.2.3 基于r DNA-ITS 區序列的病原菌分子鑒定
病原菌基因組總DNA的提取參照OMEGA真菌DNA小量提取說明書進行提取。利用引物ITS1/ ITS4對病原菌基因組總DNA為模板進行PCR擴增。PCR產物回收采用瓊脂糖凝膠DNA回收試劑盒(TaKaRa),按試劑盒說明書進行操作。取4 μL回收產物與pEASYTM Cloning Vector連接,轉化大腸桿菌感受態細胞,經藍白斑篩選后,選取3個陽性克隆子送英濰捷基(廣州)貿易有限公司測序。
1.2.4 rDNA-ITS序列比對分析 將測序得到的rDNA-ITS序列經兩端去載體序列后,于GenBank(http://www.ncbi.nlm.nih.gov/)進行BLAST比對及同源序列分析,并利用MEGA 4.0軟件中鄰接法 (neighbor-joining,NJ)進行聚類分析,繪制出相應的系統發育樹。
1.2.5 病原菌生物學特性分析
(1)不同溫度下菌落生長速率測定。以馬鈴薯葡萄糖培養基為基礎培養基,接種菌絲塊(5 mm,下同),分別于5、13、20、25、28、30、37 ℃等7個梯度溫度培養。培養6 d后,用十字交叉法測量菌落直徑。重復3次,下同。
(2)不同酸堿度下菌落生長速率測定。以1為梯度,分別將已滅菌的培養基調節為pH4.0至pH11,迅速倒制平板。冷卻后,接種菌絲塊,25 ℃恒溫培養箱中培養,6 d后測量菌落直徑(重復3次;下同)。
(3)光照對菌落生長的影響。將直徑為5 mm的菌絲塊接種于PDA平板中央,分別置于全日光照、12 h光照/12 h黑暗、全日黑暗等3種條件下培養。
(4)不同碳源對病原菌生長的影響。以固體Czapek培養基為基礎,分別以等量的蔗糖(20 g)、葡萄糖、麥芽糖、乳糖、可溶性淀粉、D-木糖、和D-半乳糖作為碳源,配制成不同碳素營養的培養基。接種菌絲塊,25 ℃恒溫培養箱中培養,6 d后測量菌落直徑。
(5)不同氮源對病原菌生長的影響。以固體Czapek培養基為基礎,對供試硝酸鈉、L-精氨酸、L-絲氨酸、甘氨酸、L-亮氨酸、L-纈氨酸、L-蘇氨酸等其氮素均折算為0.329 4 g/L純氮素進行配制,配制成不同氮素營養的培養基,備用。
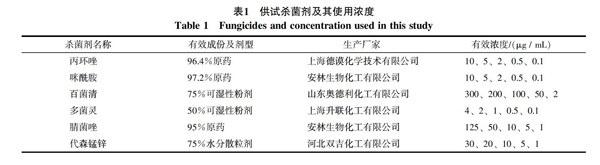
1.2.6 不同藥劑對甘蔗環斑病菌敏感性測定
采用生長速率法測定甘蔗環斑病菌對6種殺菌劑的敏感性(表1)。將甘蔗環斑病菌在PDA培養基上25 ℃預培養6 d。于菌落邊緣打取菌餅(內徑5 mm),后將菌餅分別接入含藥平板中央,每處理設3次重復。25 ℃恒溫培養箱中培養6 d后,采用十字交叉法測量菌落直徑,計算抑菌率。根據生物統計機率值換算表,將抑制百分率換算成抑制機率值。以處理濃度(mg/L)的對數值為橫坐標,相應抑制機率值為縱坐標求出毒力回歸方程,并求出抑制中濃度EC50、EC95和相關系數(r)。
2 結果與分析
2.1 病原菌的分離與形態特征
甘蔗環斑病主要侵染老葉,有時也會危害嫩葉、葉鞘以及蔗莖。葉片被危害時,呈墨綠色至褐色,長卵圓形,病斑具有輪廓分明的淡黃色邊緣,中心為枯白色或草黃色,有時整個病斑保持紅色或紅褐色(圖1-A、B)。于田間采集典型病葉帶回實驗室分離,經單孢分離獲得菌株,編號為SL10。病原菌在PDA培養基上的菌落呈圓形、邊緣整齊;菌絲體白色后期變灰色、生長旺盛,棉絮狀,中部稍隆起,菌落背面呈淡青色(圖2)。分生孢子器扁球形,黑色;分生孢子初無色,老熟時淡褐色,單胞,大小為2.713~8.395 μm-1.432~5.010 μm(隨機測量100個分生孢子)(圖3)。
2.2 病原菌致病性測定
按照柯赫氏法則將SL10菌株進行致病性測定(圖4),5 d后觀察到不規則病斑,顏色形狀與在田間自然發病得到的病斑顏色一致,再分離獲得的菌株鏡檢后,觀察到病原菌形態及分生孢子特征也一樣。由此表明,該病菌確為致病菌。
2.3 病原菌分子鑒定
通過ITS1/ITS4引物進一步對該菌進行分子確認,PCR產物經1.0%瓊脂糖凝膠電泳檢測獲得一條大小約為0.5 kb的條帶(圖5),經測序最后所得534 bp全長序列。經GenBank數據庫中的BLASTn序列經比對分析,結果表明,該序列與數據庫中KC005678~KC005680(Leptosphaeria sacchari)來自玉米甘蔗小球腔菌ITS的復蓋度為100%,其同源性高達99%。通過與GenBank數據庫中登錄的13條Leptosphaeria屬序列構建的系統發育樹揭示,SL10與Leptosphaeria sacchari的同源性最高,聚為一個分枝(圖6)。最終結合形態學觀察結果,將SL10鑒定為甘蔗小球腔菌Leptosphaeria sacchari。
2.4 病原菌生物學特性分析
根據病原菌生物學特性測定結果表明,甘蔗小球腔菌菌絲體生長的合適溫度為13~30 ℃,最適宜溫度為25 ℃,低于13 ℃或高于30 ℃時,菌絲體生長受抑制或不能生長(圖7-A);合適pH值范圍為4~11,最適宜的pH值為5(圖7-B);全黑暗培養最有利于病原菌生長(圖7-C);該病菌在含麥芽糖和葡萄糖的培養基中菌落生長狀況最好,菌絲致密茂盛,生長速率快,由此表明麥芽糖和葡萄糖是該菌生長的最適合碳源(圖7-D);該病原菌在含L-絲氨酸培養基上生長速度最快(圖7-E),菌絲體生長濃密,為該菌生長的最適氮源。
2.5 病原菌殺菌劑敏感性測定
敏感性實驗表明,各供試藥劑濃度對數與生長抑制率幾率值之間表現出線性相關,只是不同殺菌劑對甘蔗環斑病菌的毒理存在明顯差異。在6種供試藥劑中,其中咪鮮胺、丙環唑、多菌靈、腈菌唑等4種藥劑對甘蔗環斑病菌菌絲體生長具有顯著的抑制效果,其平均EC50值分別為0.397 6、2.251 9 L、2.163 4、4.827 3 μg/mL。比較而言,代森錳鋅的抑制作用較差,其EC50值為19.919 8 μg/mL;而百菌清對環斑病菌抑制效果最差,其EC50值高達385.064 4 μg/mL(表2)。在EC95方面藥劑之間差異則更加明顯,其最小值與最大值范圍介于5.583 4~63 268.18 μg/mL之間,兩者相差達113 957倍(表2)。
3 討論與結論
甘蔗環斑病是甘蔗葉片上一種普遍發生的真菌性病害。一直以來,該病害并未被引起足夠重視。近年來,該病呈現出危害加重之勢[2,4-5]。根據調查顯示,在貴州甘蔗環斑病由以前的次要病害上升為主要病害了[9]。本研究針對海南昌江十月田甘蔗種植地出現一種疑似甘蔗環斑病的葉斑病,開展了病原菌的分離與鑒定,最終將疑似葉斑病其病原菌鑒定為引起環斑病的小球腔菌[Leptosphaeria sacchari V. Breda. de Haan]。本研究中無論是觀察到的病癥還是病原鑒定結果均與易代勇等[1]報道的甘蔗小球腔菌危害癥狀以及形態特征相一致。隨后,進一步對其生物學特性進行了分析。實驗結果表明,與山楊黑色小球腔菌相似,在溫度為25 ℃左右條件下有利于病害的發生[11]。據了解,本研究系第一次較為詳細報道甘蔗環斑病病原鑒定及生物特性。
有關該病的化學藥劑防治研究方面,李向勇和易代勇對果蔗黔糖3號環斑病作了田間藥效防控試驗,篩選出防效較好的藥劑為70%甲托+50%代森錳鋅混合液和50%氯溴異氰尿酸600倍液[9]。為了獲得更多防治該病害藥劑,本研究對6種化學藥劑進行了室內毒力測定。藥劑篩選試驗結果表明,95%咪鮮胺抑菌效果最好;其次是80%多菌靈,96.4%丙環唑次之,百菌清的抑菌效果最差。需要注意的是,此次藥劑試驗中,僅在室內做了毒力測定,篩選出了幾種效果較好的殺菌劑,并未得到室外或大田試驗的驗證,所以上述幾種殺菌劑對環斑病菌的抑菌作用還有待進一步的明確,以便更科學地指導大田防治。
參考文獻
[1] 易代勇, 雷朝云, 李向勇, 等. 黔糖3號果蔗病害調查與病原菌鑒定初報[J]. 中國農學通報, 2006(9): 346-350.
[2] 龍友華, 劉洋洋, 吳小毛, 等. 貴州甘蔗真菌病害初步調查及褐斑病防治藥劑篩選[J]. 植物保護, 2015, 41(4): 186-190.
[3] 楊世常.云南德宏蔗區甘蔗病蟲草害的發生及防治[J]. 中國糖料, 2013, (3): 75-80.
[4] 韋金菊, 鄧展云, 黃誠華, 等. 廣西甘蔗主要真菌病害調查初報[J]. 南方農業學報, 2012, 43(9): 1 316-1 319.
[5] 熊國如, 李增平, 趙婷婷, 等. 海南蔗區甘蔗病害種類及發生情況[J]. 熱帶作物學報, 2010, 31(9): 1 588-1 595.
[6] 易代勇, 李向勇, 雷朝云, 等. 黔糖3號果蔗病害的致病原因與防控對策[J]. 貴州農業科學, 2008, 36(1): 97-99.
[7] 黃應昆, 李文鳳. 云南省甘蔗常見病害及其防治[J]. 云南農業科技, 1999, (3): 32-36.
[8] 陳庭俊.福建省甘蔗病害的發生及主要病害的防治[J].甘蔗. 1999, (4): 18-22.
[9] 李向勇, 易代勇. 黔糖3號輪斑病防控試驗初報[J]. 貴州農業科學, 2008, 36(5): 87-88.
[10] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols: A Guide to Methods and Applications[M]. eds. Innis M A, Gelfand D H, Sninsky J J, et al. New York, Academic Press, Inc, 1990: 315-322.
[11] 柳惠慶. 一種國內未見報道的山楊黑色小球腔菌[J]. 河北林學院學報, 1986, 1(1): 103-105.

