乏氧激活人口腔鱗癌細胞DKKL1的表達
王建秋 范如意 謝其洋 閆風琴
(杭州師范大學醫學院生物化學與分子生物學教研室,浙江 杭州 310036)
·基礎研究·
乏氧激活人口腔鱗癌細胞DKKL1的表達
王建秋范如意謝其洋閆風琴1
(杭州師范大學醫學院生物化學與分子生物學教研室,浙江杭州310036)
〔摘要〕目的探討常氧和乏氧條件下人口腔鱗癌細胞Dickkopf樣蛋白-1(DKKL1)的表達及可能的表觀遺傳學機制。方法取對數生長期人口腔鱗癌SAS細胞和OECM-1細胞,常氧或乏氧(1.0% O2)條件下培養18 h,采用實時熒光定量PCR方法檢測DKKL1 mRNA水平的表達,采用Western印跡方法檢測其蛋白水平的表達;進一步采用染色質免疫沉淀(ChIP)方法檢測DKKL1基因啟動子上H3K4乙酰化(H3K4ac)和二甲基化(H3K4me2)水平的變化。結果與常氧條件下相比,乏氧使DKKL1在SAS和OECM-1兩種口腔鱗癌細胞中的表達均顯著升高,其mRNA水平分別為常氧條件下的(4.0±0.4)倍(P<0.01)和(2.4±0.1)倍(P<0.01);ChIP結果顯示,乏氧增加了DKKL1基因啟動子上H3K4ac水平,降低了H3K4me2水平。結論乏氧可激活口腔鱗癌細胞DKKL1的表達,該作用可能與乏氧調節DKKL1基因啟動子上組蛋白H3K4的乙酰化和二甲基化修飾有關。
〔關鍵詞〕口腔鱗癌;乏氧;Dickkopf樣蛋白-1;組蛋白修飾
口腔鱗狀細胞癌(OSCC)是常見的上皮來源頭頸部惡性腫瘤,目前,其發生和轉移的分子機制尚不清楚。乏氧是腫瘤微環境的基本特征之一,通過激活缺氧誘導因子(HIF)-1α誘導的上皮細胞間質轉化(EMT)是上皮細胞來源的惡性腫瘤細胞獲得遷移和侵襲能力的重要生物學過程〔1,2〕。Dickkopf樣蛋白-1(DKKL1)基因啟動子上的組蛋白3(H3)化學修飾受到乏氧調節,由此推測,DKKL1的表達可能受到乏氧的調節作用,并可能在乏氧誘導腫瘤EMT過程中發揮作用。而關于DKKL1與腫瘤的相關性,目前鮮有報道。本研究擬檢測DKKL1基因啟動子上組蛋白標記H3K4乙酰化(H3K4ac)、H3K4二甲基化(H3K4me2)的化學修飾變化,初步探討乏氧調節DKKL1表達可能的表觀遺傳學機制。
1材料與方法
1.1主要材料人口腔鱗癌細胞系SAS和OECM-1(臺灣陽明大學生化暨分子生物研究所惠贈);改良型RPMI-1640培養基(Thermo);胎牛血清(Gibco);總RNA提取試劑RNAiso Plus(TaKaRa);反轉錄酶試劑盒(TaKaRa);Real-time qPCR試劑盒UltraSYBRMixture(CWBIO);DKKL1兔抗人多克隆抗體(Millipore);Magna ChIPTM protein A+G magnetic beads(Millipore);ChIPAb+ acetyl-histone H3(Lys4)set(Millipore,含兔抗人單克隆抗體、陰性對照IgG和GAPDH陽性對照引物);ChIPAb+ dimethyl-histone H3(Lys4)set(Millipore,含鼠抗人特異性抗體、陰性對照IgG和GAPDH陽性對照引物)。
1.2主要儀器APM-30DR三氣培養箱(ASTEC,日本);7500型熒光定量PCR儀(ABI,美國);Odyssey雙色紅外熒光掃描成像系統(LI-COR,美國)。
1.3方法
1.3.1細胞的常氧培養和乏氧處理取生長狀態良好的SAS細胞和OECM-1細胞,用含10%胎牛血清的RPMI-1640培養基,37℃、5%CO2進行常規培養。乏氧處理:取常規培養的細胞,用含1%胎牛血清的RPMI-1640培養基換液,置于三氣培養箱中,將氧濃度調整為1%后繼續培養18 h。
1.3.2實時熒光定量PCR檢測mRNA水平用Trizol法提取各組細胞的總RNA,采用逆轉錄試劑盒將mRNA逆轉錄成cDNA。Real-time PCR 的引物合成在上海捷瑞生物工程有限公司完成,引物設計:DKKL1上游:5′-GGGATGGAGTTCTGTGTGGA-3′,下游:5′-AGCTTCGAGGGTGATTTGAA-3′,18S rRNA上游:5′-GTAACCCGTTGAACCCCATT-3′,下游:5′-CCATCCAATCGGTAG TAGCG-3′。采用SYBR-Green染料法進行定量PCR,循環條件:95℃預變性5 min;95℃變性10 s,60℃復性30 s,72℃延伸20 s,40個循環。根據熔解曲線評估引物特異性。以18S RNA為內參,采用2-△△CT法進行相對定量分析,每次試驗設三復孔,行三次獨立重復試驗。
1.3.3Western印跡檢測蛋白表達提取細胞總蛋白,Bradford法測定蛋白濃度,取60 μg蛋白樣品作十二烷基硫酸鈉(SDS)聚丙烯酰胺凝膠電泳(5%積層膠,10%分離膠)。將凝膠上的蛋白轉印到聚偏氟乙烯(PVDF)膜上。PVDF 膜與DKKL1抗體(1∶1 000)在4℃搖床下孵育過夜后,再與結合有熒光染料的二抗孵育。應用Odyssey紅外掃描系統對 PVDF 膜進行掃描成像。以β-actin(抗體稀釋比例為1∶1 000)作為內參照。
1.3.4染色質免疫沉淀(ChIP)實驗1%甲醛固定細胞10 min,依次裂解細胞膜和細胞核。超聲破碎染色質DNA,使其片段長度分布在200~1 000 bp。以稀釋緩沖液將染色質懸液稀釋5倍,取2%作為對照,剩余部分五等分,分別加入抗H3K4ac、抗H3K4me2抗體和兔正常IgG、小鼠正常IgG,4℃搖床孵育過夜。應用磁性A/G瓊脂糖株收集免疫沉淀復合物,充分洗滌后65℃水浴過夜。應用PCR產物提取試劑盒提取DNA,以此為模板,應用合成的DKKL1啟動子特異性引物(上游5′-CCCCGTTCTCAGCTTGATGT-3′,下游5′-TTCTTCCCTGGTGTCCATGC-3′),SYBR green染色法進行Real-time PCR擴增。
1.4統計學分析采用SPSS20.0軟件行t檢驗。
2結果
2.1乏氧激活DKKL1在口腔鱗癌細胞中的表達實時熒光定量PCR結果顯示,乏氧顯著激活了兩種口腔鱗癌細胞系中DKKL1的轉錄(SAS細胞,常氧條件DKKL1 mRNA 0.075±0.001,乏氧條件0.300±0.027;OECM-1細胞:常氧條件DKKL1 mRNA 0.355±0.027,乏氧條件0.853±0.040)。乏氧處理18 h后,DKKL1在SAS細胞中的mRNA相對表達量是常氧條件下的(4.0±0.4)倍,而在OECM-1細胞中則是常氧條件下的(2.4±0.1)倍。與常氧條件相比,乏氧處理后SAS和OECM-1細胞DKKL1的蛋白表達均顯著增高。見圖1。
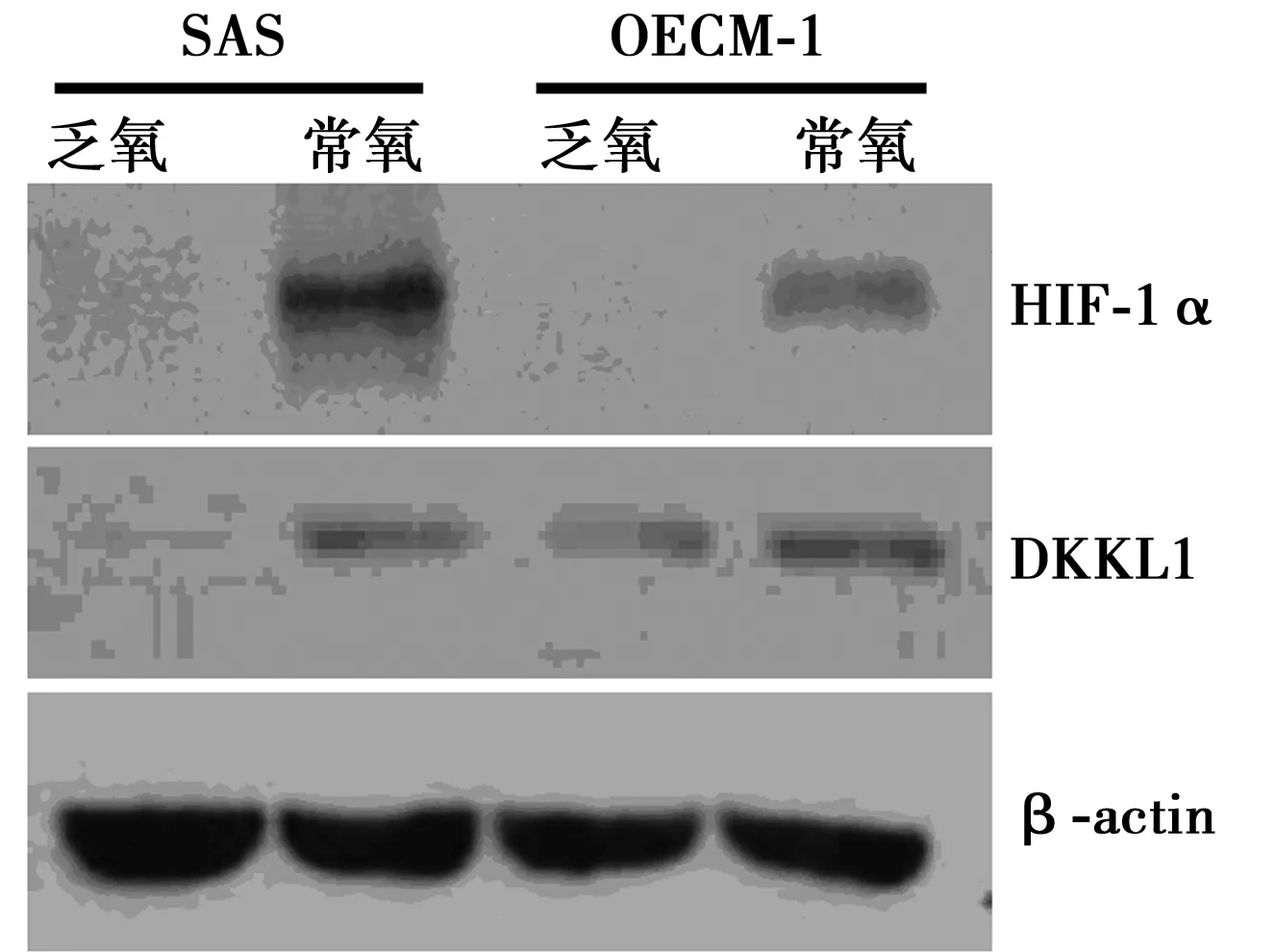
圖1 Western印跡檢測SAS、OECM-1細胞中DKKL1蛋白的表達
2.2乏氧調節DKKL1啟動子上的組蛋白修飾與常氧條件相比,乏氧處理可使OECM-1細胞DKKL1基因啟動子上的H3K4乙酰化水平顯著升高(H3K4ac抗體:常氧條件H3K4乙酰化水平0.237±0.024,乏氧條件1.156±0.079;兔正常IgG:常氧條件H3K4乙酰化水平0.039±0.004,乏氧條件0.038±0.004),達常氧條件下的(4.9±0.3)倍;而其二甲基化水平則明顯降低(H3K4 me2抗體:常氧條件下H3K4二甲基化水平4.042±0.399,乏氧條件0.383±0.039;小鼠正常IgG:常氧條件下H3K4二甲基化水平0.163±0.015,乏氧條件0.323±0.027)。
3討論
DKKL1屬于Dickkopf超家族成員,目前對其功能的認識相對較為局限,主要集中于其對精母細胞凋亡的調控作用〔3〕。不過最近有研究報道,DKKL1可能參與包括高級別膠質瘤在內的多種腫瘤的調控〔4〕,但具體機制不清。Dickkopf蛋白家族多個成員(如DKK1、DKK3)是Wnt/β-catenin信號通路的有效拮抗劑,同時又受Wnt/β-catenin的反饋調節〔5,6〕,預示著該家族蛋白功能的復雜性。如DKK1一方面被報道為腫瘤抑制因子,在結腸癌和黑色素瘤中表達下調〔7〕;另一方面又被報道在乳腺癌、肺癌和肝癌中表達明顯增高,并促進了肝癌的侵襲和轉移〔8〕。DKKL1是否也具有類似的腫瘤調節作用?本實驗結果顯示,在常氧條件下培養的口腔鱗癌細胞,無論是DKKL1的mRNA水平還是蛋白質表達水平,都是非常低的。而之前關于DKKL1在正常組織中表達的報道,也僅見表達于睪丸組織〔4〕。然而,在缺氧誘導口腔鱗癌EMT的表觀遺傳學機制研究中,從高通量測序數據中發現DKKL1基因啟動子上的組蛋白修飾可能受到乏氧的顯著調控。口腔鱗癌增長迅速,易造成局部乏氧微環境〔9〕,而乏氧是誘導腫瘤細胞EMT、促進腫瘤侵襲和轉移的重要刺激因子。目前,尚未見乏氧影響腫瘤細胞DKKL1表達的相關報道。而本實驗中,乏氧激活了DKKL1在口腔鱗癌細胞中的表達。
組蛋白修飾調節可改變染色質結構,影響轉錄因子與啟動子或其他順式作用元件的結合,調節基因表達〔10〕。組蛋白H3/H4的位點特異性乙酰化通常會引起基因轉錄激活,去乙酰化則導致轉錄抑制〔11〕。組蛋白的甲基化和去甲基化修飾對基因的轉錄調節各不相同〔12〕。本實驗采用ChIP方法,發現與常氧條件相比,乏氧顯著增加DKKL1啟動子上H3K4乙酰化水平,而降低了其二甲基化水平。因此推測乏氧通過對基因啟動子上的組蛋白H3K4位點特異性乙酰化和二甲基化的協調調節實現了對DKKL1的轉錄激活作用,符合染色質的“二價域”(bivalent domains)調節基因功能的理論〔13〕。
Wnt/β-catenin是EMT過程中重要的信號轉導通路之一,DKKL1會否像DKK1或DKK3一樣參與Wnt/β-catenin信號通路的調節,并通過該信號通路參與調節EMT,有待深入研究。
4參考文獻
1Thiery JP,Acloque H,Huang RY,etal.Epithelial-mesenchymal transitions in development and disease〔J〕.Cell,2009;139(5):871-90.
2孫昊軒,馮紅超,宋宇峰.Twist在口腔鱗狀細胞癌中的表達及其與鱗狀細胞癌上皮間質化的關系〔J〕.華西口腔醫學雜志,2015;33(5):534-8.
3Shahbazian MD,Grunstein M.Functions of site-specific histone acetylation and deacetylation〔J〕.Ann Rev Biochem 2007;76(1):75-100.
4Sibbe M,Jarowyj J.Region-specific expression of Dickkopf-like1 in the adult brain〔J〕.Neurosci Lett,2013;535(1):84-9.
5Wu KJ,Yang MH.Epithelial-mesenchymal transition and cancer stemness:the Twist1-Bmi1 connection〔J〕.Biosci Rep,2011;31(6):449-55.
6Sun J,Wang H,Lina C,etal.Remarkable impairment of Wnt/β-catenin signaling in the brains of the mice infected with scrapic agents〔J〕.J Neurochem,2015;doi:10.1111/jnc.13416.
7Kuphal S,Lodermeyer S,Bataille F,etal.Expression of Dickkopf genes is strongly reduced in malignant melanoma〔J〕.Oncogene,2006;25(36):5027-36.
8Gobel A,Browne AJ,Thiele S,etal.Potentiated suppression of Dickkopf-1 in breast cancer by combined administration of the mevalonate pathway inhibitors zoledronic acid and statins〔J〕.Breast Cancer Res Treat,2015;154(3):623-31.
9江琳琳,韓偉,王志勇.低氧促進口腔鱗癌細胞TLR3及TLR4表達的相關研究〔J〕.口腔醫學,2015;35(10):806-9.
10王維,孟智啟,石放雄.組蛋白修飾及其生物學效應〔J〕.遺傳,2012;34(7):810-8.
11Wang JQ,Wu KJ.Epigenetic regulation of epithelial-mesenchymal transition by hypoxia in cancer:targets and therapy〔J〕.Curr Pharm Des,2015;21(10):1272-8.
12Sarris M,Nikolaou K,Talianidis I.Context-specific regulation of cancer epigenomes by histone and transcription factor methylation〔J〕.Oncogene,2014;33(10):1207-17.
13Jiang H,Shukla A,Wang X,etal.Role for Dpy-30 in ES cell-fate specification by regulation of H3K4 methylation within bivalent domains〔J〕.Cell,2011;144(4):513-25.
〔2016-01-17修回〕
(編輯袁左鳴)
Activation of DKKL1 expression by hypoxia in human OSCC cell lines
WANG Jian-Qiu,FAN Ru-Yi,XIE Qi-Yang,et al.
Department of Biochemistry and Molecular Biology,School of Medicine,Hangzhou Normal University,Hangzhou 310036,Zhejiang,China
【Abstract】ObjectiveTo investigate the effects of tumor hypoxia microenvironment on expression of DKKL1 in oral squamous cell carcinoma(OSCC)cells lines and explore its potential epigenetic mechanism.MethodsTwo kinds of human OSCC cell lines in exponential growth phase,SAS and OECM-1 cells,were cultured in normoxia or hypoxia(1.0% oxygen)conditions for 18 h.Both Real-time PCR and Western blot were applied to detect the change of DKKL1 expression.Chromatin Immunoprecipitation(ChIP)experiments were performed to detect the changes of histone modification of acetylated or dimethyl H3K4(H3K4ac/H3K4me2)on DKKL1 gene promoter.ResultsCompared to normoxic conditions,hypoxia(1.0%)significantly increased the expression of DKKL1 in both SAS and OECM-1 cells,and the relative mRNA level was (4.0±0.4)folds and(2.4±0.1)folds of that under normoxia in SAS(P<0.01)or OECM-1(P<0.01)cells,respectively.ChIP experiments showed that level of H3K4ac on promoter of DKKL1 gene was increased,while the level of H3K4me2 was reduced significantly.ConclusionsHypoxia activates the expression of DKKL1,which may be related with the regulation of hypoxia on histone modification of H3K4ac and H3K4me2 on the promoter of DKKL1 gene.
【Key words】Oral squamous cell carcinoma; Hypoxia; DKKL1; Histone modification
基金項目:國家自然科學基金項目(No.81301850);浙江省教育廳科研項目(No.Y201328812)
通訊作者:閆風琴(1978-),女,主治醫師,主要從事頭頸癌放射治療的研究。
〔中圖分類號〕R739.8
〔文獻標識碼〕A
〔文章編號〕1005-9202(2016)11-2569-03;
doi:10.3969/j.issn.1005-9202.2016.11.001
1浙江省腫瘤醫院放療科十九病區
第一作者:王建秋(1979-),男,助理研究員,主要從事腫瘤與衰老的研究。

