1-磷酸鞘氨醇受體的研究進展
石小巖,廖愛軍
中國醫科大學附屬盛京醫院血液科,沈陽 110004
?
·綜述·
1-磷酸鞘氨醇受體的研究進展
石小巖,廖愛軍*
中國醫科大學附屬盛京醫院血液科,沈陽 110004
[摘要]1-磷酸鞘氨醇S1P(Sphingosine 1-phosphate,S1P)是調節細胞內外多種生物學功能的重要信號分子之一,作用于S1P受體后,在很多生理和病理過程中發揮重要的調節作用。Sphk-S1P-S1PR信號通路及其在炎癥、腫瘤、動脈粥樣硬化、自體免疫系統疾病、神經系統疾病等多種疾病中的作用已成為目前研究的熱點之一。越來越多的S1P受體調節劑被研發。
[關鍵詞]S1P;S1P受體;Sphk-S1P-S1PR信號通路;S1P受體調節劑
0引言
1-磷酸鞘氨醇(Sphingosine 1-phosphate,S1P)是調節細胞內外多種生物學功能的重要信號分子之一,S1P通過與其受體1-磷酸鞘氨醇受體(Sphingosine 1-phosphate receptors,S1PRs)結合,在不同細胞中發揮生物學效應,成為炎癥、腫瘤、動脈粥樣硬化、自體免疫系統疾病、神經系統疾病等多種疾病研究的熱點之一。近年來,隨著對S1P的產生以及其通過與S1PRs特異性結合并激活復雜下游信號的研究的逐漸深入,越來越多的以不同亞型S1PRs為特異性靶點的藥物逐漸被研發,本文對此作一綜述。
1S1P與S1PRs
鞘脂的代謝產物包括神經酰胺、鞘磷脂、S1P等,S1P主要由紅細胞、血小板和內皮細胞的細胞膜上的鞘磷脂在多種酶的催化作用下產生的。神經酰胺(Ceramide,CER)經神經酰胺合成酶脫羧化作用后轉化成鞘氨醇(Sphingosin,SPH),在鞘氨醇激酶(Sphingosine kinase,SphK)的作用下,SPH被磷酸化為S1P。此外,巨噬細胞、樹突狀細胞和肥大細胞等大部分細胞也分泌少量的S1P。S1P在很多生理和病理過程中發揮重要的調節作用。S1P1、S1P2、S1P3在腦、心臟、脾臟、肝臟、肺臟、胸腺、腎臟、骨骼肌等大部分組織中均有所表達,而S1P4主要在免疫系統的細胞表達,S1P5則主要在脾臟表達。SphK是一種高度保守的脂類激酶,具有互為異構的兩種形式,即SphK1和SphK2。SphK1主要存在于細胞質中,而SphK2主要存在于細胞核中。S1P經S1P裂解酶(S1P lyase)和S1P磷酸酶(S1P-phosphatases,SPP)發生不可逆的降解,以此維持生物體內S1P的動態平衡[1-2]。
早在1990年,首個S1PR在人臍靜脈內皮細胞上被提取出來,命名為S1PR1。隨后,S1PR2~5陸續被發現。這5個受體均與GTP結合調節蛋白(G蛋白)相偶聯。被認作是內皮分化基因家族(Endothelial differentiation genes,EDGs)的S1PR1~5亦分別被命名為EDG1、EDG5、EDG3、EDG6、EDG8。S1P通過與其受體S1PRs結合,在不同細胞中發揮生物學效應。很多細胞能通過自分泌或者旁分泌的方式分泌S1P,與S1PRs結合,并且有多種類型的細胞表達S1PRs,如免疫、心血管、中樞神經系統等。S1PRs在細胞的生長、分化、運動、存活、抗凋亡、成熟、血管生成等多種生物學功能上發揮重要作用,見表1[3-4]。
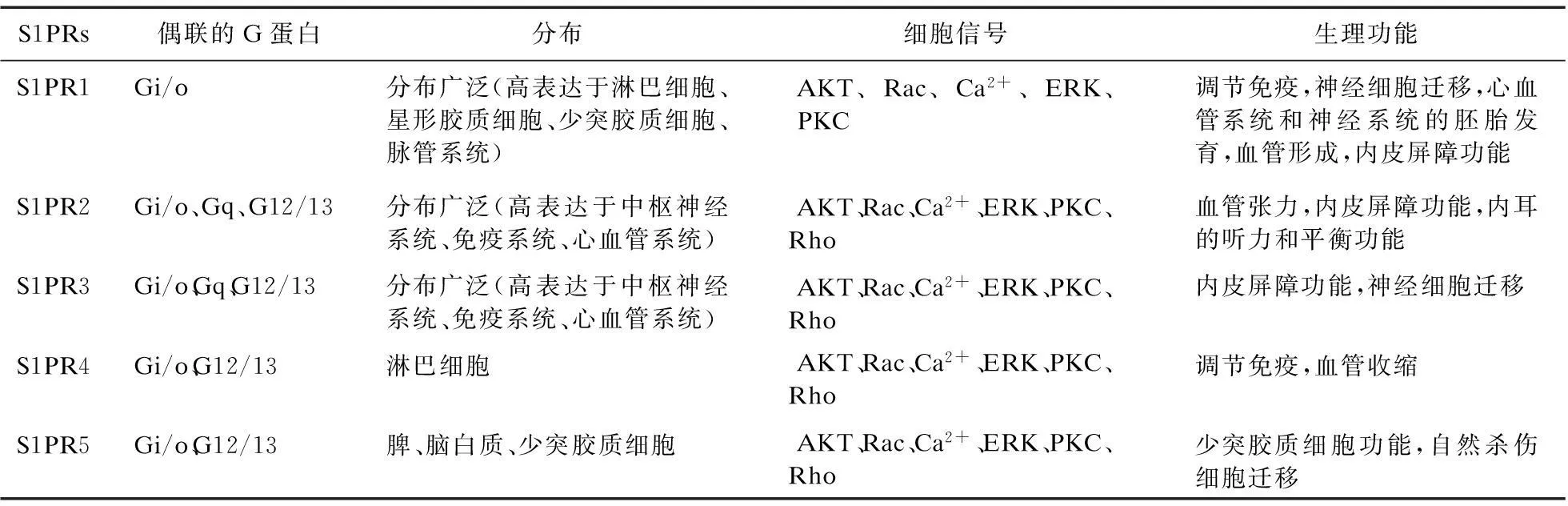
表1 S1PRs亞型的分布及其介導的細胞信號和生理功能
2Sphk-S1P-S1PR信號通路
鞘脂類及其代謝產物在膜受體介導的細胞信號傳導通路中具有重要作用。SphK-S1P-S1PR信號通路是一條有關細胞存亡、增殖的信號通路。S1P既是細胞外遞質,通過細胞表面受體作用于細胞外,與S1PRs結合,產生“由內而外”的信號通路,發揮生物學效應;又是細胞內信號轉導的第二信使,直接作用于細胞內的不同蛋白靶點介導多種生物學效應。
S1PR1~S1PR5均與Gi/o偶聯,與Gq偶聯的有S1PR2、S1PR3,除S1PR1外,其余的S1PRs均與G12/13偶聯。S1PRs與Gi/o偶聯后,可以激活下游的磷脂酶C(Phospholipase C,PLC)、Ras和磷脂酰肌醇3-激酶(Phosphatidylinositol-3-kinase,PI3K)。PLC通過激活下游的Ca2+和蛋白激酶C(Protein kinase C,PKC)調節細胞的趨化作用。Ras通過激活下游的細胞外信號調節激酶(Extracellular signal regulated kinase,ERK)調節細胞的增殖活性。PI3K通過激活下游的蛋白激酶(Protein kinase B,Akt)和Rac分別影響細胞的存活和運動性能。S1PRs與Gq偶聯后,可以激活下游的PLC,進而激活下游的Ca2+和PKC調節細胞的趨化作用。當G12/13被S1PRs激活后,下游的Rho被激活調節細胞的抗遷移性能,見表1[5-6]。Michael等[7]研究表明,S1P可以抑制組蛋白去乙酰化酶(Histone deacetylases,HDACs),相當于HDACs的抑制劑,可以保護組氨酸末端的賴氨酸不被去乙酰化,進而促進基因轉錄水平,通過表觀遺傳學調控細胞的存活。S1P亦可以通過調節腫瘤壞死因子受體相關因子2(TNF receptor-associated factor 2,TRAF2)、神經元細胞中的p位點APP裂解酶1(β-site APP cleaving enzyme1,BACE1)的活性調控基因的表達。
3S1PRs調節劑與疾病治療
2010年9月美國FDA批準的用于治療復發性多發性硬化一線治療的第一種口服藥物芬戈莫德(Fingolimod,FTY720)即為S1PRs靶向激動劑[8]。在體內,FTY720被SphK(SphK2為主)磷酸化為具有活性的pFTY720,pFTY720與S1P有化學結構同源性。除了FTY720,還有很多S1PRs激動劑和拮抗劑被研發(見表2)并逐漸應用于臨床[1]。S1PRs的調節劑在炎癥、腫瘤、動脈粥樣硬化、多發性硬化、阿爾茲海默病、自體免疫疾病等多種生理和病理過程中發揮重要的調節作用。
3.1S1PRs與腫瘤國內外大量研究表明,SphK1及其產物S1P有促進腫瘤生長、代謝、新生血管生成,抑制腫瘤凋亡的作用。癌變的組織往往高表達SphK1,這與腫瘤對放療、化療的耐藥及不良的預后有關。S1P可以通過減弱神經酰胺的促凋亡作用來增加腫瘤細胞的耐藥性。S1PR1是腫瘤細胞內及腫瘤微環境中信號傳導及轉錄活化因子3(Signal transducer and activator of transcription-3,STAT3)活化的關鍵元素,STAT3被激活后,白介素-6(Interleukin-6,IL-6)的表達上調,促進腫瘤細胞生長[7]。
S1PRs激動劑可誘導細胞發生凋亡首先報道于半胱天冬酶-3活化的雄激素依賴的前列腺癌細胞系,隨后在很多抗腫瘤模型中被證實具有抗腫瘤活性,且與其可誘導多種凋亡通路有關,即細胞凋亡的內在途經和外在途經[8]。內在途經又稱為線粒體途經,由線粒體膜上包括Bcl-2、Bad、Bax、Bid和Btf在內的Bcl-2家族所控制。線粒體在受到細胞內或細胞外的刺激后,膜的通透性會增加,使細胞色素C從線粒體內部釋放到細胞質中,使半胱天冬酶-3被激活,進而引發凋亡。外在途經又稱為死亡受體介導的凋亡途經,由Fas(即CD59)和Fas配體所介導。Fas與Fas配體結合后,使半胱天冬酶-8被激活,從而引發半胱天冬酶激活的瀑布式反應,最終通過激活的半胱天冬酶-3引發凋亡。

表2 S1PRs的調節劑
頭頸部的腫瘤往往因為藥物的毒副作用而限制了其治療效果,容易對放療和化療產生耐藥性[9-10]。在過去的20多年里,還沒有發現能顯著提高其緩解率的治療方法。但Edmonds等[9]研究表明,通過調節Sphk-S1P-S1PR信號通路,有助于減弱頭頸部對放療和化療的抵抗;Pchejetski等指出,對于前列腺癌,FTY720等可以增加體外培養的細胞或者異種移植小鼠模型對放療的敏感性。S1PRs調節劑為對傳統治療方法反應欠佳的腫瘤的治療提供了新的思路。
3.2S1PRs與心血管系統動脈粥樣硬化是一種與脂質代謝障礙有關的,以大中動脈內膜脂質沉著、粥樣斑塊形成、纖維組織增生、管壁硬化為特征的全身性疾病,是心血管疾病發生和發展的直接原因。在血液循環中,S1P大部分與高密度脂蛋白(High density lipoprotein,HDL)和白蛋白等血漿蛋白結合。在小鼠模型中,S1P類似物與S1PRs結合可以通過降低低密度脂蛋白(Low density lipoprotein,LDL)和載脂蛋白E (Apo lipoprotein E,ApoE )進而減少動脈粥樣硬化的發病[7]。這可能和其通過作用于S1PR1引起淋巴細胞減少,并使經典活化的M1型巨噬細胞向替代性活化的M2型巨噬細胞轉化有關。通過作用于S1PRs,膽固醇還可轉化成27-羥基膽固醇來發揮抗動脈粥樣硬化的活性。
3.3S1PRs與神經系統FTY720應用于復發性多發性硬化的治療是神經系統疾病治療史上以及將Sphk-S1P-S1PR信號通路應用于臨床治療的里程碑事件。多發性硬化是一種慢性自身免疫性的中樞神經系統疾病。T細胞介導的中樞神經系統炎性脫髓鞘病變是本病的主要發病機制。在中樞神經系統中,少突膠質細胞、星形膠質細胞、小膠質細胞等神經細胞均表達S1PRs,通過作用于S1PRs,FTY720可以抑制淋巴細胞外流,誘導淋巴細胞歸巢、凋亡,可以減弱淋巴細胞對中樞神經系統的浸潤,減少對中樞神經系統的免疫損傷[11-13]。長期暴露于pFTY720,S1PRs會發生不可逆的內化和功能性拮抗,失去活性。FTY720用于復發性多發性硬化的維持治療還可以顯著降低疾病的惡化程度和復發率,且口服給藥患者依從性良好,心動過緩等不良反應亦較少,患者耐受性良好。
3.4S1PRs與免疫系統當組織器官功能衰竭,發展至終末期時,器官移植已成為一種最有效的治療方法。免疫抑制劑可以降低移植物抗宿主反應,推動了器官移植的發展。作為一種新型免疫抑制劑,S1PRs在抗移植物免疫排斥反應中具有重要應用價值。S1PRs激動劑的化學結構和作用機制不同于環孢素、雷帕霉素、他克莫司等常規的免疫抑制劑,它可以直接作用于淋巴細胞,使淋巴細胞聚集在淋巴結、脾等次級淋巴器官中,可逆性地降低血液和胸腺組織中淋巴細胞的數目,但不會對淋巴細胞產生毒性作用[14-15]。如:S1PR1激動劑CYM-5442能改變多種免疫細胞,如樹突狀細胞、自然殺傷細胞、CD4+CD25+調節性T細胞等細胞的功能,進而引起機體在免疫反應上的改變,起到抗免疫排斥的作用。
4展望
隨著芬戈莫德在臨床上的應用,很多新研發的S1PRs激動劑已經進入如多發性硬化、潰瘍性結腸炎、銀屑病、器官移植等的臨床試驗,研發具有高度選擇性的S1PR調節劑,避免作用于其他S1PR亞型引起毒副作用,減少對機體正常免疫的抑制,避免誘發感染和腫瘤等,將是未來研究的熱點之一。
參考文獻:
[1]O′Sullivan C,Dev KC.The structure and function of the S1P1 receptor[J].Trends Pharmacol Sci,2013,34(7):401-412.
[2]Rosen H,Stevens RC,Hanson M,et al.Sphingosine-1-phosphate and its receptors:structure,signaling,and influence[J].Annu Rev Biochem,2013,82:637-662.
[3]Graler MH.The role of sphingosine 1-phosphate in immunity and sepsis[J].Am J Clin Exp Immunol,2012,1(2):90-100.
[4]Camm J,Hla T,Bakshi R,et al.Cardiac and vascular effects of fingolimod:Mechanistic basis and clinical implications[J].Am Heart J,2014,168(5):632-644.
[5]Maceyka M,Spiegel S.Sphingolipid metabolites in inflammatory disease[J].Nature,2014,10(7503):58-67.
[6]Kim RH,Takabe K,Allegood JC,et al.Estradiol induces export of sphingosine 1-phosphate from breast cancer cells via ABCC1 and ABCG2[J].The Journal of Biological Chemistry,2010,285(14):77-86.
[7]Maceyka M,Harikumar KB,Milstien S,et al.Sphingosine-1-phosphate signaling and its role in diaease[J].Trends Cell Biol,2012,22(1):50-60.
[8]Zhang L,Wang HD,Ji XJ,et al.FTY720 for cancer therapy[J].Oncology Reports,2013,30(6):2571-2578.
[9]Edmonds Y,Milstien S,Spiegel S.Development of small-molecule inhibitors of sphingosine-1-phosohate signaling[J].Pharmacol Ther,2011,132(3):352-360.
[10]Kageyama Y,Ikeda H,Watanabe N,et al.Antagonism of sphingosine 1-phosphate receptor 2 causes a selective reduction of portal vein pressure in bile duct-ligated rodents[J].Hepatology,2012,56(4):1427-1438.
[11]Groves A,Kihara Y,Chun J,et al.Fingolimod:direct CNS effects of sphingosine 1-phosphate(S1P) receptor modulation and implications in multiple sclerosis therapy[J].J Neurol Sci,2013,328(1-2):9-18.
[12]Subei AM,Cohen JA.Sphingosine 1-phosphate receptor modulators in multiple sclerosis[J].CNS Drugs,2015,29(7):565-575.
[13]Prager B,Spampinato SF,Ransohoff RM.Sphingosine 1-phosphate signaling at the blood-brain barrier[J].Trends Mol Med,2015,21(6):354-363.
[14]Garris CS,Blaho VA,Hla T,et al.Sphingosine-1-phosphate receptor 1 signalling in T cells:trafficking and beyond[J].Immunology,2014,142(3):347-353.
[15]Dominguez MR,Ersching J,Lemos R,et al.Re-circulation of lymphocytes mediated by sphingosine-1-phosphate receptor-1 contributes to resistance against experimental infection with the protozoan parasite Trypanosoma cruzi[J].Vaccine,2012,30(18):2882-2891.
Research progress on the receptors of the S1P
SHI Xiao-yan,LIAO Ai-jun*
(Department of Hematology,Shengjing Hospital of China Medical University,Shenyang 110004,China)
[Abstract]S1P is one of the important signal molecules which can regulate many biological functions inside and outside the cells.It plays an important role in regulating many physiological and pathological processes after being combined with S1P receptors.Sphk-S1P-S1PR signaling pathway has become a hot spot in the current research on inflammation,cancer,atherosclerosis,autoimmune system diseases,nervous system diseases and so on.More and more regulators of S1PRs are being developed.
Key words:Sphingosine 1-phosphate(S1P);S1P receptors;Sphk-S1P-S1PR signaling pathway;Regulators of S1P receptors
收稿日期:2015-11-11
基金項目:國家自然科學基金(81272629)
DOI:10.14053/j.cnki.ppcr.201604032
*通信作者

