立普妥對高糖誘導的HUVEC凋亡及PI3K/ AKT/ eNOS信號通路的影響
劉志輝(江西省景德鎮市第一人民醫院心內科,江西景德鎮 333000)
?
立普妥對高糖誘導的HUVEC凋亡及PI3K/ AKT/ eNOS信號通路的影響
劉志輝
(江西省景德鎮市第一人民醫院心內科,江西景德鎮 333000)
【摘要】目的 探討立普妥對高糖誘導的人臍靜脈內皮細胞(HUVEC)的凋亡及對磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/內皮型一氧化氮(eNOS)信號通路的影響。方法 實驗分為正常組,模型組(33. 3 mol/ L葡萄糖),立普妥組(33. 3 mol/ L葡萄糖+0. 1,1,10 μmol/ L);MTT法檢測各組HUVEC活力;倒置顯微鏡拍照檢測各組HUVEC形態;Annexin V-FITC/ PI流式雙染法檢測各組HUVEC凋亡;Gries法檢測各組HUVEC上清NO含量;Western blot分析PI3K/ AKT激活狀況及eNOS的表達情況。結果 與正常組比較,高糖組中HUVEC皺縮,變圓變亮,細胞活力降低,細胞早期凋亡和晚期凋亡率顯著提高,NO含量及eNOS、PI3K表達量及AKT磷酸化程度降低,差異均具有顯著性(P<0. 05);與模型組比較,1,10 μmol/ L立普妥組中HUVEC形態恢復,細胞活力上升,PI3K表達量提高,差異均具有顯著性(P<0. 05);0. 1,1,10 μmol/ L立普妥組HUVEC凋亡程度下降,NO含量、eNOS表達量提高,AKT磷酸化水平上升,差異均具有顯著性(P<0. 05)。結論 立普妥可抵抗高糖誘導的HUVEC凋亡,是通過激活PI3K/ AKT/ eNOS信號通路實現的。
【關鍵詞】立普妥;人臍靜脈內皮細胞(HUVEC);凋亡;PI3K/ AKT/ eNOS信號通路
糖尿病(diabetes mellitus)是一種以慢性高血糖為特征的內分泌疾病,其并發癥涉及心,眼,腎,糖尿病足和神經病變,這些都和血管損傷有關[1]。血管內皮在維持正常的血流速度及血管張力,氧化應激,抑制血管炎癥等方面具有重要作用。且糖尿病的預后及并發癥的發生和發展與整體血糖水平的升高密切相關[2]。因此,進一步深入研究高血糖引起的內皮細胞凋亡的機制對防治糖尿病血管病變具有重要的臨床意義。
立普妥,又稱阿托伐他汀鈣片,是3-羥基-3甲基戊二酰輔酶A還原酶選擇性抑制劑,可通過降低肝臟中膽固醇及脂質蛋白合成量來達到調節脂代謝目的,已大量用于臨床糖尿病,冠心病的治療。如立普妥通過調節脂代謝對2型糖尿病合并急性腦梗死患者具有治療作用[3]。立普妥可通過提高維生素D水平及骨密度含量來治療老年2型糖尿病患者[4]。通過超聲能觀察到立普妥可以逆轉2型糖尿病患者動脈粥樣硬化斑塊[5]。不同劑量立普妥對老年急性冠狀動脈綜合征患者有顯著治療作用[6]。并且立普妥對同型半胱氨酸[7],氧化型低密度脂蛋白(ox-LDL)[8],腫瘤壞死因子-α[9],高糖[10]誘導的HUVEC凋亡,但具體機制未知,因此本文在此基礎探討立普妥對高糖誘導的HUVEC凋亡抑制作用的機制。
1 材料和方法
1.1材料與試劑
人臍靜脈內皮細胞(HUVEC)購自美國標準生物品收藏中心,貨號:C-1161,培養于含10%胎牛血清的DMEM培養基中。立普妥,由輝瑞制藥提供,批號:95837021。葡萄糖購自阿拉丁,批號:G116307;兔抗eNOS,AKT,p-AKT,PI3K,GADPH單克隆抗體購自杭州Epitmics公司;NO檢測試劑盒,Annexin V-FITC流式細胞檢測試劑盒購自碧云天生物技術研究所,批號分別為:S0021,C1063;胎牛血清,DMEM培養基,四甲基偶氮唑鹽(MTT)購自美國Gibco公司。
1.2分組方法
將HUVEC分為3組,即正常組:正常HUVEC,模型組:33. 3 mol/ L葡萄糖,立普妥組:33. 3 mol/ L葡萄糖+0. 1,1,10 μmol/ L立普妥。
1.3細胞活力檢測(MTT法)
將處于生長對數期的HUVEC消化,并調整細胞濃度,接種于96孔板,按1. 2分組方法進行給藥,繼續培養24 h,并倒置顯微鏡下拍照,后每孔加MTT(5 mg/ mL)20 μL,4 h后,棄上清,并每孔加入DMSO 150 μL,10 min后,酶標儀570 nm處測定OD值。
1.4Annexin V-FITC流式細胞法檢測細胞凋亡
將處于生長對數期的HUVEC,消化,細胞濃度調整為8×103個細胞/ ml,接種于6孔板,按1. 2分組方法進行給藥,繼續培養48 h后,按照Annexin VFITC/ PI細胞凋亡檢測試劑盒說明書的方法,用0. 25%的胰蛋白酶(不含EDTA)消化,PBS洗滌,2000 r/ min離心5 min,收集細胞;加入Binding Buffer 500 μL懸浮細胞,隨后加入Annexin V-FITC 5 μL混勻后,加入PI 5 μL,混勻,于室溫避光反應5~15 min,在1 h內進行流式細胞儀檢測。
1.5細胞內NO含量
將處于生長對數期的HUVEC,消化,細胞濃度調整為8×103個細胞/ mL,接種于6孔板,按1. 2分組方法進行給藥,培養48 h,后離心收集細胞,反復凍融,使細胞內容物流出,取上清檢測NO含量,按照試劑盒說明書進行操作。
1.6Westernblotting
將處于生長對數期的HUVEC,消化,細胞濃度調整為8×103個細胞/ mL,接種于6孔板,按1. 2分組方法進行給藥,培養48 h。收集細胞樣本,加入RAPI裂解液裂解細胞,離心,獲得蛋白樣品。用BCA試劑盒檢測蛋白濃度。蛋白上樣,跑SDS凝膠電泳,濕法轉膜,脫脂奶粉封閉,加入一抗4℃孵育過夜,PBS洗滌三次。次日加二抗室溫孵育2 h,PBS洗滌三次,Biorad系統曝光。用“Quantity one”軟件對蛋白灰度值進行分析。
1.7統計學分析
數據通過SPSS17. 0進行統計分析。數據以x-± s表示,t檢驗分析組間差異的顯著性。P<0. 05表示兩組間差異有統計學意義。
2 結果
2.1立普妥對高糖誘導的HUVEC細胞形態及活力的影響
如圖1所示,與正常組比較,模型組中HUVEC細胞皺縮,細胞變圓變亮;與模型組比較,1,10 μmol/ L立普妥組中細胞形態恢復。如圖2所示,與正常組比較,模型組中HUVEC細胞活力下降,具有顯著性差異(P<0. 01);與模型組比較,1,10 μmol/ L立普妥組細胞活力提高,具有顯著性差異(P< 0. 05)。說明1,10 μmol/ L立普妥能顯著抑制高糖誘導的HUVEC細胞形態異常及活力下降。
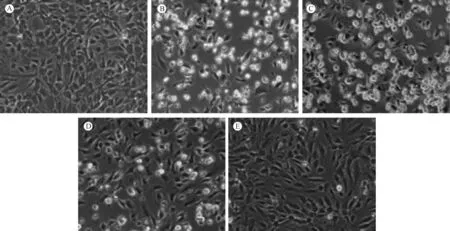
圖1 立普妥對高糖誘導的HUVEC細胞形態的影響Note:A:normal group;B:model group;C:0. 1 μmol/ L lipitor;D:1 μmol/ L lipitor;E:10 μmol/ L lipitor.Fig. 1 Effect of lipitor on morphology of HUVEC
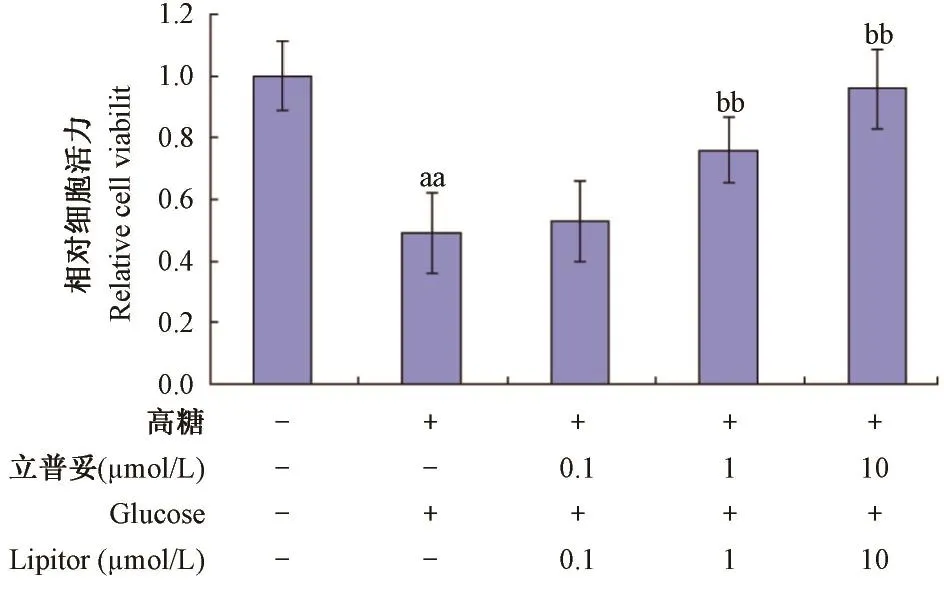
圖2 立普妥對高糖誘導的HUVEC活力的影響Note:Compared with normal group,aaP<0. 01;Compared with model group,bbP<0. 01.Fig. 2 Effect of lipitor on viability of HUVEC induced by high glucose
2.2立普妥對高糖誘導的HUVEC凋亡的影響
如表1所示,與正常組比較,模型組中HUVEC早期凋亡和晚期凋亡細胞數目顯著提高,具有顯著性差異(P<0. 01);與模型組比較,0. 1,1,10 μmol/ L立普妥組HUVEC早期凋亡和晚期凋亡數目都顯著降低,具有顯著性差異(P<0. 05)。
表1 立普妥對高糖誘導的HUVEC凋亡的影響(±s)Tab. 1 Effect of lipitor on apoptosis of HUVEC

表1 立普妥對高糖誘導的HUVEC凋亡的影響(±s)Tab. 1 Effect of lipitor on apoptosis of HUVEC
注:與正常組比較,aaP<0. 01;與模型組比較,bP<0. 05,bbP<0. 01。Note:Compared with normal group,aaP<0. 01;Compared with model group,bP<0. 05,bbP<0. 01.
induced by high glucose(±s)組別 劑量(μmol/ L)早期凋亡(%)晚期凋亡(%)正常組組 - 0. 52±0. 13 2. 57±0. 19模型組(33. 3 M) - 8. 78±0. 55aa34. 41±3. 09aa0. 1 7. 98±1. 21b 26. 22±2. 99b立普妥組 1 6. 59±0. 59bb15. 84±1. 67bb10 3. 22±0. 30bb 9. 78±0. 55bb
2.3立普妥對高糖誘導的HUVEC中NO含量的影響
如圖3所示,與正常組比較,模型組中NO含量下降,具有顯著性差異(P<0. 01);與模型組比較,0. 1,1,10 μmol/ L立普妥組中NO含量顯著提高,具有顯著性差異(P<0. 05)。
2.5立普妥對高糖誘導的HUVEC中PI3K/ AKT信號通路的影響
如圖4所示,與正常組比較,模型組中PI3K表達及AKT磷酸化程度降低,具有顯著性差異(P<0. 01);與模型組比較,1,10 μmol/ L立普妥組PI3K表達量顯著提高,具有顯著性差異(P<0. 01);0. 1,1,10 μmol/ L立普妥組AKT磷酸化水平顯著提高,具有顯著性差異(P<0. 05)。
2.6立普妥對高糖誘導的HUVEC中eNOS表達量的影響
如圖5所示,與正常組比較,模型組中eNOS表達量降低,具有顯著性差異(P<0. 01);與模型組比較,0. 1,1,10 μmol/ L立普妥組中eNOS表達量顯著提高,具有顯著性差異(P<0. 01)。
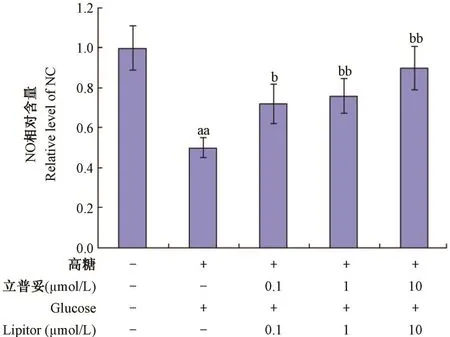
圖3 立普妥對高糖誘導的HUVEC中NO含量的影響Note:Compared with normal group,aaP<0. 01;Compared with model group,bP<0. 05,bbP<0. 01.Fig. 3 Effect of lipitor on level of NO in HVEC induced by high glucose
3 討論
糖尿病心血管病變始于內皮細胞功能紊亂,內皮細胞功能紊亂以內皮細胞凋亡加速,內皮細胞分泌因子失衡,內皮細胞與白細胞反應增多等主要表現。內皮細胞作為血管的機械屏障受損,成為內皮細胞功能紊亂的主要表現。并且糖尿病患者大血管病變危險性增高與高糖所導致的血管內皮細胞功能受損及內皮細胞凋亡有關。細胞凋亡具有典型的生化和形態學改變,主要表現為細胞膜出現囊泡、膜磷脂不對稱消失、細胞膜皺縮、核固縮、DNA有序片段化等。Song[11],Chen等[12]實驗發現在高糖環境下,HUVEC細胞凋亡顯著。本實驗發現與上述報告一致,即高濃度葡萄糖作為誘導劑,可使HUVEC細胞皺縮,細胞變圓變亮,細胞凋亡率提高。立普妥對同型半胱氨酸[7],氧化型低密度脂蛋白(ox-LDL)[8],腫瘤壞死因子-α[9]誘導的HUVEC凋亡。立普妥能立普妥亦能減輕ox-LDL誘導的人微血管內皮細胞損傷[13]。本實驗也發現一定劑量立普妥能顯著抑制高糖誘導的HUVEC細胞凋亡,并改善細胞形態,與謝彬等[10]觀點一致。

圖4 立普妥對高糖誘導的HUVEC中PI3K/ AKT信號通路的影響Note:Compared with normal group,aaP<0. 01;Compared with model group,bP<0. 05,bbP<0. 01.Fig. 4 Effect of lipitor on PI3K/ AKT signal pathway in HVEC induced by high glucose
高糖會使血管內皮依賴性血管舒張功能減退,血流速度下降,且血管舒張功能與血糖濃度負相關,提示高濃度的葡萄糖可誘導血管內皮細胞功能的異常[2]。NO是源于內皮細胞一種血管保護因子,廣泛分布于各種組織,在信息傳遞,心肺功能,臟器血流調節等方面具有重要作用。正常生理條件下,由內皮型一氧化氮合酶(eNOS)催化產生,在高糖等條件下所產生的大量超氧陰離子可抑制eNOS的生物活性,使NO生成減少,抑制NO生物活性,使NO的血管保護作用減弱,因此改善血管內皮形態及NO及其合酶的含量具有重要意義。替米沙坦聯合立普妥能改善糖尿病大鼠內皮形態及功能[14]。立普妥可通過提高NO含量來保護ox-LDL誘導的HUVEC縫隙連接,從而發揮抗動脈粥樣硬化作用[8]。立普妥聯合氨氯地平能抑制ox-LDL誘導的HUVEC內皮細胞損傷,與上調eNOS表達有關[15]。立普妥能通過提高NO含量來抑制ox-LDL誘導的HUVEC損傷[16]。立普妥能夠促進eNOS蛋白及mRNA表達,減少ox-LDL誘導的副作用,并可以選擇性地維持NO介導的內皮依賴性動脈松弛[17]。與上述報告一致,本實驗也發現高糖誘導使NO及eNOS含量顯著下降,給予一定劑量立普妥能使NO含量及eNOS表達量顯著上升,說明立普妥可通過刺激NO表達來改善內皮功能。
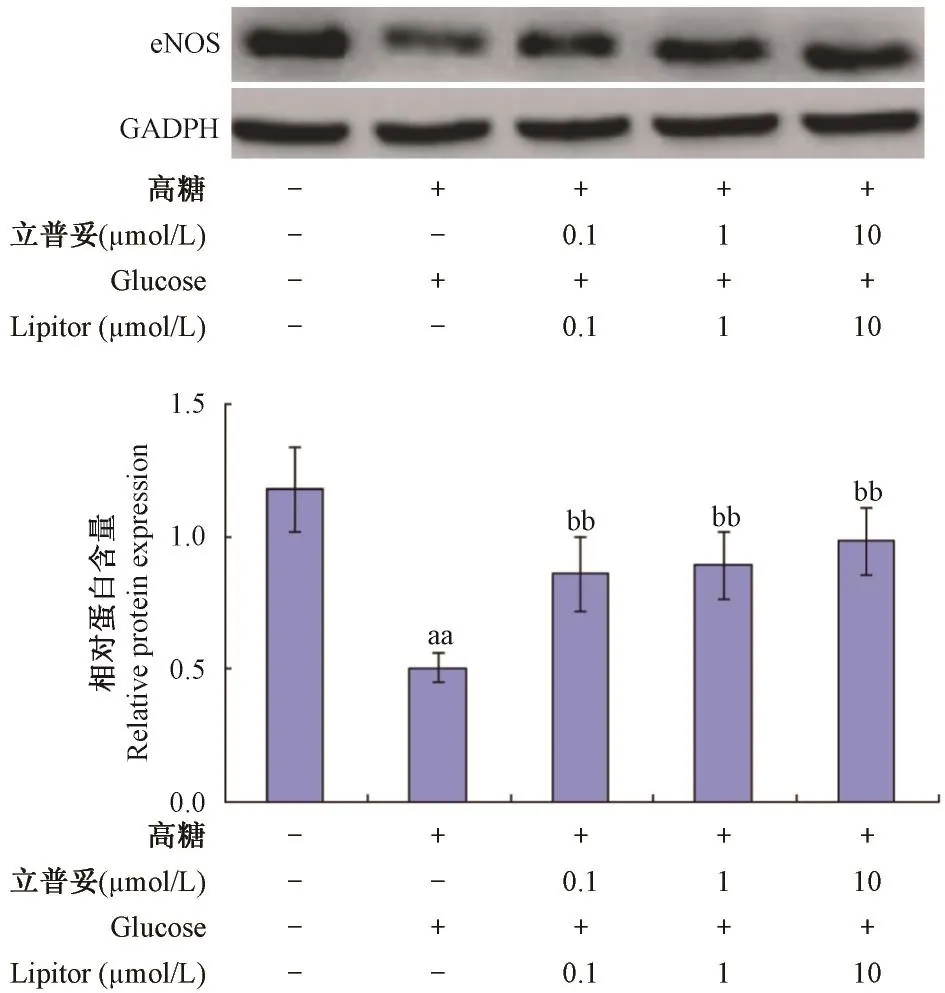
圖5 立普妥對高糖誘導的HUVEC中eNOS表達量的影響Note:Compared with normal group,aaP<0. 01;Compared with model group,bbP<0. 01.Fig. 5 Effect of lipitor on the expression of eNOS in HVEC induced by high glucose
磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)信號通路參與內皮細胞增殖、分化、凋亡、NO分泌等多種細胞功能的調節。HUVEC的凋亡與PI3K/ AKT信號通路密切相關[18]。高糖誘導的HUVEC凋亡是通過PI3K/ AKT信號通路實現的[19-20]。因此激活PI3K/ AKT信號通路一定程度上可維持HUVEC細胞活性。并且已報道立普妥可以通過激活PI3K/ AKT通路來抑制谷氨酸誘導的大鼠神經元損傷[21]。立普妥可通過激活PI3K/ AKT信號通路來GK大鼠心肌缺血再灌注損傷[22]。立普妥可通過激活PI3K/ AKT/ GSK3β信號通路來減輕缺血復合冷應激誘導的大鼠心肌損傷[23]。立普妥可以通過激活PI3K/ AKT/ mTOR通路來刺激大鼠皮質神經元突起生長[24]。與上述報告類似,本實驗也發現高糖誘導使PI3K表達量及AKT磷酸化水平顯著降低,給予一定劑量立普妥能使PI3K表達量及AKT磷酸化水平顯著提高,說明立普妥可通過激活PI3K/ AKT信號通路來維持內皮細胞存活。
糖尿病造成PI3K/ AKT信號級聯的失活,eNOS是調控內皮源性一氧化氮產生的關鍵酶,亦受PI3K/ AKT信號通路調控。高胰島素可通過PI3K/ AKT/ eNOS信號通路損傷HUVEC,產生胰島素抵抗等代謝綜合征及2型糖尿病[25]。胰高血糖素樣肽-1能減輕高糖引起的HUVEC凋亡,與激活PI3K/ AKT/ eNOS信號通路有關[26]。骨鈣蛋白可通過激活PI3K/ AKT/ eNOS通路減輕高脂飲食誘導的內皮依賴性舒張損傷[27]。羅格列酮[28],α-亞麻酸[29]可通過PI3K/ AKT/ eNOS信號通路抑制高糖誘導的HUVEC凋亡。從而進一步說明,立普妥也是通過PI3K/ AKT/ eNOS信號通路減輕高糖誘導的HUVEC凋亡。
綜上所述,立普妥可抑制高糖誘導的HUVEC細胞凋亡,并提高細胞活力改善細胞形態,與激活PI3K/ AKT/ eNOS信號通路有關。
參考文獻:
[1] Sardar P,Udell JA,Chatterjee S,et al. Effect of intensive versus standard blood glucose control in patients with type 2 diabetes mellitus in different regions of the world:systematic review and meta-analysis of randomized controlled trials[J]. J Am Heart Assoc,2015,4(5).
[2] Stubbs B,Vancampfort D,De Hert M,et al. The prevalence and predictors of type two diabetes mellitus in people with schizophrenia:a systematic review and comparative meta-analysis [J]. Acta Psychiatr Scand,2015.
[3] 李運成.阿托伐他汀對2型糖尿病合并急性腦梗死患者血清內脂素的干預作用[J].中國實用醫藥,2014,9(31):131 -132.
[4] 郭雅卿,趙丹寧,鞏建萍,等.不同劑量阿托伐他汀對老年2型糖尿病患者維生素D和骨密度的影響[J].中國全科醫學,2011,14(7A):2169-2171.
[5] 張建寧.超聲觀察立普妥逆轉2型糖尿病患者動脈硬化斑塊的療效評價[J].中國醫學工程,2012,20(10):148-149.
[6] 劉驍.不同劑量阿托伐他汀對老年ACS患者血漿hs-CRP及NT-proBNP表達的影響[J].重慶醫學,2014,43(12):1532 -1533.
[7] 李錄,邱榮榮,賈紹斌,等.阿托伐他汀調節Bcl-2/ Bax蛋白表達抑制同型半胱氨酸誘導內皮細胞凋亡[J].中國現代醫學雜志,2014,24(30):24-27.
[8] 張秀梅,于曉玲,申玉超,等.阿托伐他汀對ox-LDL誘導的人臍靜脈內皮細胞縫隙連接的影響[J].中國藥房,2013,24 (5):412-415.
[9] 牛榮華,毛德軍,臧運華,等.阿托伐他汀下調腫瘤壞死因子-α誘導的人臍靜脈內皮細胞CD40配體的表達[J].現代免疫學,2014,34(3):237-241.
[10] 謝彬,呂湛,茍連平,等.阿托伐他汀通過調節Bcl-2/ Bax蛋白表達抑制高糖誘導的人臍靜脈內皮細胞凋亡[J].中國動脈硬化雜志,2010,18(12):943-947.
[11] Song H,Wu F,Zhang Y,et al. Irisin promotes human umbilical vein endothelial cell proliferation through the ERK signaling pathway and partly suppresses high glucose-induced apoptosis [J]. PLoS One,2014,9(10):e110273.
[12] Hou Q,Lei M,Hu K,et al. The effects of high glucose levels on reactive oxygen species-induced apoptosis and involved signaling in human vascular endothelial cells[J]. Cardiovasc Toxicol,2015,15(2):140-146.
[13] 李敏,孫玲,李紅玲,等.阿托伐他汀減輕氧化型低密度脂蛋白導致的人微血管內皮細胞活化和損傷[J].中國藥理學通報,2014,30(5):679-683.
[14] 吳仕平,陳明.替米沙坦聯合阿托伐他汀對糖尿病大鼠內皮細胞形態、功能的影響[J].中國動脈硬化雜志,2010,18(7):542-546.
[15] 高艷芳,湯嘉寧.阿托伐他汀與氨氯地平對ox-LDL損傷的人臍靜脈內皮細胞LOX-1和eNOS表達的影響[J].中國藥物與臨床,2012,12(7):884-886.
[16] 李艷偉,于曉玲,申玉超.阿托伐他汀對ox-LDL誘導的人臍靜脈內皮細胞中Wnt信號通路及相關因子表達的影響[J].中國藥房,2014,25(17):1574-1577.
[17] Wassmann S,Laufs U,Baumer AT,et al. HMG-CoA reductase inhibitors improve endothelial dysfunction in normocholesterolemic hypertension via reduced production of reactive oxygen species[J]. Hypertension,2001,37(6):1450 -1457.
[18] Li P,Guo X,Lei P,et al. PI3K/ Akt/ uncoupling protein 2 signaling pathway may be involved in cell senescence and apoptosis induced by angiotensin II in human vascular endothelial cells[J]. Mol Biol Rep,2014,41(10):6931-6937.
[19] Chen HF,Liu SJ,Chen G. Heat shock protein 27 phosphorylation in the proliferation and apoptosis of human umbilical vein endothelial cells induced by high glucose through the phosphoinositide 3kinase/ Akt and extracellular signalregulated kinase 1/2 pathways[J]. Mol Med Rep,2015, 11(2):1504-1508.
[20] Sheu ML,Ho FM,Yang RS,et al. High glucose induces human endothelial cell apoptosis through a phosphoinositide 3-kinaseregulated cyclooxygenase-2 pathway[J]. Arterioscler Thromb Vasc Biol,2005,25(3):539-545.
[21] 丁奇,董燕,金英,等.阿托伐他汀對谷氨酸引起大鼠神經元損傷保護作用機制的研究[J].中國藥理學通報,2010,26 (12):1635-1640.
[22] 程振東,吳靈振,郭進建,等.阿托伐他汀后處理對GK大鼠心肌缺血再灌注損傷的保護作用[J].中國動脈硬化雜志,2012,20(8):709-713.
[23] 黃茶花,謝遙,黃曉,等.阿托伐他汀減輕缺血復合冷應激誘導的大鼠心肌損傷[J].基礎醫學與臨床,2011(11):1200 -1204.
[24] 屈文慧,郁盛雪,隋海娟,等.阿托伐他汀通過激活PI3K/ Akt/ mTOR信號轉導而促進神經元突起生長[J].中國藥理學與毒理學雜志,2013,27(2):150-155.
[25] Madonna R,De Caterina R. Prolonged exposure to high insulin impairs the endothelial PI3-kinase/ Akt/ nitric oxide signalling [J]. Thromb Haemost,2009,101(2):345-350.
[26] Yuan X,Chen K,He H,et al.[Effect of GLP-1 on high glucose-induced human umbilical vein endothelial cell apoptosis and mechanism][J]. Zhongnan Daxue Xuebao Yixue Ban,2013,38(10):1029-1034.
[27] Dou J,Li H,Ma X,et al. Osteocalcin attenuates high fat dietinduced impairment of endothelium-dependent relaxation through Akt/ eNOS-dependent pathway[J]. Cardiovasc Diabetol,2014,13:74.
[28] Wu J,Lei MX,Xie XY,et al. Rosiglitazone inhibits high glucose-induced apoptosis in human umbilical vein endothelial cells through the PI3K/ Akt/ eNOS pathway[J]. Can J Physiol Pharmacol,2009,87(7):549-555.
[29] Zhang W,Wang R,Han SF,et al. Alpha-linolenic acid attenuates high glucose-induced apoptosis in cultured human umbilical vein endothelial cells via PI3K/ Akt/ eNOS pathway [J]. Nutrition,2007,23(10):762-770.
〔修回日期〕2016-01-10
Effect of lipitor on high glucose-induced HUVEC apoptosis and PI3K/ AKT/ eNOS signal pathway
LIU Zhi-hui
(Department Cardiovascular of the First People’s Hospital,Jingdezhen,Jiangxi Jingdezhen 333000,China)
【Abstract】Objectives To explore effect of lipitor on apoptosis and phosphatidyl inositol-3-kinase(PI3K)/ protein kinase B(AKT)/ endothelial nitric oxide synthase(eNOS)signal pathway in high glucose-induced human umbilical vein endothelial cell(HUVEC). Methods The cases were randomly divided into normal control group,model control group(33. 3 mol/ L glucose),lipitor low,medium,high-dose group(0. 1,1,10 μmol/ L lipitor). The viability of HUVEC was detected by MTT assay. The morphology of HUVEC was photographed by inverted microscope. The apoptosis of HUVEC was examed by Annexin V-FITC/ PI flow dual-staining method. The concertration of NO in HUVEC supernatant was exmaed by Gries method. The activation of PI3K/ AKT and expression of eNOS was assayed by western blot. Results HUVEC was shrinkage,rounded and brighten,the viability of HUVEC decreased,early and late apoptosis rate of HUVEC increased significantly,the level of NO,eNOS,PI3K and AKT phosphorylation also reduced in model control group(P<0. 01). 1,10 μmol/ L lipitor improved HUVEC morphology,increased HUVEC’viability and expression of PI3K(P<0. 05). 0. 1,1,10 μmol/ L lipitor suppressed HUVEC’apoptosis,increased the concentration of NO,expression of eNOS and phosphorylation of AKT(P<0. 05). Conclusion These results suggested lipitor exert anti-apoptosis in high glucose -induced HUVEC,which might be related to PI3K/ AKT/ eNOS signal pathway.
【Key words】Lipitor;HUVEC;Apoptosis;PI3K/ AKT/ eNOS signal pathway
【中圖分類號】R-332
【文獻標識碼】A
【文章編號】1671-7856(2016)03-0058-06
doi:10. 3969. j. issn. 1671-7856. 2016. 03. 012

