藏紅花球莖組織培養條件的研究
李 濤,李春斌,范圣第
(1.大連民族大學 國家民委-教育部生化工程重點實驗室,遼寧 大連 116605;2.中美華世通(武漢)生物醫藥科技有限公司,湖北 武漢 430070)
?
藏紅花球莖組織培養條件的研究
李濤1,2,李春斌1,范圣第1
(1.大連民族大學 國家民委-教育部生化工程重點實驗室,遼寧 大連 116605;2.中美華世通(武漢)生物醫藥科技有限公司,湖北 武漢 430070)
摘要:以藏紅花球莖側芽為外植體,通過植物組織培養的方式建立藏紅花快速繁殖體系。研究表明:以MS為基本培養基,附加0.5 mg·L-16-BA+4.0 mg·L-12,4-D,在黑暗條件下最適于藏紅花愈傷組織的誘導,并且20 d誘導率可以達到96.7 %;附加2.0 mg·L-16-BA+0.5 mg·L-1NAA,在黑暗條件下最適合藏紅花叢生芽的誘導與增值,叢生芽誘導率可達96 %;附加5.0 mg·L-16-BA +1.5 mg·L-1NAA+0.3 g·L-1AC,在1 500~2 000 lx的光照條件下,30 d左右新生小球莖誘導率高達90 %。
關鍵詞:藏紅花;組織培養;愈傷組織;小球莖
藏紅花(CrocussativusL.),別名番紅花、西紅花,屬于鳶尾科番紅花屬多年生草本植物。藏紅花原產于西班牙、希臘、南歐各國以及伊朗等地[1],后經印度傳到中國,如今在江浙和華北都有種植[2]。在治療精神類疾病、神經退行性疾病、學習記憶障礙、心血管方面顯示出潛在的藥用價值[3-4]。由于藏紅花只能依靠球莖無性繁殖,并且在種植過程中隨著繁殖代數的增加球莖越來越小,小球莖開花少且較小,甚至不開花,從而失去了藥用價值[5]。藏紅花僅僅是柱頭入藥,但因適合其種植的地域有限且種植條件苛刻等因素,以致其產量極低,來源極為有限,價格昂貴。應用植物組織細胞培養的方法能夠很好地解決藏紅花種球病毒積累、品質退化、繁殖系數低甚至失去藥用價值等問題。
本實驗以藏紅花球莖側芽為外植體,從不同培養條件上研究藏紅花愈傷組織、叢生芽和小球莖的發生,探索出一條人工繁殖藏紅花球莖的途徑,以期提高藏紅花的繁殖系數,解決球莖退化、資源短缺等問題。
1材料與方法
1.1材料
本實驗室藏紅花球莖來自于大連市,取材時間為當年的5月底,此時的球莖正處于休眠期。基本培養基分別為MS、1/2MS、N6、B5培養基;激素分別為6-芐氨基腺嘌呤(6-BA)、2,4-二氯苯氧乙酸( 2,4-D )、α-萘乙酸 (NAA)、玉米素(ZT)。
1.2方法
1.2.1培養基的配制
分別以MS、1/2MS、N6和B5為基本培養基,所有的固體培養基中均添加30 g·L-1的蔗糖和6.5 g·L-1的瓊脂,調pH為5.8~6.2,根據實驗的需要添加6-BA、2,4-D、NAA、ZT和AC等其他附加物后分裝到培養小瓶中,最后在121 ℃下滅菌15 min備用。
1.2.2外植體的消毒方法
以保存于4 ℃冰箱中8周的休眠藏紅花球莖為外植體,在流水沖洗下去掉球莖表面的泥土和皮膜,剔除清洗不干凈的病斑后,將其中已萌發的芽連同球莖一起切下,在流水下沖洗過夜。在已通過紫外除菌的潔凈工作臺上將藏紅花球莖和側芽轉入到75 %乙醇滅菌1min,再轉入0.1 %~0.2 %的升汞或5 %次氯酸鈉中,消毒5~20 min,然后用無菌水沖洗5次,無菌濾紙吸去多余的水分,備用。每瓶接種3個外植體,3種不同的消毒方式分別接種10瓶,一周后觀察不同的消毒劑對藏紅花染菌率的影響。
1.2.3接種及愈傷組織誘導
在無菌操作臺上將已消毒處理好的球莖側芽切成1 cm左右的小段,分別將其接種到添加了0.5 mg·L-16-BA+2.0 mg·L-12,4-D的MS、1/2MS、N6和B5培養基中,分別附加不同的激素,并在不同溫度下進行暗培養,觀察研究4種不同的基本培養基與藏紅花愈傷組織誘導的關系,同時篩選出適合誘導愈傷組織的最佳培養基。
1.2.4叢生芽誘導與繼代培養
將上述經繼代培養獲得的愈傷組織切塊后分別轉接到添加了0~3 mg·L-16-BA和NAA與添加了0~3 mg·L-1ZT和NAA的MS基本培養基中,在優化溫度和黑暗條件下進行叢生芽的誘導。培養一個月后,觀察統計藏紅花愈傷組織芽的分化情況,篩選出最適合藏紅花愈傷組織分化出芽的培養基。利用優化的培養基,在優化的溫度條件下分別以暗培養、光照培養和1 500~2 000 lx與16 h·d-1光照的方式進行藏紅花愈傷組織叢生芽的誘導。將誘導出的叢生芽在優化的條件下進一步繼代培養。
1.2.5球莖誘導培養
取經繼代增殖培養后的叢生芽分別轉接到添加了0~5 mg·L-16-BA和NAA的MS+0.3 g·L-1AC培養基中觀察活性炭存在下激素對球莖誘導的作用,再向上述優化的培養基中添加0~1 g·L-1AC,觀察活性炭質量濃度對球莖誘導的作用,且均在優化溫度、1 500~2 000 lx和14 h·d-1光照下培養。
2結果與分析
2.1培養基對愈傷組織誘導的影響
采用4種不同的培養基來進行藏紅花愈傷組織的誘導,篩選出藏紅花愈傷組織誘導的最佳培養基,結果見表1。

表1 基本培養基對愈傷組織誘導的影響
由表1可發現,當以N6為基礎培養基時愈傷組織的誘導率為0 %,以1/2MS和B5為基礎培養基時愈傷組織的誘導率都相對較低,以MS為基礎培養基時愈傷組織的誘導率為83.3 %,表明最適合藏紅花愈傷組織誘導的是MS培養基,這也與MS培養基是目前使用最普遍的培養基,具有較高的無機鹽濃度,能夠保證組織生長所需的礦質營養,還能加速愈傷組織的生長特點相吻合。
2.2不同消毒方法與外植體染菌率的關系
實驗以不同濃度的消毒劑處理不同的時間來研究不同的消毒方法對藏紅花離體培養染菌率的影響。統計結果見表2。
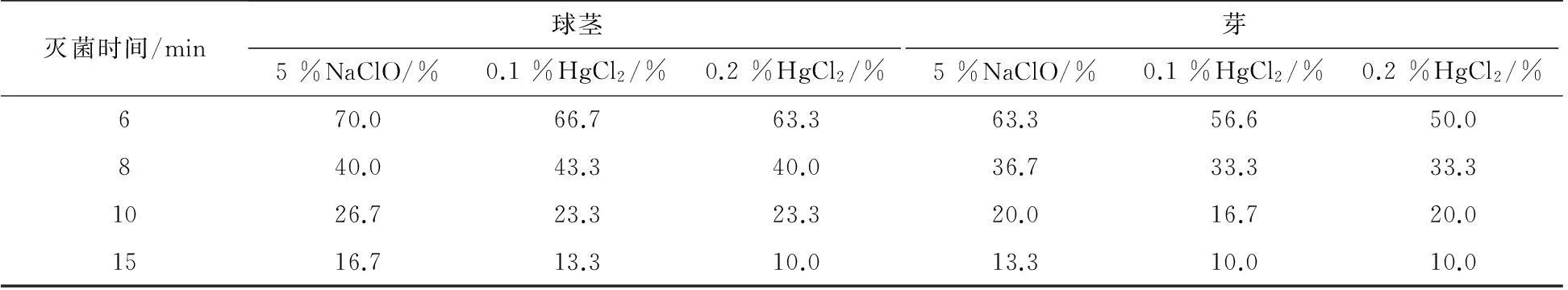
表2 不同消毒方法對外植體染菌率的影響
經分析發現,在相同時間下不同消毒劑對染菌率的影響,氯化高汞的滅菌效果相對比次氯酸鈉好;在相同的消毒劑下處理不同的時間,其滅菌效果差異顯著。經LSD法分析,處理時間在6 ,8,10 min時,滅菌效果差異非常顯著,而在10 min和15 min時滅菌效果不十分明顯。當以升汞處理時間為6~10 min時,外植體的染菌率高達50.0 %以上, 10~15 min時,其染菌率可降低到20 %左右。然而從愈傷組織誘導率和消毒劑對外植體的傷害來看,并不是處理的時間越長越好,當0.1 %升汞或0.2 %升汞處理時間超過15 min后,部分外植體出現病變腐爛現象,從而導致其不能正常地誘導出愈傷組織,因此降低了愈傷組織的誘導率。綜合考慮愈組織誘導率和外植體的染菌率,認為以75 %乙醇消毒1 min外加0.1 %升汞消毒10 min的組合方式來處理藏紅花組織培養中的外植體較為合適。
2.3培養溫度對愈傷組織誘導的影響
通過將外植體接種到相同的無菌培養基中,利用光照培養箱在(16±0.3) ℃、(18±0.3) ℃、(20±0.3) ℃、(22±0.3) ℃和(24±0.3) ℃下培養1個月,統計結果見表3。
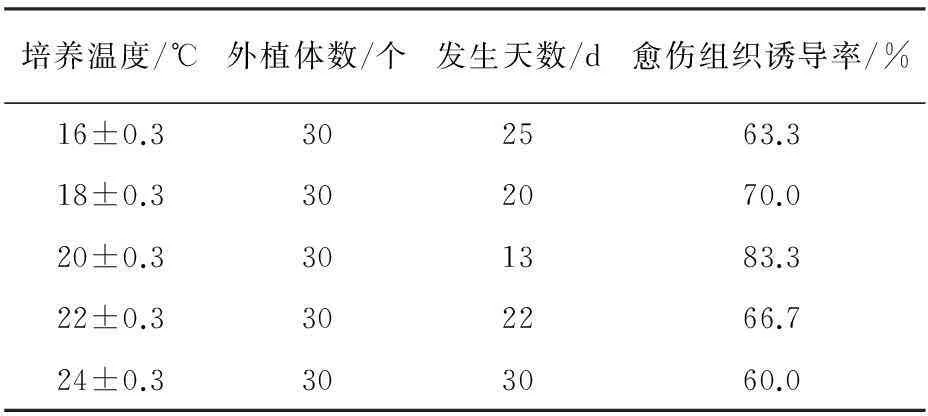
表3 溫度對愈傷組織誘導的影響
溫度過高或過低都不利于藏紅花愈傷組織的快速誘導和誘導率的提高,研究結果表明,愈傷組織的最佳誘導溫度為(20±0.3) ℃,因此本實驗選擇(20±0.3) ℃作為藏紅花愈傷組織的誘導最佳溫度。
2.4激素對愈傷組織誘導的影響
將球莖側芽接種于以MS為基本培養基且添加了不同質量濃度和配比的6-BA和2,4-D中,利用光照培養箱,在培養溫度為(20±0.3) ℃和黑暗條件下培養10 d左右,外植體切口處開始張裂,有顆粒狀的物質出現時,再連續培養20 d左右后形成黃色顆粒狀的愈傷組織(如圖1)。

圖1 藏紅花球莖側芽愈傷組織的誘導
通過接種后一個月的觀察,記錄統計結果見表4。在僅僅添加2,4-D時不能成功的誘導出愈傷組織,其誘導率為0 %。當存在定量的6-BA協同作用時,2,4-D質量濃度過高或過低都不利于愈傷組織誘導率提高和愈傷組織快速誘導,同時6-BA質量濃度過大也不利于藏紅花愈傷組織誘導率的提高。研究結果表明,藏紅花愈傷組織誘導的最適激素配比為0.5 mg·L-16-BA+4.0 mg·L-12,4-D,其中藏紅花愈傷組織誘導率為96.7 %。
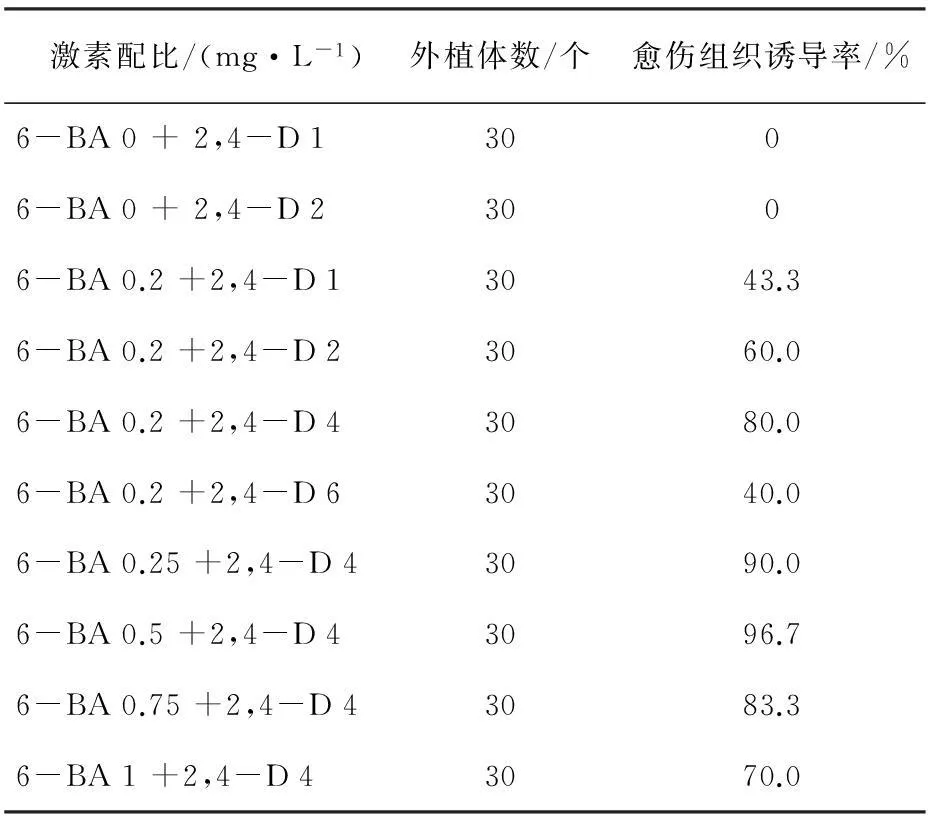
表4 不同激素組合對藏紅花愈傷組織誘導的影響
2.5激素對叢生芽誘導的影響
將已形成的愈傷組織中生長狀態相對一致的轉接到附加了不同質量濃度激素配比的分化培養基中,利用光照培養箱在(20±0.3) ℃和暗培養條件下進行藏紅花無菌叢生芽的誘導培養。在培養過程中發現,除了形成愈傷組織外,逐漸有些突起形成白色披針形的葉片,慢慢形成叢生芽(如圖2),將叢生芽進一步繼代培養以后得到更多的叢生芽(如圖3)。

圖2 藏紅花愈傷組織分化出叢生芽
通過對愈傷組織分化培養一個月的觀察,統計結果(見表5)表明,當較高質量濃度的6-BA與較低質量濃度的NAA相互協同作用時,能成功誘導出藏紅花叢生芽,但是6-BA的質量濃度太高或NAA的質量濃度太低對叢生芽的誘導都不利,其中6-BA 與ZT相比更有利于叢生芽的誘導,當激素配比是2.0 mg·L-16-BA+0.5 mg·L-1NAA時,藏紅花的叢生芽誘導率最高,且最高可達到96 %。

圖3 藏紅花的繼代增值
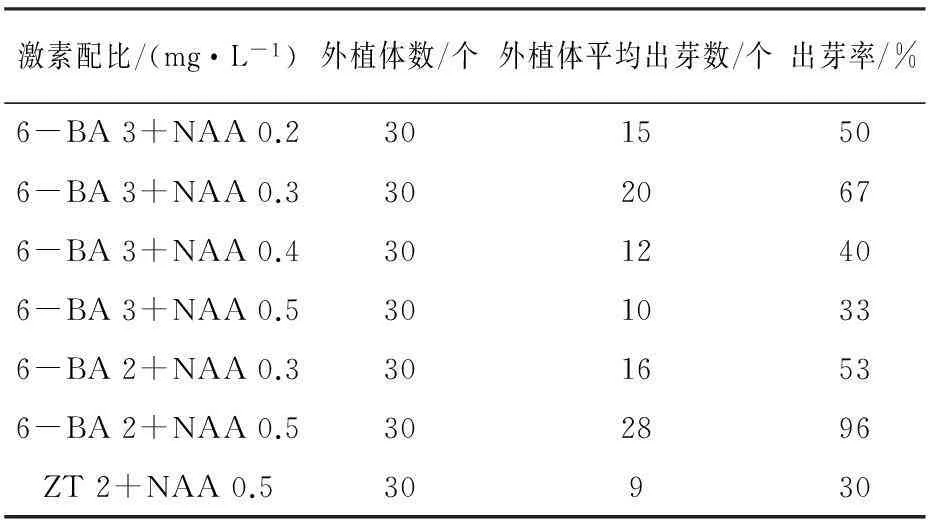
激素配比/(mg·L-1)外植體數/個外植體平均出芽數/個出芽率/%6-BA3+NAA0.23015506-BA3+NAA0.33020676-BA3+NAA0.43012406-BA3+NAA0.53010336-BA2+NAA0.33016536-BA2+NAA0.5302896ZT2+NAA0.530930
2.6光照對叢生芽誘導的影響
本實驗均在暗培養條件下進行藏紅花愈傷組織的誘導,為了確定光照是否對藏紅花叢生芽的誘導有影響,又研究了光照對叢生芽誘導的影響,結果見表6。

表6 光照時間對藏紅花愈傷組織分化成芽的影響
表6結果表明,在暗培養條件下叢生芽的誘導率可高達95 %,但是在光照的培養條件下叢生芽的誘導率明顯降低,最高只能到達30 %,說明光照不利于藏紅花愈傷組織進一步誘導叢生芽。
2.7藏紅花球莖的誘導條件
2.7.1激素對球莖誘導的影響
通過50 d的球莖誘導培養,探討不同質量濃度的激素配比對球莖誘導的影響,結果見表7。在不添加任何激素的MS培養基中,芽不能正常生長,更不能誘導出小球莖;在僅添加1.0 mg·L-16-BA或1.0 mg·L-1NAA的MS培養基中,叢生芽生長十分緩慢且相對矮小,最終都不能誘導出小球莖。研究表明,球莖誘導的最佳激素配比為5.0 mg·L-16-BA+1.5 mg·L-1NAA,球莖誘導最快,且能正常生長,第30 d球莖誘導率為90 %。
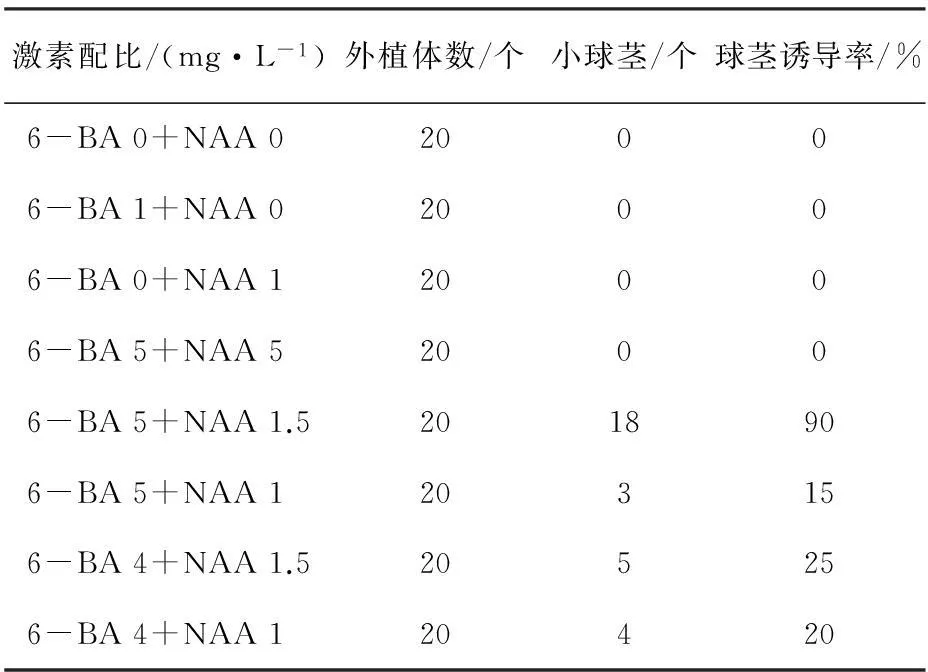
表7 激素對藏紅花球莖誘導的影響
2.7.2活性炭與藏紅花試管球莖誘導的關系
考察了當以MS為基本培養基,結合球莖誘導最佳激素配比5.0 mg·L-16-BA+1.5 mg·L-1NAA 的條件下,不同質量濃度的活性炭對藏紅花球莖誘導的影響,結果見表8。在不添加活性炭的情況下,即使培養基到第65 d,球莖的誘導率依舊為0 %;而在添加了0.3 g·L-1活性炭的培養基中,藏紅花小球莖的誘導時間最短為30 d且誘導率最高可達90 %(如圖4)。
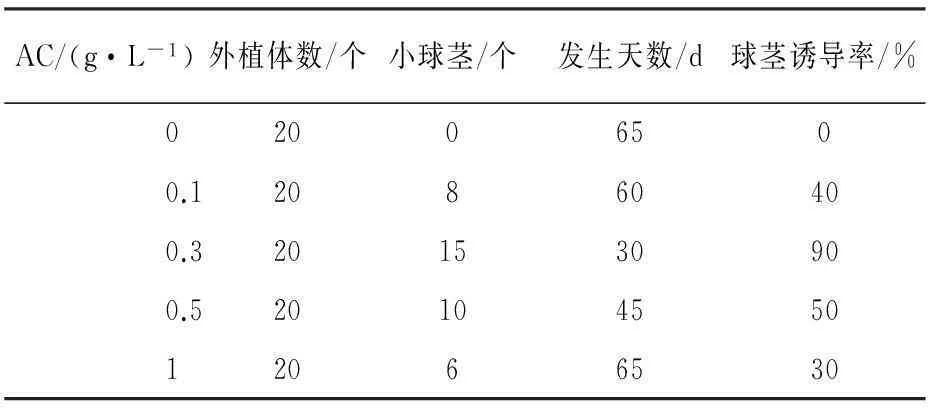
表8 活性炭對藏紅花試管球莖誘導的影響

圖4 藏紅花球莖
3討論
有關藏紅花的組織培養,最近國內外有報道利用SH和LS等作為基礎培養基[6-11],但是利用常用的MS作為基礎培養基并附加與本實驗不同的激素濃度配比時也能誘導出叢生芽和小球莖,可見外源激素的類型與濃度配比是藏紅花快速繁殖是否成功的關鍵。其中國內外多以藏紅花球莖為外植體來進行組織培養,然而,關于以藏紅花球莖側芽為外植體來進行組織培養的報道較少。本文以藏紅花球莖側芽為外植體,建立了藏紅花球莖的快速繁殖體系,成功誘導出了藏紅花愈傷組織且分化出叢生芽,由叢生芽進一步誘導培養后成功獲得了球莖,并且其誘導率均高于國內外的相關報道。
在藏紅花愈傷組織誘導過程中,以MS為基礎培養基時愈傷組織的誘導率都相對比以1/2MS和B5為基礎培養基時高,其中原因可能是MS培養基中的硝酸鹽和銨的含量較高,更有利于藏紅花球莖愈傷組織的誘導,并且與陳書安[12]等研究結果一致。實驗結果表明,只有當細胞分裂素和生長激素的協同作用時才能誘導出藏紅花愈傷組織。此外,當存在定量的6-BA協同作用時,2,4-D質量濃度過高或過低都不利于愈傷組織誘導率提高和愈傷組織快速誘導,同時6-BA質量濃度過大也不利于藏紅花愈傷組織誘導率的提高。本實驗中愈傷組織20 d能達到96.7 %的誘導率,均高于國內外相關愈傷組織誘導的研究[13-16]。與Zeybek[14]等研究結果相比,藏紅花愈傷組織誘導率均顯著提高,但與Raja[16]等的研究相比,延長了藏紅花愈傷組織的誘導時間,其中可能原因是與外植體的來源不同有關。以細胞分裂素和生長激素協同作用來決定細胞的分裂和生長,在藏紅花球莖誘導中起著決定性的作用,在僅含6-BA或2,4-D的培養基中,小球莖誘導率都較低或不產生小球莖。在藏紅花球莖誘導過程中,可以利用活性炭對激素的吸附和解吸附來調控培養基中的激素水平[17],同時能通過吸附培養基滅菌時產生的糖裂解產物、植物分泌的酚類等抑制生長的物質[17],促進藏紅花試管球莖的誘導。
關于直接以藏紅花花柱為外植體的快速繁殖,有待進一步的研究,以實現在最短的時間內直接獲得更多的藏紅花藥用成分。
參考文獻:
[1] 陳文浩,歐元, 趙兵,等. 番紅花球莖的快速高頻誘導[J]. 過程工程學報,2007,7(1):129-130.
[2] 李琳琳.藏紅花的研究概述[J] .中山大學研究生學刊, 2008,29(2): 46-51.
[3] 王平,童應鵬,陶露霞,等.西紅花的化學成分和藥理活性研究進展[J].中草藥,2014,45(20):3015-3028.
[4] CARLO I G. Tuberoso, ANTONELLA Rosa, PAOLA Montoro,et al.Antioxidant activity, cytotoxic activity and metabolic profiling of juices obtained from saffron (Crocus sativus L.) floral by-products[J].Food Chemistry,2016,199(15): 18-27.
[5] 董峰麗,饒君鳳,毛碧增.西紅花組織培養研究進展[J].藥物生物技術,2013,20(1):91-94.
[6] 陳書安,王曉東, 歐陽杰,等.藏紅花球莖愈傷組織快速誘導的研究[J].中國藥學雜志,2003,38(4):254-256.
[7] 袁麗紅,陸玉婷,黃晶.藏紅花球莖愈傷組織誘導和褐化抑制[J].南京工業大學學報(自然科學版),2009,31(6):21-26.
[8] SIVANESAN I, JANA S, JEONGIN B R. Vitro shoot regeneration and microcorm development in crocus vernus hill[J]. Pakistan Journal Botany,2014,46(2):693-697.
[9] MIR J I, AHMED N,WANI S H, et al. In vitro development of microcorms and stigma like structures in saffron (Crocus sativus L.)[J]. Physiol Mol Biol Plants,2010,16(4):369-373.
[10] SHARMA K D, RATHOUR R, SHARMA R, et al. In vitro cormlet development in Crocus sativus[J]. Biologia Plantarum, 2008,52(4): 709-712.
[11] 朱保華.番紅花離體快繁及無病毒植株的培育[D].重慶:西南大學,2009.
[12] 陳書安,王曉東,趙兵,等.藏紅花的研究進展[J].中草藥,2001,32(12):1137-1139.
[13] 彭海君. 西紅花生物學特性、離體快繁及質量評價研究[D].浙江:浙江農林大學,2014.
[14] ZEYBEK E, ?NDE S, KAYA Z.Improved in vitro micropropagation method with adventitious corms and roots for endangered saffron[J]. Central Eur J Biol, 2012,7(1): 138-145.
[15] 王壽芹,趙永欽,劉莉莎,等.藏紅花愈傷組織的誘導及植株再生[J].西南農業學報,2011,24(1):369-372.
[16] RAJA W, ZAFER G, WANI S A, In vitro microcorm formation in saffron (Crocus sativus L.) [J]. Acta Hortic, 2007,739:291-293.
[17] 卜學賢,陳維倫.活性炭對培養基中植物生長調節物質的吸附作用[J].植物生理學報,1988,14(4):401-405.
(責任編輯鄒永紅)
Study on Tissue Culture Conditions of Saffron Corm
LI Tao1,2, LI Chun-bin1, FAN Sheng-di1
(1.Key Laboratory of Biological Chemistry Engineering -The State Ethnic Affairs Commission - Ministry of Education, Dalian Minzu University, Dalian Liaoning 116605, China;2.Wuhan Company Ltd, Waterstone Pharmaceuticals Group, Wuhan Hubei 430070, China)
Abstract:A rapid propagation system of saffron (Crocus sativus L.) was established here using corms of saffron as explants by means of plant tissue culture. When the corms of saffron were cultured in the dark on MS medium containing 0.5 mg/L 6-benzyladenine (6-BA) and 4.0 mg/L 2,4-dichlorophenoxyacetic acid (2,4-D) for 20 days, the callus induction rate was as high as 96.7%. When the corms of saffron were cultured in the dark on MS medium containing 2.0 mg/L 6-benzyladenine (6-BA) and 0.5 mg/L naphthalene acetic acid (NAA) for 20 days, the callus induction rate was as high as 96%. When the corms of saffron were cultured in 1500 ~ 2000 lx lighting condition on MS medium containing 5.0 mg/L 6-benzyladenine (6-BA), 1.5 mg/L naphthalene acetic acid (NAA) and 0.3 g/L activated carbon (AC) for about 30 days, the cormels induction rate was as high as 90%.
Key words:Saffron; tissue culture; callus; cormlets
收稿日期:2016-03-18;最后修回日期:2016-03-26
基金項目:國家自然科學基金項目(21372037)。
作者簡介:李濤(1989-),男,湖北天門人,大連民族大學碩士研究生,主要從事天然產物與藥物制造技術研究。通訊作者:李春斌(1973-),男,黑龍江慶安人,副教授,博士,主要從事藥用植物組織培養與天然產物研究,Email:lcb@dlnu.edu.cn。
文章編號:2096-1383(2016)03-0212-05
中圖分類號:S567.219
文獻標志碼:A

