應用四條溶出曲線篩選厄貝沙坦片處方工藝
劉德智,李 鵬(浙江金立源藥業有限公司,浙江 紹興 312369)
?
應用四條溶出曲線篩選厄貝沙坦片處方工藝
劉德智,李鵬
(浙江金立源藥業有限公司,浙江紹興312369)
摘要:采用比較自研處方與參比制劑(亦稱原研制劑)在水、醋酸鹽緩沖液、鹽酸、磷酸鹽緩沖液中四條溶出曲線的f2因子,確定自研處方。通過調整厄貝沙坦片處方中輔料的含量,比較自制制劑(處方一~五)和參比制劑(批號:3A292)的f2因子,得到當處方中乳糖、微晶纖維素、交聯羧甲基纖維素鈉、羥丙基甲基纖維素、二氧化硅和硬脂酸鎂含量分別為18.60%、14.34%、4.65%、1.16%、2.71%、0.39%時和參比制劑比較相似,工藝具有良好穩定性及重現性。
關鍵詞:厄貝沙坦;處方工藝;溶出度評價
厄貝沙坦(Irbesartan)為法國賽諾菲圣德拉堡與百時美施貴寶公司共同開發成功的一種長效、非肽類選擇性AT1受體拮抗劑,于1997年以片劑形式首次在英國和德國上市。2004年,在中國獲準上市,商品名為安博維?(Aprovel?)。目前,厄貝沙坦已成為臨床用一線降壓藥物,進入國家基本藥物目錄。我公司自主研發厄貝沙坦片(規格:0.15 g),并按照國內仿制藥注冊要求,采用四條溶出曲線[1]與原研制劑比較,確認該工藝處方制劑與安博維?在體外溶出行為基本一致。
1 儀器、試劑和試藥
溶出儀:智能藥物溶出儀RC-8MD(天津天大天發科技有限公司);紫外可見光分光光度計:紫外分光光度計UV-2600(日本島津公司)。
純化水;磷酸二氫鉀,分析純;氫氧化鈉(片狀),分析純;三水醋酸鈉,分析純;冰醋酸;鹽酸,分析純。
厄貝沙坦(浙江金立源藥業有限公司,批號:20140101);厄貝沙坦(工作對照品自制,浙江省食品藥品檢驗研究院標化,批號20120801R);乳糖(荷蘭DMV INTERNATIONAL,批號為F1312001);微晶纖維素(型號PH101,批號為F1408001)、交聯羧甲基纖維素鈉(批號為F1403001)、羥丙基甲基纖維素(批號為F1403001)、二氧化硅(批號為F1408001)、硬脂酸鎂(批號為F1403001)、胃溶型薄膜包衣劑(型號YCW-C-020001,批號為F1408001)均為安徽山河藥用輔料有限公司產品。
參比制劑:參照仿制藥質量一致性評價-口服固體制劑參比制劑確立原則(草案)[2],選擇原研制劑安博維?作為參比制劑,規格:0.15g,賽諾菲(杭州)制藥有限公司進行分裝。
2 制備工藝篩選
2.1處方前研究
本研究中確定研究劑型為片劑,規格為0.15 g。參閱安博維?RFDA說明書可以獲知該制劑處方中輔料組成如下:乳糖、微晶纖維素、交聯羧甲基纖維素鈉、羥丙基甲基纖維素、二氧化硅和硬脂酸鎂。依據制劑學知識,對上述輔料在該處方中作用分析如下:乳糖、微晶纖維素為填充劑、羥丙基甲基纖維素為粘合劑、二氧化硅和硬脂酸鎂為助流劑和潤滑劑[3]。
2.2自研處方設計
根據2.1項下的原研處方分析,設計自研處方,見表1,處方量為1000片。

表1 處方篩選1000片處方量/g
2.3制備工藝描述
(1)將原料厄貝沙坦用氣流粉碎機粉碎成微粉(D90<7 μm),輔料乳糖、微晶纖維素、交聯羧甲基纖維素鈉分別過60目篩,二氧化硅和硬脂酸鎂分別過100目篩,備用;(2)將羥丙基甲基纖維素,加純化水配制成3%的溶液,作為粘合劑;(3)將厄貝沙坦、乳糖、微晶纖維素、交聯羧甲基纖維素鈉,混合均勻,加入黏合劑制軟材,用18目篩制粒,在80℃~90℃下干燥,水分控制在4%以內,干顆粒用16目篩整粒,再加入二氧化硅和硬脂酸鎂,混合均勻,壓片、包衣即得。
3 溶出行為評價
根據口服固體制劑溶出度試驗技術指導原則[4],的要求,仿制藥需要在水、醋酸鹽緩沖液、鹽酸、磷酸鹽緩沖液中的溶出行為與原研藥品一致。因此自制制劑需在上述四種溶劑中與參比制劑考察溶出行為,分別計算相似因子[5],從而進行處方篩選。本次實驗處方篩選,首先比較在水中的溶出曲線,合格后,再研究其他三種溶出介質的溶出曲線。采用中國藥典2010年版附錄X C第二法進行測定。
3.1自研處方和參比制劑在水溶液中溶出曲線比較
取自制處方中每個處方中5片和參比制劑1片,以水為溶出介質,分別在5 min、10 min、15 min、30 min、60 min、90 min、120 min、180 min、240 min、 360 min取樣,計算各時間點的累積溶出度,并計算f2因子,結果見表2和圖1。可見,處方五和參比制劑的f2因子為87.21大于50,溶出曲線與原研曲線相似度高,可以初步確定處方五和參比制劑相似。

表2 處方一~五和參比制劑在水中溶出度測定結果

圖1 處方一~五和參比制劑在水中溶出曲線圖
3.2處方五和參比制劑在其它三種溶出介質中溶出曲線比較
(1)處方五和參比制劑在pH=1.0鹽酸溶液中溶出曲線的比較
取處方五制備的5片,原研片1片,以pH= 1.0鹽酸溶液為溶出介質,分別在5 min、10 min、15 min、20 min、30 min、45 min、60 min取樣,計算各時間點的累積溶出度,結果見表3和圖2,可見,處方五15 min的累積溶出度97.48,滿足15 min累積溶出度大于85的要求。
(2)處方五和參比制劑在pH=4.5醋酸鹽緩沖液中溶出曲線的比較
取處方五制備的5片,原研片1片,以pH=4.5醋酸鹽緩沖液為溶出介質,分別在5 min、10 min、15 min、30 min、60 min、90 min、120 min、180 min、240 min、360 min取樣,計算各時間點的累積溶出度,并計算f2因子,結果見表3和圖3,可見,處方五和參比制劑f2因子為99.90,大于50,因此可以初步確定處方五和參比制劑在在pH=4.5醋酸鹽緩沖液中溶出曲線相似。
(3)處方五和參比制劑在pH=6.8磷酸鹽緩沖液中溶出曲線的比較。
取處方五制備的5片,原研片1片,以pH=6.8磷酸鹽緩沖液為溶出介質,分別在5 min、10 min、15 min、20 min、30 min、60 min、90 min、120 min取樣,計算各時間點的累積溶出度,結果見表3和圖4,可見,處方五和參比制劑f2因子為79.65,大于50,因此可以初步確定處方五和參比制劑在pH=6.8磷酸鹽緩沖液中溶出曲線相似。
(4)結論
綜上所述,在水、pH=4.5醋酸鹽緩沖液、pH= 6.8磷酸鹽緩沖液中處方五和參比制劑的f2因子分別為87.21、99.90、79.65,均大于50,在pH=1.0鹽酸溶液中滿足15 min累積溶出度大于85的要求,因此可以初步確定處方五和參比制劑相似。
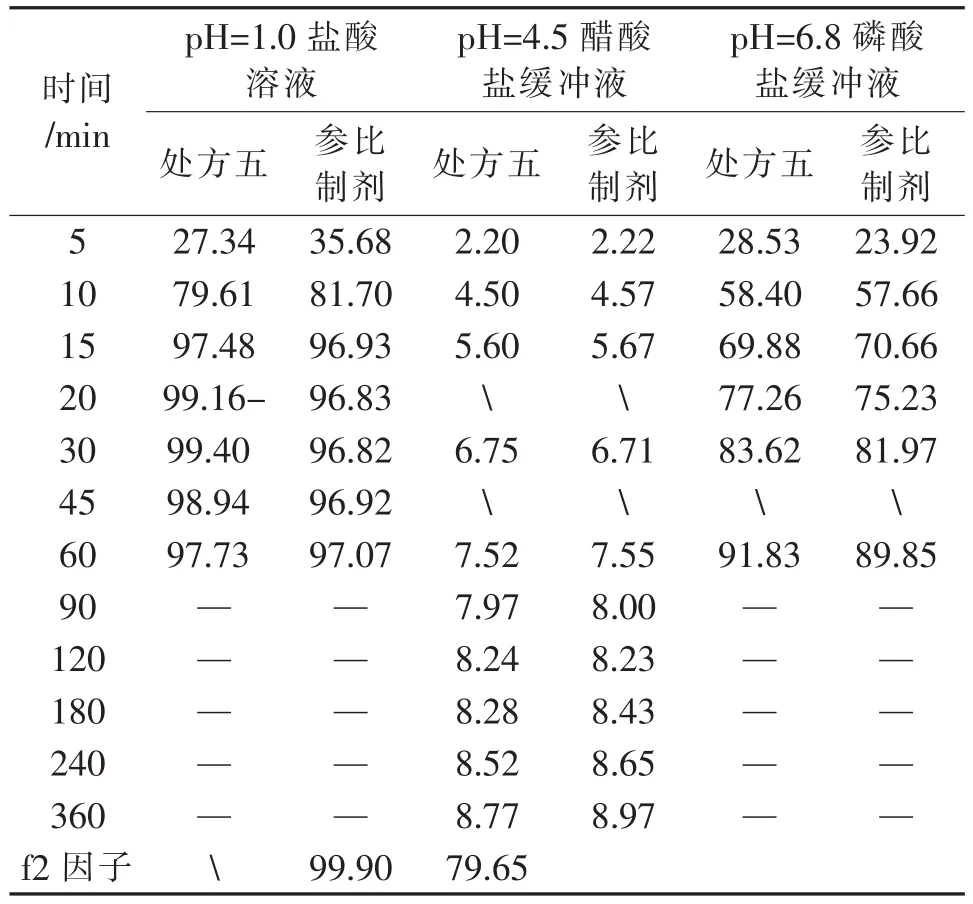
表3 不同溶出介質溶出度測定結果

圖2 處方五和參比制劑在pH=1.0鹽酸溶液中溶出曲線
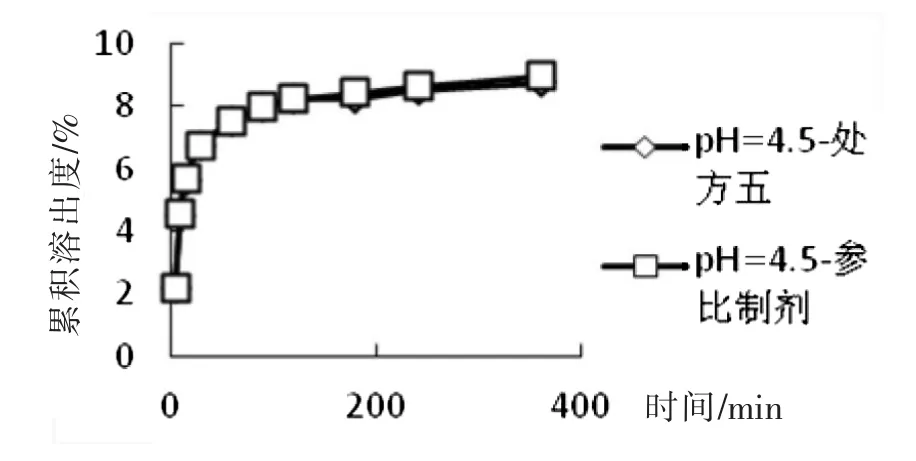
圖3 處方五和參比制劑在pH=4.5醋酸鹽緩沖液中溶出曲線
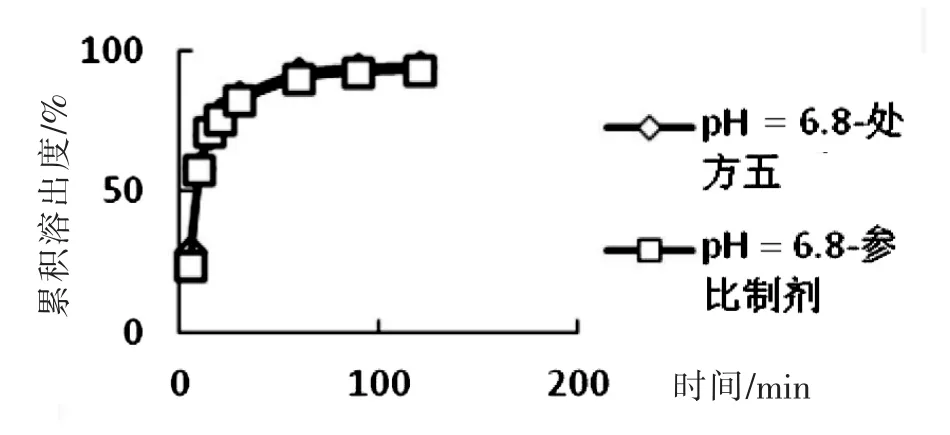
圖4 處方五和參比制劑在pH=6.8磷酸鹽緩沖液中溶出曲線
4 中試放大
為了進一步驗證處方五與原研制劑在四種溶出介質中的溶出行為一致,我們按照處方五,進行中試批量放大,連續試制三批,試制批量為每批5萬片,再與參比制劑的進行溶出曲線比較。結果見表4和圖5。可見,三批中式放大后制得的片劑和參比制劑在水、pH=4.5醋酸鹽緩沖液、pH= 6.8磷酸鹽緩沖液中溶出曲線的f2因子均大于50,在pH=1.0鹽酸溶液中滿足15 min累積溶出度大于85的要求。中試放大后溶出曲線依然具有良好的相似性。
5 結論
本實驗研究通過改變處方中乳糖、微晶纖維素101、交聯羧甲基纖維素鈉、二氧化硅的量,設計五個處方,見表1,并對這五個處方和參比制劑在水溶液中進行溶出曲線比較,初步確定處方五和參比制劑相似,又對處方五和參比制劑在pH= 1.0鹽酸溶液、pH=4.5醋酸鹽緩沖液、pH=6.8磷酸鹽緩沖液中進行溶出度曲線比較,進一步確定處方五和參比制劑相似。再將處方五中試放大5萬片生產三批,通過測定溶出度驗證了該工藝的具有良好穩定性及重現性。

表4 三批中試樣品在不同介質溶出度測定結果

圖5 三批中試和參比制劑在不同介質中溶出曲線圖
參考文獻:
[1]張啟明,謝沐風,寧保明,等.采用多條溶出曲線評價口服固體制劑的內在質量[J].中國醫藥工業雜志,2009,40 (12):946-950,955.
[2]中國食品藥品檢定研究院.仿制藥質量一致性評價-口服固體制劑參比制劑確立原則(草案).2013-12-31.
[3]Ku C C,Sprockel O L,Lang B A,et al.Pharmaceutical compositions containing irbesartan:US,5994348A[P].1999-11-30.
[4]國家食品藥品監督管理總局藥品審評中心.口服固體制劑溶出度試驗技術指導原則.2009.
[5]謝沐風.溶出曲線相似性的評價方法[J].中國醫藥工業雜志,2009,40(4):308-311.
精細化工
修回日期:2016-03-17
Screening the Irbesartan Tablet Formulations According to 4 Dissolution Profiles
LIU De-zhi,LI Peng
(Zhejiang Kinglyuan Pharmaceutical Co.,Ltd.Shaoxing,Zhejiang 312309,China)
Abstract:After compare the f2 factors of 4 dissolution profiles obtained from water,acetate buffer solution,hydrochloric acid solution and phosphate buffer solution due to self-developed products and reference product,the final formulation is determined.By compare the different f2 factor due to homemade products with different excipients content(Formulation 1~5)and the reference product(Lot No.:3A292),we found that when the content of lactose,microcrystalline cellulose,croscarmellose sodium carboxymethyl cellulose,hydroxypropyl methyl cellulose,silica and magnesium stearate is 18.60%,14.34%,4.65%,1.16%,2.71% and 0.39%respectively,the f2 factor of homemade product is similar with the reference product.What’s more,the process is stable and repeatable.
Keywords:irbesartan;formulation;dissolution evaluation
文章編號:1006-4184(2016)5-0024-04
作者簡介:劉德智(1975-),男,浙江杭州人,工程師,主要從事藥品生產、研發及質量管理工作。E-mail:344546939@qq.com。

