銅基催化劑還原過程研究綜述
肖二飛,劉華偉,錢勝濤,劉應杰,雷 軍,王先厚,孔渝華
(工業氣體凈化精制與利用湖北省重點實驗室,華爍科技股份有限公司,湖北 武漢 430074)
?
綜述與展望
銅基催化劑還原過程研究綜述
肖二飛*,劉華偉,錢勝濤,劉應杰,雷軍,王先厚,孔渝華
(工業氣體凈化精制與利用湖北省重點實驗室,華爍科技股份有限公司,湖北 武漢 430074)
摘要:銅基催化劑廣泛應用于工業生產中,催化劑還原是催化劑生產的最后一道工序,也是工業使用前的第一個步驟,對幾種銅基催化劑的還原過程進行綜述。銅基催化劑主要應用于CO與H2合成甲醇和CO低溫變換,也可用于CO2與H2合成甲醇以及脂肪酯加氫制脂肪醇。銅基催化劑的還原方法主要有液相還原法和氣相還原法,其中,氣相還原法用途較廣。對影響還原的條件(H2濃度、溫度、壓力和空速等)及雜質(H2O、O2和CO2等)進行總結,并以甲醇合成催化劑為例對低氫還原法和高氫還原法作了介紹。
關鍵詞:催化劑工程;銅基催化劑;甲醇合成催化劑;還原
銅屬于過渡金屬元素,對有機化合物催化氧化、加氫和脫氫等反應有很好的活性,廣泛應用于催化劑制備。銅主要以0價金屬形式、+2價和+1價的鹽類或氧化物形式存在,對于不同催化反應,銅系催化劑對活性銅價態存在形式的要求不同。因此,制備好的催化劑需要經過一個活化過程才具有很好的催化活性。銅基催化劑活化過程是CuO的還原過程,不同制備方法和催化反應類型的催化劑還原條件有差別[1]。
肖長義[2]對11個廠家27爐低壓甲醇催化劑的使用情況進行了跟蹤調查,發現有45%的催化劑是因為還原過程出現問題,造成高溫燒結,活性和壽命銳減。CuO的還原是一強放熱反應,還原條件不當易導致銅燒結,使催化劑活性下降。不同催化反應的活性中心不同,過度還原或還原不充分對催化劑性能造成損害。本文對幾種銅基催化劑的還原過程進行綜述,對影響還原的條件(H2濃度、溫度、壓力和空速等)以及雜質(H2O、O2和CO2等)進行總結,并以甲醇合成催化劑為例對低氫還原法和高氫還原法作了介紹。
1銅基催化劑的應用
銅基催化劑具有價格低廉、毒性低和催化活性好等優點,廣泛應用于有機催化反應。銅對C—C鍵氫解的反應活性很低,而對C—O鍵的氫解卻表現出良好的反應活性,銅可以在很多反應中起到很好的選擇催化作用,包括甲醇合成催化劑、CO低溫變換催化劑、脂肪酸酯加氫催化劑、甘油氫解催化劑、硝基苯制苯胺催化劑和環己醇脫氫制環己酮催化劑等。其中,銅基甲醇合成催化劑和CO低溫變換催化劑我國在20世紀60年代開始應用[3]。
1.1CO及CO2加氫制甲醇
隨著工業的發展,空氣中CO和CO2含量不斷增加,由此引發的生態環境問題日益受到關注。CO和CO2的開發與利用得到重視,其中,CO和CO2加氫合成甲醇是有效的利用途徑之一。
甲醇合成催化劑主要以銅為活性組分,Al2O3為載體,添加不同助劑。洪中山等[4]考察了焙燒條件對Cu/ZnO/Al2O3甲醇催化劑的影響,研究了焙燒氣氛、焙燒溫度和焙燒過程中不同升溫速率對催化劑晶粒大小、結構及各組分間相互作用的影響。徐三魁等[5]研究了CuO/ZnO/ZrO2甲醇催化劑的活性和比表面積,并對甲醇合成催化劑的活性中心問題進行研究和討論。Choi Y等[6]采用Cu-ZnO體系催化劑對CO2和CO加氫合成甲醇的活性中心進行了研究,認為Cu-Zn位是CO2加氫活性中心,Cu-O-Zn位是CO加氫的活性中心。
1.2CO低溫變換反應
CO低溫變換反應又稱低溫水煤氣變換反應,水煤氣變換反應通常用于甲醇重整制氫反應中大量CO的去除[7],反應中所用催化劑通常為銅鋅系催化劑,在(200~250) ℃有很好的變換活性。該反應為放熱反應,較低的反應溫度有利于化學平衡,但反應溫度過低影響反應速率。
我國CO低溫變換催化劑的研究始于20世紀60年代,南化集團研究院研制了國內第一種CO低溫變換催化劑B201型(Cu-Zn-Cr系),1966年又開發了降銅去鉻的Cu-Zn-Al系B202型催化劑。20世紀70年代,我國從國外引進了一批大型合成氨裝置,隨即南化集團研究院開發了Cu-Zn-Al系B204型催化劑。20世紀80年代,南化集團研究院開發的B206型催化劑在中原大化集團有限責任公司成功地替代了進口催化劑[8]。
1.3脂肪酸酯加氫制脂肪醇
酯、酸及酐加氫在工業上有廣泛用途,酸和酯是較難活化的分子,尤其是酸,更難活化加氫,這類反應一般需在較高壓力和溫度下進行。油脂加氫制高級醇,如椰子油制十二碳醇和棕櫚油制十六碳醇,一般采用Cu催化劑,在(200~300) ℃和(10~30) MPa條件下反應。劉金香等[9]分別研究了用于乙二酸二乙酯加氫和順酐加氫的 Cu 催化劑體系,分別對反應條件和動力學進行了研究。國內現階段對草酸酯加氫制乙二醇的研究是一個熱點,使用的催化劑主要以Cu/SiO2為主。
2銅基催化劑還原過程
2.1還原化學反應過程
銅基催化劑還原過程可以認為是以下反應:
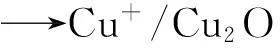
(1)

(2)

(3)
銅基催化劑的還原行為與CuO還原行為有差別,負載在MCM-41上的CuO的還原溫度比純CuO低200 ℃,更有利于還原[11]。不同方法制備的銅基催化劑上銅的存在價態不同,陶庭紅等[11]研究認為,實驗條件下制備的新鮮Cu/C催化劑中同時存在CuO、Cu2O和Cu0,而催化劑的程序升溫還原過程為(2)、(3)相對獨立的平行反應過程,并非(1)、(2)的串聯反應。徐杰等[12]采用TG-DTA-DSC熱分析儀研究了Cu-Co-Fe系催化劑在程序升溫還原過程中的中間態變化及其動力學,發現催化劑還原分階段進行,CuO先還原成Cu2O,然后還原為Cu0。
郭有才等[13]研究了不同氫濃度及環境溫度下銅催化劑用氫還原過程中粒內溫度的動態分布,結果表明,還原過程中,催化劑粒子表層及中心溫度在反應開始后均隨時間而變,且始終高于環境溫度,但表層和中心之間的溫差較小。溫度梯度主要集中在相間而不是粒內,H2濃度梯度主要存在于固體粒子中。
2.2活性中心
對于不同的催化反應,即使用相同催化劑,對反應起催化作用的銅活性中心可能不同。王志飛等[14]考察了Cu/SiO2模型催化劑上甲醇部分氧化制氫反應,指出催化劑的制氫活性與Cu0有關,而大量Cu+與Cu2+的存在不利于催化劑活性的提高,Zn助劑的引入,穩定了Cu+物種,導致Cu2O物種的大量生成,從而提高催化劑還原溫度,抑制Cu的氧化還原過程,降低催化劑活性。曹勇等[15]研究認為,Cu/ZnO/Al2O3甲醇合成催化劑是Cu+和Cu0物種之間協同作用的結果,調節Cu+和Cu0的比例,催化劑才有最佳的催化活性。李振花等[16]對草酸二乙酯加氫制乙二醇銅硅系催化劑進行了研究,指出銅的催化活性是Cu0和Cu+協同作用的結果,Cu+決定草酸二乙酯轉化率,Cu0決定乙二醇選擇性。張啟云等[17]采用微型管式反應器研究了草酸二甲酯在Cu/SiO2催化劑上的加氫反應,認為Cu+是催化劑的主要活性中心。
3銅基催化劑還原方法
工業上應用較多的銅基催化劑還原方法是H2還原法。文獻[15]報道了其他方法,主要分為氣相還原法和液相還原法,傳統的氣相還原活化銅基催化劑的過程常伴隨強烈的熱效應,使催化劑活化過程存在耗時長和還原條件難以控制等問題;液相還原法往往技術不夠完善及生產成本較高,很難實現大規模工業應用。
3.1氣相還原法
氣相還原法還原劑為H2、CO及一些醇類等,氣相還原是在一定溫度條件下通入一定濃度的還原性氣體,對CuO進行還原。還原過程中放出大量的熱,催化劑過熱使起催化作用的銅微晶縮聚凝結,降低催化活性,因此,氣相還原的關鍵是控制還原反應緩慢進行,并采取措施帶出反應熱。馬友山等[18]提供了一種以C1~C12醇為還原劑的銅基催化劑常壓還原方法,認為醇還原的優點在于還原產生的熱量可以被醇脫氫反應吸收,也可以被醇和產生的醛酮吸收帶走,從而解決還原放熱不易控制的問題,還原升溫速率也可加快。
專利[19]使用甲醇為還原劑,將甲醇水蒸汽重整制氫催化劑的還原過程分為3個階段:(1) 脫水。在(110~120) ℃通入惰性氣體或空氣;(2) 催化劑還原的引發。繼續升溫通入0.5%~2%的H2,水氣進行還原誘導;(3) 還原階段。繼續升溫通入0.1%~5%的甲醇水溶液進行還原,還原溫度(200~230) ℃。該還原方法與傳統方法相比,具有控溫容易和還原較均勻的優點,活性無明顯差別。
3.2液相還原法
液相還原法還原劑有葡萄糖、無水亞硫酸鈉、水合肼和金屬有機化合物等。王麗[20]研究了還原劑對Cu/AC催化劑催化氧化羰基化活性的影響,指出還原劑是影響催化劑活性物種的主要因素,葡萄糖作為還原劑時得到最好的還原效果,CuO被還原為球形顆粒Cu2O,并且葡萄糖起到分散銅物種的作用。曹勇等[15]采用KBH4溶液對新鮮制備的碳酸鹽共沉淀進行液相化學還原處理,直接得到高活性及高選擇性的還原態Cu/ZnO/Al2O3甲醇合成催化劑,催化劑具有更大的比表面積、孔徑及孔容。
4銅基催化劑的H2還原法
銅基催化劑前驅體的還原反應為放熱反應,升高溫度不利于適度的還原,但可以加大催化劑還原速率,縮短還原時間。還原溫度過高,增大微晶尺寸,比表面積下降;溫度過低,還原速率慢,影響反應器的生產周期,延長已還原催化劑暴露在水汽中的時間(還原中伴有水分產生),增加氧化-還原的反復機會,降低催化劑活性。每一種催化劑都有一個特定的起始溫度、最低還原溫度和最高還原溫度,還原時應根據催化劑性質選擇并控制升溫速率和還原溫度[21]。
4.1還原動力學性質[3]
銅基催化劑的還原過程分為升溫脫水期和還原期,升溫脫水期主要是將常溫狀態的催化劑用惰性氣體載熱,溫度升至約180 ℃,使催化劑具備還原反應活性,同時脫除催化劑中所含水分;還原期主要是用還原劑將催化劑中的CuO還原為Cu微晶,采用N2作載氣,H2作還原劑。還原過程可分:(1) 誘導期。還原劑進入催化劑床層后,吸附活化至開始還原反應所需的時間;(2) 加速期。還原開始后,反應速率由慢變快,至最高速率的時間;(3) 減速期。當催化劑還原到一定程度后,因CuO含量減少和深度還原擴散阻力增大等原因,還原速率由快變慢,至還原結束所需的時間。
4.1.1誘導期與H2濃度和溫度的關系
H2濃度低,床層溫度低,誘導期較長。為避免誘導期過長而造成急于提高H2濃度或床層溫度,導致超溫燒結事故,應在床層溫度較高(約180 ℃)導入低濃度的H2。
4.1.2表觀起始還原溫度與H2濃度的關系
有些Cu-Zn系催化劑與H2反應可起始于99 ℃,而在121 ℃達到高峰。因此,銅基催化劑的升溫還原配H2時,應注意床層溫度變化。
4.1.3動力學
(1) 在一定H2濃度和溫度下,隨著還原過程的進行,還原速率加快,當還原度達到20%后,還原速率開始下降。
(2) H2濃度提高時,還原反應速率增大。實驗表明,還原速率與H2分壓的一次方成正比。
(3) 升高溫度,還原速率顯著增大。
(4) 還原末期,還原速率顯著減慢至難以觀測的程度,此時,提高H2濃度和溫度,加快還原速率效果顯著。還原末期,可適當升高反應溫度和提高H2濃度,以縮短還原時間。
4.2H2濃度和溫度的影響
在催化劑還原過程中,H2濃度和還原溫度對反應速率有直接影響,反應過快,導致產生的大量反應熱無法迅速排出,引起催化劑燒結,影響催化活性和壽命。
王保偉等[22]采用沉淀沉積法制備了Cu/SiO2催化劑,研究表明,還原溫度是影響其催化性能的關鍵因素之一,如果還原溫度不夠高,催化劑無法還原到適當程度;還原溫度過高,則導致催化劑表面Cu燒結,減少活性位數量。還原溫度還決定Cu0與Cu+的比值,與催化性能密切相關。李振花等[23]研究認為,還原溫度超過350 ℃,隨著還原溫度的升高,所有催化劑上的產物收率均呈下降趨勢,這是因為銅基催化劑還原時放熱量較大,容易引起銅的聚集,還原溫度愈高,聚集現象愈嚴重,也愈容易引起燒結。李玉清等[1]研究了還原溫度對催化劑活性銅結構變化的影響,結果表明,在200 ℃以上還原,將使高度分散的活性銅轉變為晶體銅,導致催化劑上活性銅比表面積降低,活性下降。
吉定豪[24]對銅硅系環己醇脫氫制環己酮催化劑的還原溫度進行了研究,在20%H2-N2混合氣氛中,分別于250 ℃、300 ℃、350 ℃和400 ℃還原3 h,結果表明,隨著還原溫度的升高,環己醇轉化率提高,300 ℃時,環己醇轉化率達66.5%,之后隨著還原溫度的升高開始降低。石雷等[25]采用等體積浸漬法制備了Cu/SiO2催化劑,將其用于一步法合成吲哚反應,在150 ℃經50%H2-50%N2混合氣還原后,其催化性能最佳,吲哚收率可達88%。
孫軍明[26]對Cu/SiO2催化劑上苯胺和乙二醇一步合成吲哚進行了研究,發現以H2+N2混合氣還原Cu/SiO2催化劑時,H2濃度不同對催化劑活性和選擇性的影響亦不同。在H2和N2混合氣總量為60 mL·min-1條件下,H2所占比例大于或小于50%時,吲哚收率略低;H2比例為50%時,吲哚收率最高。還原溫度較低時,吲哚收率略低;還原溫度150 ℃時,吲哚收率最高;還原溫度升至180 ℃,吲哚收率下降。
4.3還原壓力和空速的影響
還原壓力和空速影響氣流在催化劑床層橫截面上的分布,對還原溫度有直接的調控作用,如果氣流線速過低,氣體可能產生偏流現象,部分催化劑不能及時還原,而在還原末期,增大H2濃度或切換工藝氣,可能產生局部過熱燒結催化劑等事故[3]。
從理論上看,催化劑還原空速愈大愈好,空速增加,單位時間活性組分脫除氧的數目增多,還原后活性Cu晶粒愈小,從而增大表面積,相應提高催化劑活性。實際生產中,甲醇合成催化劑的空速極限應視熱平衡條件而定,工廠現行空速一般選擇(l 000~1 500) h-1較為適宜[26]。
范崇正等[27]對Raney-Cu還原過程進行了研究,發現還原氣為純H2或純CO時,Cu晶粒生長隨著空速的提高而變好,晶粒數量亦增多,其中,以CO作還原氣所觀察到的結果更為顯著。若以H2+N2混合氣作為還原氣,還原后的Cu晶粒生長較差,晶粒數量較少,而且晶粒生長狀況與還原氣空速無關。高空速的H2或CO可使催化劑表面嚴重燒結,細小孔洞被封堵,表面積減小為零。用H2+N2和低空速的H2或CO還原所得銅催化劑顆粒度細小,分散度高,而高空速H2及CO還原所得銅催化劑明顯由較大顆粒構成,分散度低。
4.4雜質的影響
雜質影響主要指還原過程中由系統帶入或反應產生的一些氧化性物質對還原過程的影響,包括水、O2和CO2。
水是CuO還原后產物,如果沒有及時排出還原系統,與還原好的Cu0發生反復氧化還原反應,造成Cu晶粒長大。陳長林等[29]對甘油氫解Cu-ZnO催化劑進行了研究,指出減少反應水含量和降低還原溫度有利于提高催化劑穩定性。
對于Ni-Cu-Mn-K/γ-Al2O3高溫變換催化劑,葉柄火等[29]提出了相反意見,認為還原過程添加適量的水蒸汽,催化劑具有良好的催化性能和熱穩定性。
殷永泉等[30]研究指出,用碳酸鈉沉淀法制備的Cu/Zn/Al催化劑在H2還原過程中,除了進行CuO還原反應,還存在CuO和ZnO表面上吸附的CO2加氫反應和逆水汽變換反應,這兩種反應對于Cu/Zn/Al催化劑在CO2/CO加氫反應非常重要。
4.5甲醇催化劑的還原
關于銅基催化劑的還原方法研究最多的是甲醇合成催化劑[31],甲醇廠普遍采用低氫法和高氫法。低氫法是利用高純度N2作為稀釋氣(載體氣),并依據床層活化反應變化情況,適量補進H2,控制入塔氣中H2濃度為0.1%~5%。H2濃度低,活化還原反應緩慢,不易發生超溫現象,還原后催化劑活性較高。低氫法還原過程中通過監測出口水汽與H2濃度和床層溫度控制進口H2濃度。
高氫法是利用銅洗塔后氣體作為催化劑的還原氣源,方便易得。高氫法與低氫法惟一不同是還原氣體中H2濃度不同,高氫還原H2濃度≥70%,還原氣中H2濃度高,反應劇烈,容易發生超溫現象。王和高[32]介紹了高氫甲醇催化劑的還原過程,認為如何處理好既含高氫又能減慢反應速率,緩解反應熱量,防止超溫過熱,做到出水均勻平穩,使整個還原過程按照擬定的程序順利進行是實現高氫還原法的關鍵。
高氫還原分為4個階段:(1) 升溫階段(室溫~80 ℃)。主要脫除物理水,40 ℃時,要開啟兩臺循環機,準備足夠的循環量;60 ℃時,注意分離器放水;(2) 還原初期[(80~100) ℃]。用時15 h,溫度約100 ℃時,注意熱電偶工作情況,發現異常立即停車,正常后繼續升溫;(3) 還原主期[(100~170) ℃]。第一期溫度(100~130) ℃,用時15 h,為整個高氫還原的關鍵,反應激烈,出水旺盛,應嚴格控制升溫速率,控制小時出水量與水汽濃度不超標;第二期溫度(130~170) ℃,用時8 h,注意系統壓力變化,要穩定連續充壓,并依據床層溫度適當加大空速;(4) 還原末期。將熱點溫度升至250 ℃,塔底溫度升至230 ℃,同平面溫差小于5 ℃,以恒溫為主。
5結語
銅基催化劑在有機合成催化領域應用廣泛,尤其對加氫和脫氫反應有很好的催化活性及選擇性。催化劑還原是催化劑制備過程中的重要環節,直接影響催化劑性能和壽命。銅基催化劑的還原主要有氣相還原法和液相還原法,氣相加氫還原目前應用較為廣泛,其中,對合成甲醇催化劑的還原方法研究最為深入。氣相加氫還原的關鍵是防止還原反應過于激烈而導致超溫燒結,通過控制H2濃度、還原溫度及空速可以有效控制超溫現象的發生,方便、低廉達到催化劑的還原效果是今后研究銅基催化劑還原方法的重點。
參考文獻:
[1]李玉清,莊永美.用熱分析方法研究銅-鋅體系催化劑的還原性質[J].石油化工,1991,20(9):630-632.
[2]肖長義.低壓甲醇催化劑的預還原-鈍化-再還原的研究[J].精細石油化工,1993,(1):43-47.
[3]向德輝,劉惠云.化肥催化劑使用手冊[M].北京:化學工業出版社,1992.
[4]洪中山,曹勇,孫琦,等.焙燒條件對Cu/ZnO/Al2O3甲醇催化劑的影響[J].復旦大學學報(自然科學版),2002,41(3):101-105.Hong Zhongshan,Cao Yong,Sun Qi,et al.The effect of calcinations conditions on Cu/ZnO/Al2O3methanol synthesis catalysts[J].Journal of Fudan University(Natural Seience),2002,41(3):101-105.
[5]徐三魁,張書森,郭憲吉.CuO-ZnO-ZrO2甲醇催化劑的活性和比表面研究[J].河南化工,2001,(7):11-12.
Xu Sankui,Zhang Shusen,Guo Xianji.Study of activity and specific surface area on CuO-ZnO-ZrO2methanol catalyst[J].Henan Chemical Industry,2001,(7):11-12.
[6]Choi Y,Futagami K,Nakmura J.The role of ZnO in Cu/ZnO methanol synthesis catalysts-morphology effect or active site model[J].Catalysis Letters,2001,208(1):163-167.
[7]張穎鶴.低溫水煤氣變換催化劑的研究進展[J].安徽化工,2006,(5):6-8.
Zhang Yinghe.The development of catalysts for low-temperature water-gas shift reactions[J].Anhui Chemical Industry,2006,(5):6-8.
[8]史秀齊,張戈,林承順,等.低汽氣比CO低溫變換催化劑進展及B207的工業應用[J].化肥工業,2002,29(6):17-24.
Shi Xiuqi,Zhang Ge,Lin Chengshun,et al.Advances in LTS CO catalyst at low steam-gas ratio and commercial use of B207[J].Journal of the Chemical Fertilizer Industry,2002,29(6):17-24.
[9]劉金香,沈偉,徐華龍,等.熱分析用于順酐加氫銅系催化還原反應動力學研究[J].化學世界,1996,(S1):208.
[10]閆繼娜,李亮,華子樂,等.MCM-41負載氧化銅活性組分的結構及其氫程序升溫還原特性[J].硅酸鹽學報,2005,33(4):452-455.
Yan Jina,Li Liang,Hua Zile,et al.Structural and hydrogen temperature programmed reduction properties of MCM-41 supported copper oxide catalysts[J].Journal of the Chinese Ceramic Society,2005,33(4):452-455.
[11]陶庭紅,楊學仁,彭少逸.銅/活性炭催化劑還原過程的研究[J].燃料化學學報,1990,18(2):116-121.
Tao Tinghong,Yang Xueren,Peng Shaoyi.Investigation on reduction process of an activated carbon supported copper catalyst[J].Journal of Fuel Chemistry and Technology,1990,18(2):116-121.
[12]徐杰,王文祥,張家靈.Cu-Co-Fe催化劑還原行為的研究[J].催化學報,1991,12(2):114-119.
Xu Jie,Wang Wenxiang,Zhang Jialing.Reduction behavior of Cu-Co-Fe catalysts[J].Journal of Catalysis,1991,12(2):114-119.
[13]郭有才,趙修仁.銅系催化劑用氫還原時粒內溫度的動態分布[J].大連工學院學報,1984,23(3):29-36.
[14]王志飛,王衛平,呂功煊.Cu/SiO2模型催化劑上甲醇部分氧化制氫反應研究[J].分子催化,2002,16(5):327-333.
Wang Zhifei,Wang Weiping,Lü Gongxuan.Investigation of partial oxidation of methanol to hydrogen over Cu/SiO2catalysts[J].Journal of Molecular Catalysis(China),2002,16(5):327-333.
[15]曹勇,陳立芳,戴維林,等.沉淀還原法制備高性能CO2加氫合成甲醇Cu/ZnO/Al2O3催化劑[J].高等學校化學學報,2003,24(7):1296-1298.
Cao Yong,Chen Lifang,Dai Weilin,et al.Preparation of high performance Cu/ZnO/Al2O3catalyst for methanol synthesis from CO2hydrogenation by coprecipitation-reduction[J].Chemical Journal of Chinese Universities,2003,24(7):1296-1298.
[16]李振花,許根慧,王海京,等.銅基催化劑的制備方法對草酸二乙酯加氫反應的影響[J].催化學報,1995,16(1):9-14.
Li Zhenhua,Xu Genhui,Wang Haijing,et al.Effect of the preparation of Cu-based catalyst on the hydrogenation of diethyl oxalate[J].Chinese Journal of Catalysis,16(1):9-14.
[17]張啟云,黃維捷,文峰,等.草酸二甲酯加氫合成乙二醇反應的研究[J].石油化工,2007,36(4):340-344.
Zhang Qiyun,Huang Weijie,Wen Feng,et al.Hydrogenation of dimethyl oxalate to ethylene glycol[J].Petrochemical Technology,2007,36(4):340-344.
[18]馬友山,蘇杰,王春梅,等.一種含銅催化劑的還原方法:中國,CN00110704.6[P].2000-07-24.
[19]張曉陽,胡志彪,黃宏,等.甲醇水蒸汽重整制氫用銅基催化劑的還原方法:中國,CN200610021008.1[P].2006-10-25.
[20]王麗.液相還原法制備無氯銅基催化劑及其催化氧化羰基化[D].太原:太原理工大學,2010.
Wang Li.Chloride-free copper catalyst prepared by liquid-phase reduction method and oxycarbonylation catalysis[D].Taiyuan:Taiyuan University of Technology,2010.
[21]錢志剛.草酸二甲酯氣相催化加氫制乙二醇催化劑的研究[D].上海:華東理工大學,2004.
Qian Zhigang.Research on catalysts of gaseous dimethyl oxalate hydrogenation to ethylene glycol[D].Shanghai:Shanghai East China University of Science and Technology,2004.
[22]王保偉,張旭,許茜,等.Cu/SiO2催化劑的制備、表征及其對草酸二乙酯加氫制乙二醇的催化性能[J].催化學報,2008,29(3):275-280.
Wang Baowei,Zhang Xu,Xu Qian,et al.Preparation and characterization of Cu/SiO2catalyst and its catalytic activity for hydrogenation of diethyl oxalate to ethylene glycol[J].Chinese Journal of Catalysis,2008,29(3):275-280.
[23]李振花,李延春,許根慧.草酸二乙酯氣相催化加氫合成乙二醇的研究[J].化學工業與工程,1993,10(4):27-33.
[24]吉定豪.環己醇脫氫制環己酮銅基催化劑的研究[D].長春:吉林大學,2007.Ji Dinghao.The Study of copper-based catalysts in dehydrogenation of cyclohexanol to cyclohexanone[D].Changchun:Jilin University,2007.
[25]石雷,孫軍明,任世斌,等.用于一步法高效合成吲哚的Cu/SiO2催化劑的研究[J].催化學報,2003,25(5):384-386.
Shi Lei,Sun Junming,Ren Shibin,et al.Study on Cu/SiO2catalyst for efficient synthesis of indole via one-step method[J].Chinese Journal of Catalysis,2003,25(5):384-386.
[26]孫軍明.Cu/SiO2催化劑上苯胺和乙二醇一步合成吲哚的研究[D].大連:大連理工大學,2002.
Sun Junming.Study on Cu/SiO2catalyst for direct synthesis of indole[D].Dalian:Dalian University of Technology,2002.
[27]范崇正,王勝君.Raney-Cu催化劑在還原過程中的燒結行為[J].燃燒化學學報,1990,18(4):375-380.
Fan Chongzheng,Wang Shengjun.Sintering behavior of Raney-Cu catalyst in various reducing atmospheres[J].Journal of Fuel Chemistry and Technology,1990,18(4):375-380.
[28]陳長林,於德偉.水及還原溫度對氧化銪促進的Cu-ZnO催化劑上甘油氫解性能的影響[J].南京工業大學學報(自然科學版),2010,32(1):7-11.
Chen Changlin,Yu Dewei.Influence of water and reduction temperature on catalytic performance of Eu2O3promoted Cu-ZnO catalyst in the hydrogenolysis of glycerol[J].Journal of Nanjing University of Technology(Natural Science Edition),2010,32(1):7-11.
[29]葉炳火,江莉龍,魏可鎂,等.Ni-Cu-Mn-K/γ-Al2O3高溫變換催化劑的制備和還原條件[J].化工學報,2007,58(6):1445-1450.
Ye Binghuo,Jiang Lilong,Wei Kemei,et al.Preparation parameters and reduction conditions of Ni-Cu-Mn-K/γ-Al2O3catalysts for high-temperature shift reaction[J].Journal of Chemical Industry and Engineering(China),2007,58(6):1445-1450.
[30]殷永泉,肖天存,蘇繼新,等.原位紅外光譜研究Cu/Zn/Al催化劑的還原過程[J].天然氣化工,2000,25(3):20-22.
Yin Yongquan,Xiao Tiancun,Su Jixin,et al.In situ FI-IR studies on the reduction precess of Cu/Zn/Al catalyst[J].Natural Gas Chemical Industry,2000,25(3):20-22.
[31]鄭靜.甘油氫解反應中銅基催化劑的研究[D].長春:吉林大學,2009.
Zheng Jing.Study of hydrogenolysis of glycerol over Cu-based catalysis[D].Changchun:Jilin University,2009.
[32]王和高.甲醇催化劑的高氫還原[J].山西化工,1995,(3):42-43.
CLC number:TQ426.6;O643.36Document code: AArticle ID: 1008-1143(2016)03-0035-07
A review of the reduction process of copper based catalyst
XiaoErfei*,LiuHuawei,QianShengtao,LiuYingjie,LeiJun,WangXianhou,KongYuhua
(Hubei Industrial Gas Purification and Utilization Key Laboratory, Haiso Technology Co., Ltd.,Wuhan 430074, Hubei, China)
Abstract:Copper based catalysts are widely used in commercial production. The reduction of catalyst is the last step in the process of catalyst production, and also the first step before use. The reduction processes of several copper based catalysts were reviewed. Copper based catalysts were mainly used for synthesis of methanol from CO and H2 and CO low temperature conversion, and could also be applied for synthesis of methanol from CO2 and H2 as well as the synthesis of fatty alcohol from fatty ester hydrogenation. The reduction methods of copper based catalysts mainly had the liquid phase reduction method and the gas phase reduction method, in which the gas phase reduction method was widely used. The conditions (H2 concentration, temperatures, pressure and space velocity, etc.) and impurities (H2O, O2 and CO2, etc.) which influenced on the catalyst reduction were summaried. Using methanol synthesis catalyst as an example, the low hydrogen reduction method and the high hydrogen reduction method were introduced.
Key words:catalyst engineering; copper based catalyst; methanol synthesis catalyst; reduction
中圖分類號:TQ426.6;O643.36
文獻標識碼:A
文章編號:1008-1143(2016)03-0035-07
doi:10.3969/j.issn.1008-1143.2016.03.005 10.3969/j.issn.1008-1143.2016.03.005
作者簡介:肖二飛,1982年生,碩士,工程師。
收稿日期:2015-09-16;修回日期:2015-11-23
通訊聯系人:肖二飛。

