5種干預療法對去卵巢骨質疏松大鼠骨髓脂肪細胞數目和PPARγ2蛋白表達水平的影響
卜淑敏 楊涵

摘要:采用去卵巢骨質疏松大鼠模型,觀察跑臺運動、全身垂直振動、金雀異黃酮、雌激素和氯化鋰5種干預療法對去卵巢骨質疏松大鼠骨髓脂肪細胞數目和過氧化物酶體增殖激活物受體γ2(PPARγ2)蛋白表達水平的影響。方法:將80只3月齡雌性SD大鼠按體重分層后隨機分為假手術組和去卵巢組,去卵巢10周后,將去卵巢組大鼠按體重分層后又隨機分為去卵巢組、雌激素組、金雀異黃酮組、氯化鋰組、跑臺運動組和全身垂直振動組。去卵巢第11周時,不同組別的大鼠開始進行不同干預處理。干預8周后,用HE染色法觀察左脛骨組織形態學和骨髓脂肪細胞空泡數目的變化;用Western blotting檢測右脛骨近端骨組織PPARγ2蛋白表達水平的變化。結果:經雌激素、金雀異黃酮、跑臺運動和氯化鋰干預后,去卵巢骨質疏松大鼠脛骨松質骨骨小梁數目顯著增加,脂肪空泡數目和PPARγ2蛋白表達水平顯著下降,而經全身垂直振動干預后,去卵巢骨質疏松大鼠脛骨松質骨骨小梁數目顯著增加,脂肪空泡數量顯著減少,但PPARγ2蛋白表達水平無顯著變化。結論:雌激素、金雀異黃酮、跑臺運動和氯化鋰可能是通過下調去卵巢骨質疏松大鼠骨組織PPARγ2蛋白的表達水平而抑制去卵巢骨質疏松大鼠骨髓細胞向脂肪細胞的分化。
關鍵詞: 去卵巢大鼠;跑臺運動;全身垂直振動;金雀異黃酮;PPARγ2
中圖分類號: G 804.2 文章編號:1009783X(2016)03027004 文獻標志碼: A
Abstract:The aim of this study was to investigate the effects of five different intervention methods on the bone histology and the protein expression of peroxisomeproliferatoractivated receptorgamma2 (PPARγ2) in the ovariectomized osteoporosis rats.Methods:Eighty healthy female SD rats,aged 3 months,were randomly divided into the following two groups by body weight:shamoperation (Sham) and ovariectomized (OVX).After ten weeks,the OVX group rats were randomly divided into the following six groups by body weight:OVX;17βestradiol (E2);Genisteine (G);treadmill exercise (TE);Lithium chloride (LiCL);Wholebody vertical vibration (WBVV).Then the rats began to be treated with different intervention methods.At the end of 8 weeks intervention,during 3648 hours,the tibia was isolated.The morphological changes of the left tibia were observed by HE staining and the protein expression of PPARγ2 in right tibia were detected by western blot.Results:After treated with E2,treadmill exercise,wholebody vertical vibration,genistein and LiCL,the number of trabecular bone were significantly increased and the number of bone marrow adipocytes were significantly decreased than that of in OVX group.After treated with E2,treadmill exercise,genistein and LiCL,the protein expression of PPARγ2 were significantly lower than that of in OVX group.However,wholebody vertical vibration treatment had no significant difference.Conclusions:Treadmill exercise,E2,genistein and LiCL could inhibit the differentiation of bone marrow stromal cells to fat cells by inhibiting the protein expression of PPARγ2 in bones of OVX osteoporosis rats.
Keywords:ovariectomized osteoporosis rats;treadmill exercise;genistein;lithium chloride;PPARγ2
在人的一生中,骨骼都在持續經歷著骨形成和骨吸收的重塑過程。在生長發育期和年輕時,骨平衡是正平衡,即骨形成大于骨吸收;但40歲以后,骨吸收則大于骨形成,骨量開始下降,隨著年齡進一步增加會出現骨質疏松癥狀[1]。絕經后婦女體內雌激素的缺乏是引起骨量急劇下降、發生骨質疏松的主要原因[2]。雖然目前治療絕經后骨質疏松的方法有激素替代療法、雙磷酸鹽、植物雌激素等藥物療法,以及運動、電脈沖刺激等非藥物療法[37],但絕經后骨質疏松的防治仍具有挑戰性。盡管人體和動物實驗均已證明了跑臺運動、金雀異黃酮、全身垂直振動、雌激素和氯化鋰等不同療法的骨質疏松治療效應,但對其作用機制還不是很清楚。
隨著年齡的增加,成骨發生的下降會伴隨骨髓脂肪發生的增加,因為成骨細胞和脂肪細胞來源于共同的骨髓基質干細胞[8]。已有研究表明, 絕經后骨質疏松的發生與骨髓基質細胞向脂肪細胞方向分化的增加有關[9],因此,調節骨髓基質細胞向成骨細胞和脂肪細胞分化的平衡可能是骨質疏松防治的新策略。動物研究[10]表明,過氧化物酶體增殖激活物受體γ2(PPARγ2)能使骨髓細胞脂肪分化增加,導致骨丟失。鑒此,本文采用去卵巢骨質疏松大鼠模型,觀察雌激素、全身垂直振動、跑臺運動、金雀異黃酮和氯化鋰5種干預療法對去卵巢骨質疏松大鼠骨組織骨髓脂肪細胞數目和PPARγ2蛋白表達水平的影響。
1 材料與方法
1.1 材料
SD大鼠購自北京大學實驗動物部(動物合格證號SCXK(京)20110012)。17βestradiol (E2)和金雀異黃酮購自Sigma公司。PPARγ2和βactin抗體購自SC公司。BCIP/NBT顯色濃縮液和馬抗小鼠IgG/堿磷酶標記抗體購自北京中杉金橋生物技術有限公司。SDSPAGE蛋白上樣緩沖液和RIPA蛋白裂解液(強型)購自海門碧云天生物技術有限公司。Leica軟組織切片機購自德國。研究級正置熒光顯微鏡購自日本尼康。DSPT202型大鼠跑臺由杭州段氏制造廠生產。DYY7C型電泳儀購自北京六一儀器廠。垂直振動臺由北京雅士林廠生產。
1.2 研究方法
1.2.1 實驗分組
大鼠每天自由進食標準嚙齒類飼料,自由飲用自來水,每籠5只分籠飼養。適應性喂養1周后,稱量各只大鼠的體重,然后按體重分層后隨機分為去卵巢手術組(68只)和假手術組(12只)。2組大鼠手術前均禁食12~18 h,腹腔注射10%水合氯醛(3 mL/kg)麻醉,從背部切除手術組大鼠雙側卵巢,而假手術組大鼠的卵巢不切除,只切除卵巢脂肪墊中與卵巢相當大的一塊脂肪。無菌手術在北京大學醫學部實驗動物科學部進行[SYXK(京)20110039]。術后靜養10周,第11周時稱量去卵巢組大鼠體重并按體重分層后將其隨機分為去卵巢組(11只)、金雀異黃酮組(10只)、雌激素組(9只)、跑臺組(9只)、振動組(9只)、氯化鋰組(9只)。實驗過程中有11只大鼠先后死亡。
1.2.2 不同干預療法處理方案
手術后第11周,不同組別的去卵巢大鼠分別進行不同的干預處理,具體干預方案同前期報道[11], 即雌激素組采用頸部皮下注射17β雌二醇,劑量為25 μg/kg體重,每周3次;金雀異黃酮組采用灌胃,劑量為1 mg/kg體重,每周7次;氯化鋰組采用腹腔注射氯化鋰,劑量為15 mg/kg體重,每周3次。跑臺組每次進行速度18 m/min、坡度5°、時間40 min的跑臺訓練,每周4次;振動組每天進行2次時間15 min、頻率90 Hz、振幅0.5 mm的振動訓練,每周7次。
1.2.3 HE
將固定好的脛骨近端投入15%EDTA溶液中脫鈣,脫鈣后用常規石蠟包埋方法進行處理,用Leica軟組織切片機將骨標本切成5 μm切片。切片經二甲苯脫蠟、梯度乙醇脫水、常規蘇木素伊紅染色、中性樹脂封片后,在顯微鏡下觀察拍照計數脂肪空泡數目。
1.2.4 Western blot
Western blot方法參照前期報道[11]。將稱量的200 mg骨組織放入研磨器中,加入液氮迅速研磨成粉末后移入1.5 mL離心管,加入1 mL組織裂解液,放入低溫離心機中作用1 h后,12 000 r/min、4 ℃離心30 min,取上清,留一部分檢測蛋白質濃度,其余蛋白樣品與SDSPAGE蛋白上樣緩沖液(5X)按照4∶1的比例混勻,沸水變性5 min,分裝后凍入-80 ℃冰箱。取10~15 μL蛋白樣品上樣,80 V電壓電泳約2 h后,再以80 V電壓轉移2 h。取出PVDF膜,放入5%脫脂奶粉溶液中室溫封閉1 h,加入一抗4 ℃過夜,次日用TBST緩沖液洗4次,每次10 min,分別加馬抗小鼠Ig/G堿磷酶標記二抗,室溫孵育2 h,用TBST緩沖液洗4次,每次10 min,然后將PVDF膜放入BCIP/NBT顯色液中避光顯色至條帶出現,將膜撈出放入水中以終止顯色,用數碼相機拍照,用Quantity One軟件掃描計算各條帶的灰度值。
1.3 統計學分析
采用SPSS 19.0軟件對實驗數據進行統計學分析,實驗結果以均值±標準差表示,用單因素方差進行分析。若方差齊時,用LSD posthoc檢驗;若方差不齊時,用Tamhane posthoc檢驗。P<0.05為顯著性差異,P<0.01為極顯著性差異。
2 結果
2.1 5種干預療法對去卵巢骨質疏松大鼠體重、腹部脂肪重量和子宮重量的影響
干預8周后,與假手術組大鼠比較,去卵巢組大鼠體重和腹腔脂肪重量顯著增加,而子宮重量顯著降低,見表1。與去卵巢組大鼠比較,雌激素組、金雀異黃酮組、跑臺組和振動組大鼠體重和腹腔脂肪重量均顯著下降,而氯化鋰組大鼠未見顯著性差異。與去卵巢組大鼠比較,只有雌激素組大鼠子宮重量顯著增加,其余各組未見顯著性差異。與干預前體重比較,去卵巢組顯著增加,雌激素組顯著下降,而其余4組未見顯著性差異。與去卵巢組比較,雌激素組、金雀異黃酮組、跑臺組和振動組干預前后體重的變化量均顯著降低,而氯化鋰組未見顯著性差異。
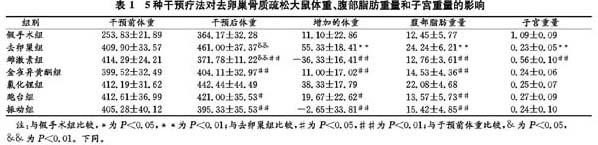
2.2 5種干預療法對去卵巢骨質疏松大鼠脛骨近端骨組織形態學和脂肪空泡數目的影響
如圖1和圖2所示,假手術組大鼠脛骨近端骨小梁致密,排列整齊,大鼠去卵巢后骨小梁明顯變得稀疏,出現斷裂、消失,骨髓腔內脂肪空泡數目顯著增加,經雌激素、金雀異黃酮、氯化鋰、跑臺運動和全身垂直振動干預8周后,骨小梁增加,骨髓腔內脂肪空泡數目顯著減少。
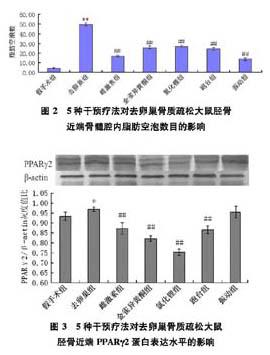
2.3 不同干預療法對去卵巢骨質疏松大鼠脛骨近端PPARγ2蛋白表達水平的影響
與假手術組大鼠比較,去卵巢組大鼠脛骨近端PPARγ2蛋白表達水平顯著增加;與去卵巢組比較,雌激素組、金雀異黃酮組、氯化鋰組和跑臺組脛骨近端PPARγ2蛋白表達水平均顯著降低,振動組脛骨近端PPARγ2蛋白表達水平未見顯著變化。
3 討論
隨著年齡的增加,眾多婦女絕經后不僅骨量急劇下降,腹部脂肪也隨之增加,易發生骨質疏松和代謝綜合征[12]。本研究中,大鼠去卵巢后體重和腹腔內脂肪重量顯著增加,經雌激素、金雀異黃酮、跑臺運動和全身垂直振動干預后,體重和腹腔內脂肪重量均顯著下降,而經氯化鋰干預后,體重和腹腔內脂肪重量均未見顯著變化。結果提示:除氯化鋰外,雌激素、金雀異黃酮、跑臺運動和全身垂直振動干預處理均能顯著抑制大鼠由去卵巢導致的肥胖。
骨髓脂肪增加和骨量下降的相關性有助于更好地理解骨丟失的病理及絕經后骨質疏松的預防和治療[13]。有研究表明,去卵巢大鼠骨髓脂肪增加伴隨骨量下降[14]。Somjen等[15]的研究表明,天然的和人工合成的雌激素均能逆轉由去卵巢誘導的骨髓脂肪發生。我們的前期研究表明,跑臺運動能抑制去卵巢大鼠骨髓脂肪數目的增加[16]。已有研究表明,氯化鋰不僅可產生抗成脂發生的效應[17],且具有促進成骨發生的效應[18]。本研究中,雌激素、金雀異黃酮、跑臺運動、全身振動和氯化鋰干預8周均能顯著抑制去卵巢骨質疏松大鼠骨髓脂肪細胞數量的增加。結果提示:雌激素、金雀異黃酮、跑臺運動、全身振動和氯化鋰對去卵巢骨質疏松大鼠的干預效應與其抗骨髓脂肪發生有關。至于干預效應是否和促進成骨發生有關,還有待實驗證實。
骨髓脂肪細胞的分化受核受體家族PPAR的調節。轉錄因子PPARγ的缺乏能減少小鼠骨髓脂肪含量,加強成骨發生[19]。相反,成骨細胞過表達PPARγ能加快由去卵巢導致的骨質疏松的發生[20]。為了探討雌激素、金雀異黃酮、跑臺運動、全身垂直振動和氯化鋰減少去卵巢骨質疏松大鼠骨髓脂肪數目的機制,本文采用免疫印跡方法檢測PPARγ2蛋白表達水平的變化。結果表明:雌激素、金雀異黃酮、跑臺運動和氯化鋰干預均能抑制去卵巢骨質疏松大鼠脛骨近端PPARγ2蛋白的表達水平,而全身垂直振動卻無此抑制效應。
4 結論
結果表明,雌激素、跑臺運動、金雀異黃酮和氯化鋰干預均可能通過抑制去卵巢骨質疏松大鼠骨組織PPARγ2蛋白表達水平而抑制去卵巢骨質疏松大鼠骨髓基質細胞向脂肪細胞的分化,而全身垂直振動對去卵巢骨質疏松大鼠骨髓基質細胞向脂肪細胞分化的抑制效應可能與PPARγ2蛋白表達水平無關。
參考文獻:
[1]JEREMIAH M P,UNWIN B K,GREENAWALD M H,et al.Diagnosis and management of osteoporosis[J].Am Fam Physician,2015,92(4):263.
[2]MAEDA S S,LAZARETTICASTRO M.An overview on the treatment of postmenopausal osteoporosis[J].Arq Bras Endocrinol Metabol,2014,58(2):168.
[3]MARAKA S,Kennel K A.Bisphosphonates for the prevention and management of postmenopausal osteoporosis[J].BMJ,2015,351:3783.
[4]WEBERRAJEK M,MIESZKOWSKI J,NIESPODZIRKI B,et al.Wholebody vibration exercise in postmenopausal osteoporosis[J].Prz Menopauzalny,2015,14(1):44.
[5]LIU H,LIU Y,YANG L,et al.Curative effects of pulsed electromagnetic fields on postmenopausal osteoporosis[J].Journal of Biomedical Engineering,2014,31(1):50.
[6]BERNABEI R,MARTONE A M,ORTOLANI E,et al.Screening,diagnosis,and treatment of osteoporosis:a brief review[J].Clin Cases Miner Bone Metab,2014,11(3):204.
[7]WEBERRAJEK M,MIESZKOWSKI J,NIESPODZISKI,et al.New antiresorptive therapies for postmenopausal osteoporosis[J].J Menopausal Med,2015,21(1):6.
[8]KUSHWAHA P,KHEDGIKAR V,GAUTAM J,et al.A novel therapeutic approach with aviuninbased isoflavonoid that en routes bone marrow cells to bone formation via BMP2/Wntβcatenin signaling[J].Cell Death Dis,2014(5):1422.
[9]FAN J Z,WANG Y,MENG Y,et al.Panax notoginseng saponins mitigate ovariectomyinduced bone loss and inhibit marrow adiposity in rats[J] .Menopause,2015,22(12):1347.
[10]ZHUANG H,ZHANG X,ZHU C,et al.Molecular Mechanisms of PPARγ Governing MSC Osteogenic and Adipogenic Differentiation[J].Curr Stem Cell Res Ther,2016,11(3):255.
[11]郭蓋,卜淑敏,韓天雨.不同干預療法對去卵巢骨質疏松大鼠子宮GSK3β蛋白表達的影響[J].中國實驗動物學報,2014,22(5):54.
[12]JUNG S R,KIM S H,AHN N Y,et al.A novel therapeutic approach with Caviuninbased isoflavonoid that en routes bone marrow cells to bone formation via BMP2/Wntβcatenin signaling[J].Cell Death Dis,2014(5):1422.
[13]LI G W,XU Z,CHANG S X,et al.Influence of early zoledronic acid administration on bone marrow fat in ovariectomized rats[J].Endocrinology,2014,155(12):4736.
[14]YAN G F,YUAN P W,HAO Y Q,et al.Emodin enhances osteogenesis and inhibits adipogenesis[J].BMC Complement Altern Med,2014(14):74.
[15]SOMJEN D,KATZBURG S,KOHEN F,et al.The effects of native and synthetic estrogenic compounds as well as vitamin D lesscalcemic analogs on adipocytes content in rat bone marrow[J].J Endocrinol Invest,2011,34(2):108.
[16]CHEN Y,WANG S,BU S,et al.Treadmill training prevents bone loss by inhibition of PPARγ expression but not promoting of Runx2 expression in ovariectomized rats[J].Eur Appl Physiol,2011,111(8):1764.
[17]MAI Y,ZHANG Z,YANG H,et al.BMP and activin membranebound inhibitor(BAMBI) inhibits the adipogenesis of porcine preadipocytes through Wnt/βcatenin signaling pathway[J].Biochem Cell Biol,2014,92(3):179.
[18]GALLI C,PIEMONTESE M,LUMETTI S,et al.GSK3binhibitor lithium chloride enhances activation of Wnt canonical signaling and osteoblast differentiation on hydrophilic titanium surfaces[J].Clin Oral Implants Res,2013,24(8):925.
[19]ZHAO X Y,CHEN X Y,ZHANG Z J,et al.Expression patterns of transcription factor PPARγ and C/EBP family members during in vitro adipogenesis of human bone marrow mesenchymal stem cells[J].Cell Biol Int,2015,39(4):462.
[20]CHO S W,YANG J Y,HER S J,et al.Osteoblasttargeted overexpression of PPARγ inhibited bone mass gain in male mice and accelerated ovariectomyinduced bone loss in female mice[J].J Bone Miner Res,2011,26(8):1949.
[21]TANG L,CHEN Y,PEI F,et al.Lithium Chloride Modulates Adipogenesis and Osteogenesis of Human Bone MarrowDerived Mesenchymal Stem Cells[J].Cell Physiol Biochem,2015,37(1):150.
[22]ZHANG Y,MA C,LIU X,et al.Epigenetic landscape in PPARγ2 in the enhancement of adipogenesis of mouse osteoporotic bone marrow stromal cell[J].Biochim Biophys Acta,2015,1852(11):2514.

