順鉑作用于人肝癌細胞系HepG2后對腫瘤干細胞標志物的影響*
徐穎佳,薛贏俊,陸嬋娟
(1.同仁醫院檢驗科,上海 200050;2.上海中醫藥大學附屬龍華醫院檢驗科,上海 200333)
?
·論著·
順鉑作用于人肝癌細胞系HepG2后對腫瘤干細胞標志物的影響*
徐穎佳1,薛贏俊2,陸嬋娟1
(1.同仁醫院檢驗科,上海 200050;2.上海中醫藥大學附屬龍華醫院檢驗科,上海 200333)
摘要:目的研究順鉑作用于人肝癌細胞系HepG2后對腫瘤干細胞標志物的影響。方法培養HepG2人肝癌細胞,以對數生長期的細胞為研究對象,分成對照組和實驗組,對照組不予特殊處理,實驗組予以順鉑處理并測定細胞生長抑制率、移行愈合率,并測定相關腫瘤標記物P53、caspase-3、caspase-8、CD133、腺苷三磷酸結合盒轉運體G2(ABCG2)、細胞間黏附分子-1(ICAM-1)等的表達變化。結果細胞生長抑制率:隨著藥物濃度增加而增強,與對照組比較,差異有統計學意義(P<0.05)。細胞移行愈合率:實驗組細胞移行愈合率明顯低于對照組(P<0.05),9 μmol/L順鉑組移行愈合率明顯低于6 μmol/L順鉑組(P<0.05)。相關腫瘤標記物P53、caspase-3、caspase-8隨著藥物濃度增加而各指標表達增強,與對照組相比差異有統計學意義(P<0.05)。細胞免疫熒光方法顯示隨著順鉑濃度的增加,CD133、ABCG2、ICAM-1的表達增強。結論順鉑可能通過上調腫瘤標記物P53、caspase-3、caspase-8的表達,從而抑制人肝癌細胞HepG2的生長,并抑制HepG2細胞的遷移愈合,但會使其耐藥性也增加。
關鍵詞:順鉑;肝癌;腫瘤干細胞;細胞增殖;細胞周期
原發性肝癌在我國較為常見,發病率、病死率較高[1],大部分患者確診時已喪失手術機會,對于這部分的肝癌患者化療為首選治療措施[2]。腫瘤干細胞在腫瘤增殖、轉移過程中起重要作用。腫瘤干細胞具有無限增殖、分化的能力,可能具有抵抗化療藥物損傷的作用,從而導致腫瘤細胞增殖、轉移。P53基因是一種抑癌基因[3],caspase-8在細胞凋亡中起重要作用,通過激發級聯反應,活化caspase-3[4],三者在在肝癌細胞系HepG2細胞凋亡中起關鍵作用。本實驗探討了順鉑對人肝癌HepG2腫瘤干細胞增殖、遷移能力的影響,在細胞水平上,通過MTT法測定細胞增殖能力,細胞劃痕實驗觀察細胞遷移愈合能力,逆轉錄PCR(RT-PCR)檢測P53、caspase-3、caspase-8的表達情況,細胞免疫熒光方法檢測CD133、腺苷三磷酸結合盒轉運體G2(ABCG2)、細胞間黏附分子-1(ICAM-1)等的表達,以期為肝癌的藥物治療提供借鑒。現報道如下。
1材料與方法
1.1儀器與試劑細胞培養基購于GIBCO公司;胎牛血清購自PAA公司,MTT購自Sigma公司;順鉑購自山東齊魯制藥有限公司;Trizol購自海生工生物工程技術有限公司;逆轉錄試劑盒購自上海萊楓生物科技有限公司;CD133、ABCG2、ICAM-1抗體購自北京博奧森生物技術有限公司。
1.2方法
1.2.1細胞培養人HepG2肝癌細胞株在37 ℃、50 mL/L CO2的環境下,在含1%青霉素和鏈霉素、100 mL/L的胎牛血清的培養基中培養。
1.2.2細胞增殖實驗實驗分為對照組和實驗組,對照組不加入順鉑(空白),實驗組培養基中加入順鉑(分為3、6、9、12、15、18、24、30 μmol/L 8個濃度梯度),每個孔中為100 μL的7×104/mL的人HepG2肝癌細胞懸濁液,培養48 h后,應用MTT法檢測細胞增殖的情況,記錄吸光度A490值,計算細胞增殖抑制率,重復3次,求平均值。
1.2.3細胞劃痕實驗實驗分為對照組和實驗組,對照組不加入順鉑(空白),實驗組培養基中加入順鉑(分為6、9 μmol/L 2個濃度梯度),每個孔中為600 μL的7×104/mL的人HepG2肝癌細胞懸濁液。待細胞鋪滿板底,用無菌20 nL槍頭在24孔板底部劃出一條直線,每孔只劃一次,加入培養基及藥物后培養24 h后,測定移行愈合率:移行愈合率=(初始邊緣距離-24 h后邊緣距離)/初始邊緣距離×100%,重復3次,求平均值。
1.2.4順鉑對HepG2細胞增殖抑制作用機制的研究細胞分為對照組和實驗組,對照組為空白,實驗組培養基中加入順鉑(分為5.4、10.76 μmol/L 2個濃度),10.76 μmol/L和5.4 μmol/L分別為順鉑作用于人肝癌HepG2腫瘤干細胞48 h的細胞半數抑制濃度(IC50)的1/2和1/4,每個孔中為600 μL的7×104/mL的人HepG2肝癌細胞懸濁液,待細胞鋪滿板底,加入藥物,培養48 h,提取細胞總RNA,鑒定P53、caspase-3、caspase-8等相關RNA的純度和分析濃度,合成cDNA,電泳分析PCR產物。
1.2.5HepG2腫瘤干細胞標記物的檢測實驗分組分為對照組和實驗組,對照組為空白,實驗組加入順鉑(分為5.4、10.76 μmol/L 2個濃度),隨后的操作和1.2.4相同,培養48 h后用細胞免疫熒光方法檢測CD133、ABCG2、ICAM-1的表達。

2結果
2.1細胞增殖能力的測定單獨運用3、6、9、12、15、18、24、30 μmol/L 8個濃度梯度的順鉑作用于人肝癌HepG2腫瘤干細胞48 h后,測定A490值,計算細胞增殖抑制率。各處理組與對照組比較,差異有統計學意義(P<0.05)。順鉑對人肝癌HepG2腫瘤干細胞有抑制增殖的作用,IC50時的順鉑濃度為21.52 μmol/L,藥物抑制作用隨著順鉑濃度的增加而增強,差異有統計學意義(P<0.05)。見表1。
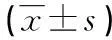
表1 順鉑作用于HepG2細胞48 h后對細胞增殖的
-:該項無數據。
2.2順鉑對HepG2細胞遷移的影響測定移行愈合率的比較,實驗組(2個濃度)與對照組比較,差異均有統計學意義(P<0.05),實驗組移行愈合率明顯低于對照組。6和9 μmol/L兩個濃度組比較,差異有統計學意義(P<0.05),9 μmol/L順鉑組移行愈合率明顯低于6 μmol/L順鉑組。見表2。
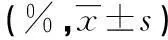
表2 不同濃度順鉑的作用下HepG2細胞移行愈合率的
2.3順鉑對HepG2細胞增殖的抑制作用機制計算實驗組條帶的光密度值與相應的內參光密度值的比值然后與對照組進行比較,差異均有統計學意義(P<0.05),順鉑組caspase-3、caspase-8、P53表達水平上調。見表3。
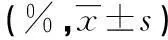
表3 順鉑對HepG2細胞P53、caspase-3、caspase-8表達
2.4順鉑對人肝癌細胞株HepG2腫瘤干細胞標志物的影響細胞免疫熒光方法示,隨著順鉑濃度的增加,CD133、ABCG2、ICAM-1的表達增強,因此可知,順鉑刺激了腫瘤干細胞耐藥性的增加。
3討論
順鉑具有廣譜的抗腫瘤作用,影響腫瘤細胞代謝周期,促進其凋亡,有抑制腫瘤細胞增殖的作用。原發性肝癌在我國較為常見,發病率、病死率較高,首選的治療措施是手術切除,但本病發病隱匿,發現時已屬晚期,出現腫瘤細胞播散和遠處轉移,已喪失手術機會,對于這部分的肝癌患者化療為首選措施,所以順鉑被常用于肝癌的化療。腫瘤干細胞在腫瘤增殖、轉移過程中起重要作用,腫瘤干細胞具有無限增殖、分化的能力,可能具有抵抗化療藥物損傷的作用,從而導致腫瘤細胞增殖轉移,在腫瘤增殖、分化中P53、caspase-3、caspase-8的表達起到重要作用[5-7]。本實驗探討了順鉑對人肝癌HepG2腫瘤干細胞增殖、遷移能力的影響。在細胞水平上,通過MTT法測定細胞增殖能力,細胞劃痕實驗觀察細胞遷移愈合能力,RT-PCR檢測P53、caspase-3、caspase-8的表達情況。實驗中用3、6、9、12、15、18、24、30 μmol/L 8個濃度的順鉑分別作用于人肝癌HepG2腫瘤干細胞48 h后,測定A490值、細胞增殖抑制率,發現順鉑對人肝癌HepG2腫瘤干細胞有抑制增殖的作用,藥物抑制作用隨著順鉑濃度的增加而增強。順鉑的IC50為21.52 μmol/L。6和9 μmol/L濃度的實驗組與對照組比較,實驗組的移行愈合率明顯低于對照組;6和9 μmol/L濃度下的實驗組比較,高濃度順鉑組移行愈合率明顯低于低濃度的順鉑組。順鉑作用于HepG2細胞48 h使caspase-3、caspase-8、P53表達水平上調可能是其抑制細胞增殖的機制。CD133是腫瘤干細胞的廣譜標志物之一,ABCG2是腫瘤細胞逃避藥物作用的標志物之一,ICAM-1是一細胞黏附分子,在腫瘤的侵襲和轉移過程中發揮重要作用,細胞免疫熒光方法顯示:隨著順鉑濃度的增加,CD133、ABCG2、ICAM-1的表達增強,因此可知,順鉑刺激了腫瘤干細胞耐藥機制的加強。
綜上所述,順鉑作用于肝癌HepG2腫瘤干細胞后,可能通過上調腫瘤標記物P53、caspase-3、caspase-8表達,從而抑制人HepG2肝癌細胞的生長,并抑制人HepG2腫瘤細胞的遷移愈合,且隨著藥物濃度增加而抑制作用增強。但是順鉑在應用于肝癌患者后普遍出現耐藥現象,對于其耐藥機制的研究還有待于進一步完善[8-10]。
參考文獻
[1]Cheung ST,Cheung PF,Cheng CK,et al.Granulin-epithelin precursor and ATP-dependent binding cassette(ABC)B5 regulate liver Cancer cell chemoresistance[J].Gastroenterology,2011,140(1):344-355.
[2]Williamson JM,Thairu N,Katsoulas N,et al.Impact of portal vein embolization on expression of Cancer stem cell markers in regenerated liver and colorectal liver metastases[J].Scand J Gastroenterol,2010,45(12):1472-1479.
[3]Zhu AX,Duda DG,Ancukiewicz M,et al.Exploratory analysis of early toxicity of sunitinib in advanced hepatocellular carcinoma patients:kinetics and potential biomarker value[J].Clin Cancer Res,2011,17(4):918-927.
[4]Na DC,Lee JE,Yoo JE,et al.Invasion and EMT-associated genes are up-regulated in B viral hepatocellular carcinoma with high expression of CD133-human and cell culture study[J].Exp Mol Pathol,2011,90(1):66-73.
[5]萬元泰,劉小敏,虞金寶,等.肝復康膠囊對人肝癌細胞系HepG2的影響[J].中國實驗方劑學雜志,2011,17(21):165-168.
[6]鐘揚,李靖,黃小兵,等.慢病毒載體介導的人肝癌HepG2細胞BC047440基因沉默[J].第三軍醫大學學報,2010,32(8):744-748.
[7]劉禮,謝紀文,王熙,等.EGCG聯合不同劑量放療對人肝癌細胞系HepG2中hTERT表達的影響[J].世界華人消化雜志,2010,18(18):1873-1878.
[8]張方宇,何松.乳糖脂修飾苦參堿脂質體的肝靶向性和體外抑瘤作用研究[J].重慶醫科大學學報,2009,34(6):747-751.
[9]葛金華,朱月永,劉豫瑞,等.siRNA降低COX-2基因表達對肝癌細胞系HepG2增殖的影響[J].世界華人消化雜志,2009,17(22):2244-2250.
[10]特日格樂,邰大鵬,劉剛,等.人肝癌細胞系HepG2的次黃嘌呤鳥嘌呤磷酸核糖轉移酶缺陷型的建立[J].中國畜牧獸醫,2011(12):92-95.
The effects of cisplatin on cancer stem cell markers of hepatocellular carcinoma cell line HepG2*
XuYingjia1,XueYinjun2,LuChanjuan1
(1.DepartmentofClinicalLaboratory,TongrenHospital,Shanghai200050,China;2.DepartmentofClinicalLaboratory,LonghuaHospitalAffiliatedtoShanghaiUniversityofTraditionalChineseMedicine,Shanghai200333,China)
Abstract:ObjectiveTo observe the effects of cisplatin on the expression of tumor stem cell markers in human hepatoma cell line HepG2.MethodsThe cultured human hepatoma HepG2 cells in logarithmic growth phase were used for the study,which were divided into control(no special treatment was administrated) and experimental groups(cisplatin was added),then the rates of cell growth inhibition,transitional healing rates and changes in tumor associated markers associated P53,caspase-3,caspase-8,CD133,adenosine triphosphate-binding cassette superfamily G member 2(ABCG2),intercellular cell adhesion molecule-1(ICAM-1) were measured.ResultsComparison of cell growth inhibition:with the increase of drug concentration increased,compared with the control group,the difference was statistically significant(P<0.05).Transitional healing rate:with the increase of drug concentration,compared with the control group,the difference was statistically significant(P<0.05).The expression of related tumor markers P53,caspase-3,caspase-8 increased while the drug concentrations increase and were higher in the control group(P<0.05),the difference were statistically significant.In the immunofluorescence for the detection of CD133,ABCG2,ICAM-1,the fluorescence intensity increased with the concentrations of cisplatin.ConclusionCisplatin could inhibit the growth of tumor cells by up-regulating the tumor markers such as P53,caspase-3 and caspase-8.The migration of tumor cells in cell scratch test could also be inhibited by cisplatin while their drug resistance were enhanced.
Key words:cisplatin;liver cancer;cancer stem cells;cell proliferation;cell cycle
(收稿日期:2015-12-25)
DOI:10.3969/j.issn.1673-4130.2016.08.003
文獻標識碼:A
文章編號:1673-4130(2016)08-1023-03
基金項目:上海市藥學會醫院藥學科研基金(2012-YY-01-02)。
作者簡介:徐穎佳,女,檢驗師,主要從事免疫分子生物學方面的研究。

