IL-6對Raji和OCI-LY8細胞生長影響的分子機制**?
楊文秀,李品浩,陳 琴,裴媛媛
(貴州醫(yī)科大學病理學教研室,貴州貴陽 550004)
?
IL-6對Raji和OCI-LY8細胞生長影響的分子機制**?
楊文秀,李品浩,陳琴,裴媛媛
(貴州醫(yī)科大學病理學教研室,貴州貴陽550004)
[摘要]目的:觀察白介素-6(IL-6)對伯基特淋巴瘤(BL) Raji細胞和彌漫大B細胞淋巴瘤(DLBCL) OCILY8細胞生長的影響,探討信號轉(zhuǎn)導子與轉(zhuǎn)錄活化-3(STAT3)及基質(zhì)金屬蛋白酶組織抑制因子-1(TIMP-1)分子在BL和DLBCL中發(fā)生發(fā)展的作用及其相互關系。方法:用不同濃度的IL-6(0、50、100、150及200 μg/L)分別培養(yǎng)Raji細胞和OCI-LY8細胞24 h、48 h及72 h(分別為對照組和不同濃度IL-6試驗組),用MTT法檢查2株細胞生長情況,用RT-qPCR檢測培養(yǎng)48 h時2株細胞STAT3、TIMP-1的mRNA表達,用Western blot檢測100 μg/L IL-6培養(yǎng)48 h時Raji細胞的STAT3、p-STAT3及TIMP-1蛋白的表達,流式細胞技術檢測100 μg/L IL-6培養(yǎng)48 h 時2株細胞的細胞周期變化。結果:與相應的對照組比較,不同濃度IL-6試驗組2株細胞在A490nm處OD值明顯降低,呈現(xiàn)藥物濃度依賴關系(P<0.01) ; 2株細胞內(nèi)的STAT3,TIMP-1的mRNA表達明顯升高(P<0.05),呈現(xiàn)出藥物濃度依賴關系(P<0.05),2株細胞內(nèi)TIMP-1與STAT3的mRNA表達呈正相關關系(r =0.982,P = 0.018) ; IL-6組Raji細胞中p-STAT3、STAT3和TIMP-1蛋白表達增高; IL-6組Raji和OCI-LY8細胞的G1期細胞都明顯減少、S期細胞明顯增多(P<0.05),G2-M期的Raji細胞無明顯變化而OCI-LY8細胞則明顯增多(P = 0.037)。結論: IL-6對Raji細胞和OCI-ly8細胞生長有明顯作用,STAT3活化及其下游靶基因TIMP-1的上調(diào)表達可能是IL-6影響2株細胞生長的重要分子機制。
[關鍵詞]淋巴瘤,B細胞;伯基特淋巴瘤;細胞培養(yǎng);信號轉(zhuǎn)導子與轉(zhuǎn)錄活化子-3;基質(zhì)金屬蛋白酶組織抑制因子-1;白細胞介素-6
網(wǎng)絡出版時間: 2016-02-23網(wǎng)絡出版地址: http: / /www.cnki.net/kcms/detail/52.5012.R.20160223.1909.022.html
信號轉(zhuǎn)導子與轉(zhuǎn)錄活化子3(single transducer and transcription activater-3,STAT3)是STATS家族的重要成員,多項臨床研究發(fā)現(xiàn),肝癌、乳腺癌、肺癌、胃癌等腫瘤中STAT3活性均發(fā)生高頻率的異常活化,且活化程度與患者的預后呈顯著負相關[1-4]。STAT3是EGFR、IL-6/JAK、Src等多個致癌性酪氨酸激酶信號通道的匯聚焦點[5],阻斷STAT3傳導通路可以阻斷多種腫瘤發(fā)生的機制。近年來,以STAT3為靶點的腫瘤治療研究逐漸成為腫瘤基因治療研究的熱點。有文獻報道,伯基特淋巴瘤(Burkitt lymphoma,BL)和彌漫大B細胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)中存在STAT3分子的異常,但其活化對BL和DLBCL影響的分子機制尚未完全清楚[6-7]。本研究觀察了STAT3激動劑白介素-6(interleukin-6,IL-6)對BLRaji細胞和DLBCL-OCI-LY8細胞生長的影響,并進一步探討了STAT3和基質(zhì)金屬蛋白酶組織抑制因子-1 (tissue inhibitors of metalloproteinase-1,TIMP-1)的活化是否是藥物作用的分子機制,為臨床治療BL和DLBCL尋找可能的基因靶點提供實驗依據(jù)。
1 材料和方法
1.1實驗材料
BL-Raji細胞株購自中國科學院上海細胞庫,DLBCL-OCI-LY8細胞株由復旦大學腫瘤醫(yī)院周曉燕教授惠贈。細胞培養(yǎng)基RPMI1640購自Hyclone公司,總RNA試劑盒購自上海碧云天公司,RTPCR試劑盒購自Invitrogen公司,抗STAT3(單克隆抗體)、抗TIMP-1和抗β-actin抗體購自Santa Cruz公司,抗p-STAT3抗體購自CST公司,IL-6購自Pepro TECH公司,PCR引物由上海生工合成。
1.2方法
1.2.1細胞培養(yǎng)和分組分別將Raji細胞和OCI-LY8細胞置于RPMI1640培養(yǎng)液(含10%胎牛血清和1%青霉素/鏈霉素)及混合培養(yǎng)基(含 10%胎牛血清、90% IMDM和1%雙抗)中,在37℃、5% CO2飽和濕度的恒溫培養(yǎng)箱中培養(yǎng),每2~3 d換液1次,待細胞計數(shù)>1×106/mL時,按1∶2~1∶3傳代培養(yǎng)。收集細胞并調(diào)節(jié)濃度為2× 105/mL,2株細胞分別加入不同濃度的IL-6(0、50、100、150及200 μg/L),分別為對照組和不同IL-6濃度試驗組,繼續(xù)培養(yǎng)24、48及72 h。
1.2.2檢測細胞活力用MTT法對細胞生長活力進行檢測。分別于培養(yǎng)24、48及72 h后收集對照組和不同IL-6濃度試驗組的Raji和OCI-ly8細胞,再于無血清培養(yǎng)基中培養(yǎng)24 h,同步化后于96孔板布板。每孔加入0.5% MTT 20 μL,繼續(xù)培養(yǎng)4 h,加入三聯(lián)溶劑(SDS 10 g +異丁醇5 mL + 10 mol/L HCl 0.1 mL,用雙蒸水溶解配成100 mL溶液) 150 μL,置搖床上低速振蕩10 min。鏡下觀察結晶物充分溶解后在酶聯(lián)免疫檢測儀490 nm處測量各孔的吸光值A。每組5個復孔,實驗重復3次。
1.2.3檢測STAT3和TIMP-1的mRNA按試劑盒說明提取細胞mRNA,檢測mRNA 260/280光密度比值。RT-qPCR擴增檢測STAT3和TIMP-1的mRNA相對表達量。PCR循環(huán)參數(shù): 95℃10 min、90℃15 s、60℃1 min,40個循環(huán)。結果用2-ΔΔCT表示,以β-actin作為內(nèi)參照。mRNA相對表達量2-ΔΔCt= 2-[實驗組(Ct目的基因-Ct管家基因)-對照(Ct目的基因-Ct管家基因)]。PCR引物序列和產(chǎn)物見表1。

表1 RT-qPCR引物序列及相應產(chǎn)物Tab.1 The sequences of the primers for RT-qPCR and corresponding products
1.2.4 STAT3、p-STAT3和TIMP-1蛋白表達IL-6的最佳作用濃度取100 μg/L,收集該濃度下培養(yǎng)48 h足量的Raji細胞,用PBS洗滌3次后,加入一定量的細胞裂解液及蛋白酶抑制劑,冰上不時振蕩充分裂解30 min,12 000 r/m離心5 min后取上清液。蛋白樣品采用BCA法進行定量后,進行PAGE凝膠電泳,每孔上樣30 mg,10%聚丙烯酰胺凝膠電泳后轉(zhuǎn)至PVDF膜上,用5% BSA封閉p-STAT3、5%脫脂牛奶封閉其他目的蛋白后,分別加一抗孵育過夜(稀釋度:抗STAT3、抗p-STAT3、抗TIMP-1均為1∶500,抗β-actin為1∶1 000),二抗稀釋比例為1∶5 000,洗膜,加辣根過氧化酶偶聯(lián)的二抗孵育1.5 h、再洗膜。加ECL發(fā)光液顯色,暗室曝光,得到STAT3、p-STAT3和TIMP-1的條帶膠片,膠片掃描后用Gelpro32軟件分析。
1.2.5檢測細胞周期分別將Raji細胞和OCILY8細胞以70 000 mL接種于6孔板中,加入最佳作用濃度(100 μg/L)的IL-6培養(yǎng)48 h后,收集Raji細胞和OCI-LY8細胞,用流式細胞儀檢測細胞周期。
1.3統(tǒng)計學方法
使用SPSS 20.0統(tǒng)計軟件包。STAT3,TIMP-1 的mRNA及蛋白表達水平采用兩獨立樣本t檢驗,藥物作用的多組間比較采用單因素方差分析,多組間均數(shù)的兩兩比較采用SNK q檢驗,多組均數(shù)與一個對照樣本均數(shù)比較采用Dunnett t檢驗。各藥物濃度組間兩分子表達之間的關系及分子表與藥物濃度的相關性關系采用Pearson相關性分析,以P <0.05為差異有統(tǒng)計學意義。
2 結果
2.1細胞活力
與相應的對照組比較,Raji細胞及OCI-LY8細胞490 nm處吸光度值在加入IL-6培養(yǎng)后顯著增高(P<0.05)。Raji和OCI-LY8細胞吸光度值與IL-6呈現(xiàn)出藥物濃度依賴關系,r和P依次為0.966、0.008及0.959、0.010。見圖1。
2.2 STAT3 mRNA和TIMP-1mRNA
各組細胞mRNA的A260/A280光密度比值為1.8~2.0,符合后續(xù)試驗要求。RT-qPCR結果顯示,與相應的對照組比較,2株細胞的試驗組STAT3,TIMP-1的mRNA表達明顯升高,不同IL-6濃度試驗組Raji細胞和OCI-LY8細胞之間STAT3 和TIMP-1的mRNA表達均有顯著差異(P<0.05),且2種基因mRNA表達都呈現(xiàn)出藥物濃度依賴關系(Raji細胞IL6與STAT3 r = 0.979,P = 0.021,IL-6與TIMP-1 r = 0.981,P = 0.019; OCILY8細胞IL6與STAT3 r = 0.996,P = 0.004,IL-6 與TIMP-1 r =0.973,P =0.027)。2株細胞TIMP-1與STAT3的mRNA表達呈正相關(r = 0.961、0.998,P =0.039、0.002)。見表2。
2.3 Raji細胞p-STAT3、STAT3及TIMP-1蛋白
與對照組比較,100 μg/L IL-6培養(yǎng)48 h時的Raji細胞p-STAT3及STAT3蛋白升高,P分別為0.026、0.001,見圖2。
2.4細胞周期
Raji細胞和OCI-LY8細胞G0/G1、S、G2-M各周期的細胞百分率差異有統(tǒng)計學意義(P =0.001、P =0.001、P =0.000)。與對照組相比,試驗組Raji和OCI-LY8細胞的G1期細胞都明顯減少(P = 0.031和P = 0.019),S期細胞明顯增多(P = 0.038和P = 0.034),G2-M期的Raji細胞無明顯變化(P = 0.63),G2-M期的OCI-LY8細胞則明顯增多(P =0.037)。見表3。
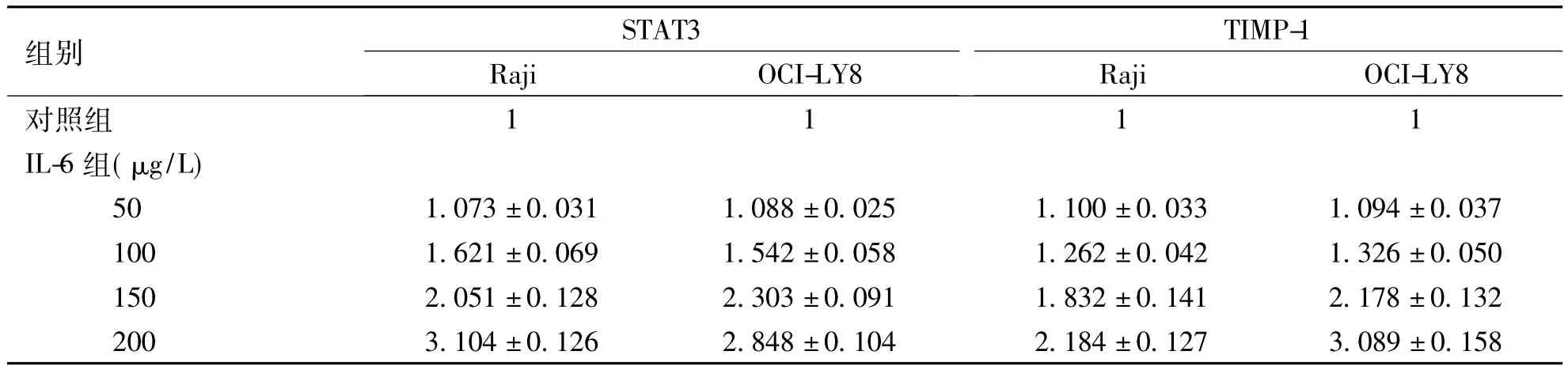
表2 不同濃度IL-6培養(yǎng)Raji和OCI-LY8細胞48 h時STAT3 mRNA及TIMP-1 mRNA水平Tab.2 The mRNA expressions of STAT3 and TIMP-1 in the Raji and OCI-LY8 cells treated with IL-6 for 48 h
表3 100 μg/L IL-6培養(yǎng)Raji和OCI-LY8細胞48 h時的細胞周期變化(±s)Tab.3 Propotion of the cell cycle in OCI-LY8 and the Raji cells cultured with 100 μg/L IL-6
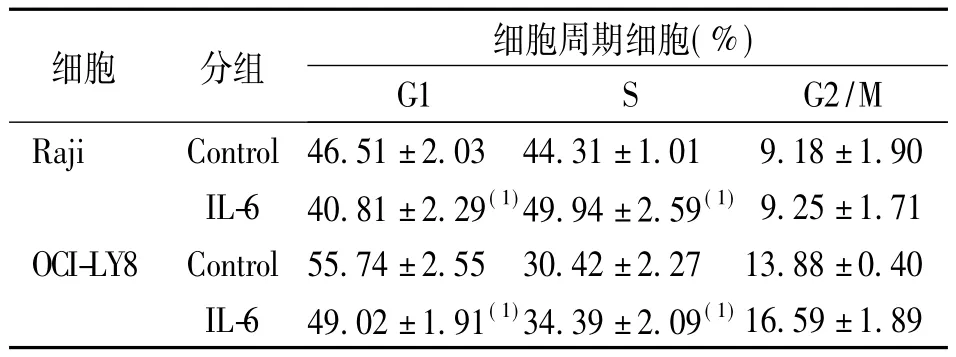
表3 100 μg/L IL-6培養(yǎng)Raji和OCI-LY8細胞48 h時的細胞周期變化(±s)Tab.3 Propotion of the cell cycle in OCI-LY8 and the Raji cells cultured with 100 μg/L IL-6
(1)與相應對照組比較,P<0.05
細胞 分組 細胞周期細胞(%) G1 S G2/M Raji Control 46.51±2.03 44.31±1.01 9.18±1 16.59±1.89 .90 IL-6 40.81±2.29(1)49.94±2.59(1)9.25±1.71 OCI-LY8 Control 55.74±2.55 30.42±2.27 13.88±0.40 IL-6 49.02±1.91(1)34.39±2.09(1)
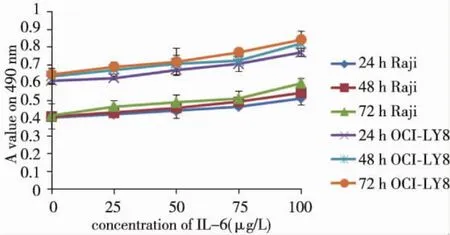
圖1 IL-6對Raji、OCI-LY8細胞生長的影響Fig.1 The effects of IL-6 at different concentrations for different times on the growth of the two kind of cells
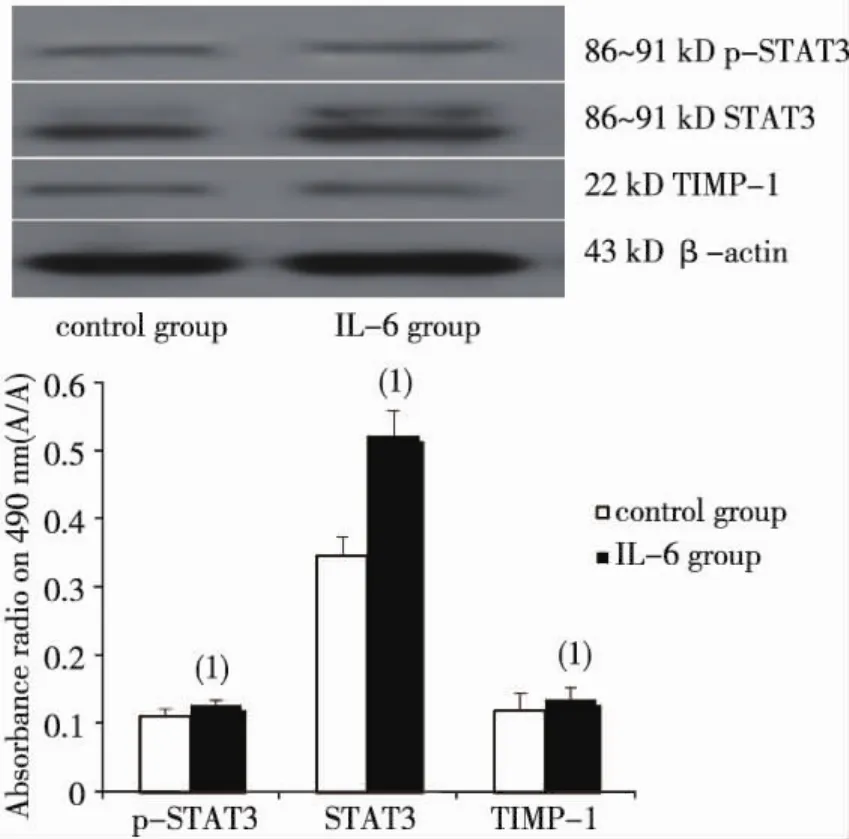
圖2 100 μg/L IL-6培養(yǎng)48 h時Raji細胞中STAT3、p-STAT3、TIMP-1蛋白表達Fig.2 The protein levels of STAT3,p-STAT3 and TIMP-1 in the Raji cells with 100 μg/L IL-6
3 討論
有研究發(fā)現(xiàn),JAK/STAT3信號轉(zhuǎn)導通路持續(xù)激活可導致細胞異常增殖或惡性轉(zhuǎn)化,該通路在侵襲性B細胞淋巴瘤侵襲及轉(zhuǎn)移過程中發(fā)揮重要作用[8-10]。用該通路的抑制劑可抑制STAT3在侵襲性惡性淋巴瘤細胞系中的活性。TIMP-1是基質(zhì)金屬蛋白酶組織抑制因子(tissue inhibitors of metalloproteinases,TIMPs)家族中的一員。TIMPS是一個多基因家族編碼蛋白基質(zhì)金屬蛋白酶(matrix metalloproteinase,MMPs)的內(nèi)源性特異性抑制因子。關于TIMP-1的研究,一方面認為它具有抗有絲分裂的活性,能促進內(nèi)皮細胞增生,能與基質(zhì)膠原酶、基質(zhì)分解素及明膠酶(主要是明膠酶B)形成可逆的復合物,通過抑制MMPs的活化及其對ECM的降解、抑制ECM中相關凋亡蛋白的釋放,發(fā)揮調(diào)節(jié)細胞凋亡及促進腫瘤細胞生長的功能[11]。還有研究認為,TIMP-1作為一種轉(zhuǎn)錄抑制劑抑制MMPs基因的轉(zhuǎn)錄;另一方面TIMP-1位于JAK/STAT信號通路的下游,其表達受JAK/STAT信號通路調(diào)控。后者可通過上調(diào)TIMP-1的表達而抑制大鼠腎小球系膜細胞凋亡[12]。近年來,在人紅白血病細胞研究中又發(fā)現(xiàn)TIMP-1和JAK/STAT存在雙向調(diào)控作用[13]。在肝的纖維化研究中發(fā)現(xiàn)敲除STAT3基因之后,CCl4導致的肝纖維化中TIMP-1的高表達消失[14]。同時有研究發(fā)現(xiàn),TIMP-1可以由淋巴瘤細胞自分泌或旁分泌產(chǎn)生,通過B細胞生長分化因子IL-10以及原癌基因bcl-xL來抑制細胞程序性死亡,從而延長正常扁桃體B細胞、Burkitt淋巴瘤細胞的壽命[15]。還有研究發(fā)現(xiàn)TIMP-1與非霍奇金淋巴瘤的臨床分級相關。
IL-6是IL-6/JAK信號通路的激活劑[16-17],激活JAK后可促進STAT3的表達及磷酸化,以磷酸化二聚體的形式進入細胞核,與下游凋亡及細胞周期調(diào)控基因、基質(zhì)金屬蛋白酶等靶基因的啟動子結合,調(diào)節(jié)腫瘤細胞的增殖凋亡和遷移等過程。本研究在培養(yǎng)的Raji和OCI-LY8細胞中分別加入不同濃度的IL-6后,發(fā)現(xiàn)細胞生長活力增強,呈現(xiàn)出藥物濃度依賴關系。2株細胞G1期均體現(xiàn)出減少的趨勢,S期細胞明顯增多,處于G2-M的Raji細胞無明顯改變,而OCI-ly8細胞明顯增多。這表明JAK/STAT3信號通路對Raji和OCI-LY8細胞的生長可能有明顯的影響。進一步探討IL-6影響2株細胞生長的相關分子機制,本研究檢測了細胞內(nèi)STAT3和TIMP-1的mRNA及蛋白表達情況。Raji細胞和OCI-LY8細胞內(nèi)STAT3基因的mRNA表達水平隨著IL-6濃度的增加而增高,TIMP-1和STAT3的mRNA表達呈正相關關系。在IL-6作用48 h后Raji細胞內(nèi)p-STAT3,STAT3和TIMP-1蛋白表達明顯升高,三者變化趨勢一致。提示IL-6作用下,TIMP-1蛋白的表達可能與STAT3的活化有關。
綜上,IL6能顯著促進淋巴瘤Raji及OCI-LY8細胞的生長,并促進細胞周期的運行。其作用可能與細胞內(nèi)STAT3分子活化有關,細胞內(nèi)TIMP-1的上調(diào)表達也可能是IL-6活化STAT3的結果。2種細胞內(nèi)STAT3的活化及其引起的TIMP-1的表達上調(diào)可能是IL-6影響淋巴瘤細胞生長的重要機制,這可能是Burkitt和DLBCL淋巴瘤治療的新思路。
4 參考文獻
[1]Morikawa T,Baba Y,Yamauchi M,et al.STAT3 expression,molecular features,inflammation patterns,and prognosis in a database of 724 colorectal cancers[J].Clin Cancer Res,2011(6) : 1452-1462.
[2]Grivennikov S,Karin E,Terzic J,et al.IL-6 and STAT3 are required for survival of intestinal epithelial cells and development of colitis-associated cancer[J].Cancer Cell,2009(2) : 103-113.
[3]Berishaj M,Gao SP,Ahmed S,et al.STAT3 is tyrosinephosphorylated through the interleukin-6/glycoprotein 130/Janus kinase pathway in breast cancer[J].Breast Cancer Res,2007(3) : R32.
[4]Kim DY,Cha ST,Ahn DH,et al.STAT3 expression in gastric cancer indicates a poor prognosis[J].J Gastroenterol Hepatol,2009(4) : 646-651.
[5]侯嘉杰,孫倍成.STAT3:慢性炎癥介導腫瘤發(fā)生和進展的關鍵節(jié)點[J].生物化學與生物物理進展,2014 (1) : 69-78.
[6]Soldini D,Montagna C,Schüffler P,et al.A new diagnostic algorithm for Burkitt and diffuse large B-cell lymphomas based on the expression of CSE1L and STAT3 and on MYC rearrangement predicts outcome[J].Ann Oncol,2013(1) : 193-201.
[7]Mizowaki T,Sasayama T,Tanaka K,et al.STAT3 activation is associated with cerebrospinal fluid interleukin-10 (IL-10) in primary central nervous system diffuse large B cell lymphoma[J].Journal of neuro-oncology,2015(2) : 165-74.
[8]Al Zaid Siddiquee K,Turkson J.STAT3 as a target for inducing apoptosis in solid and hematological tumors[J].Cell Res,2008(2) : 254-67.
[9]Siveen KS,Sikka S,Surana R,et al.Targeting the STAT3 signaling pathway in cancer: role of synthetic and natural inhibitors[J].Biochim Biophys Acta,2014(2) : 136-154.
[10]Lam LT,Wright G,Davis RE,et al.Cooperative signaling through the signal transducer and activator of transcription 3 and nuclear factor-κB pathways in subtypes of diffuse large B-cell lymphoma[J].Blood,2008 (7) : 3701-3713.
[11]Udayakumar TS,Stratton MS,Nagle RB,et al.Fibroblast growth factor-1 induced promatrilysin expression through the activation of extracellular-regulate kinases and STAT3[J].Neoplasia,2002(4) : 60-67.
[12]溫文斌,林洪麗,吳泰華,等.JAK/STAT通路在金屬蛋白酶1組織抑制劑抑制腎小球系膜細胞凋亡中的作用[J].中華腎臟病雜志,2008(1) : 24-29.
[13]Lambert E,Boudot C,Kadri Z,et al.Tissue inhibitor of metalloproteinases-1 signalling pathway leading to erythroid cell survival[J].Biochem J,2003 (3) : 767-774.
[14]Wang H,Lafdil F,Wang L,et al.Tissue inhibitor of metalloproteinase 1 (TIMP-1) deficiency exacerbates carbon tetrachloride-induced liver injury and fibrosis in mice: involvement of hepatocyte STAT3 in TIMP-1 production[J].Cell&bioscience,2011(1) : 14.
[15]樊嶸,金冶寧.TIMP-1在乳腺癌中的作用機制和臨床意義[J].現(xiàn)代腫瘤醫(yī)學,2009(1) : 154-158.
[16]Garbers C,Aparicio-Siegmund S,Rose-John S.The IL-6/gp130/STAT3 signaling axis: recent advances towards specific inhibition[J].Curr Opin Immunol,2015 (34C) : 75-82.
[17]Munoz J,Dhillon N,Janku F,et al.STAT3 inhibitors: finding a home in lymphoma and leukemia[J].Oncologist,2014(5) : 536-544.
(2015-12-20收稿,2015-12-31修回)
中文編輯:戚璐;英文編輯:趙毅
Molecular Mechanism of IL-6 Effect on the Growth of Two Lymphoma Cells
YANG Wenxiu,LI Pinhao,CHEN Qin,PEI Yuanyuan
(Department of Pathology,Guizhou Medical University,Guiyang 550004,Guizhou,China)
[Abstract]Objective: To observe the effects of IL-6 (interleukin-6) on the growth of Burkitt lymphoma (BL) cell line Raji and Diffuse large B cell lymphoma (DLBCL) cell line OCI-LY8,and to investigate their effect on cellular growth and the relationship between changes of STAT3 (single transducer and transcription activater-3) and TIMP-1 (tissue inhibitors of metalloproteinase-1) expression.
[Key words]lymphoma,B cell; Burkitt lymphoma; cell culture; single transducer and transcription activator-3; tissue inhibitors of metalloproteinase-1; interleukin-6
*[基金項目]國家自然科學基金(No.81160299) ;貴州省優(yōu)秀人才省長基金(No.2011.125)
[中圖分類號]R559; R34
[文獻標識碼]A
[文章編號]1000-2707(2016) 02-0125-05
Methods: Raji and OCI-LY8 cells were cultured by varied concentration of IL-6(0 g/L,50 g/L,100 g/L,150 g/L and 200 g/L) for 24 h,48 h and 72 h.Viability of 2 strains of cells was measured by MTT.The mRNA expressions of STAT3 and TIMP-1 of 2 strains of cells were detected by RT-PCR,and p-STAT3,STAT3 and TIMP-1 protein expression of Raji cell cultivated by 100 g/L IL-6 for 48 h were detected by Western blotting.Cell cycle was examined by flow cytometry.Results: Comparing with control group,OD value at 490 nm decreased the two strain of cells treated by varied concentration of IL-6.It was presented concentration-dependence relationship(P<0.01) ; mRNA expressions of STAT3 and TIMP-1 in both cells exhibited positive correlation (r = 0.982,P = 0.018) ; protein expression of p-STAT3,STAT3 and TIMP-1 of Raji cells in IL-6 groups increased.Cells were distinctly reduced at phase G1 and increased at phase S in two types of cell of IL-6(P<0.05).The Raji cell atphase G2-M showed no significant change while OCI-LY8 cells increased significantly(P = 0.037).Conclusions: IL-6 has an obvious effect on the growth of Raji and OCI-LY8 cell.The activation of STAT3 and up-regulated expression of TIMP-1 might be important molecular mechanism for promoting the viability of Burkitt and DLBCL cell.

