利拉魯肽聯合替米沙坦對早期糖尿病腎病患者血中TNF-α、IL-6及TGF-β1水平的影響*
楊冉 王韞芳 張維
利拉魯肽聯合替米沙坦對早期糖尿病腎病患者血中TNF-α、IL-6及TGF-β1水平的影響*
楊冉1王韞芳1張維2
(1.冀中能源峰峰集團總醫院北院區腎內二科, 河北 邯鄲 056001;2.成都醫學院第一附屬醫院, 成都 四川 610500)
目的 探討人胰高血糖素樣肽-1 (GLP-1)類似物利拉魯肽聯合小劑量血管緊張素Ⅱ (ANG Ⅱ) AT1受體拮抗劑替米沙坦,對早期糖尿病腎病患者生化指標及血中炎癥介質TNF-α、IL-6及TGF-β1水平的影響。 方法 將200例符合診斷標準的早期糖尿病腎病患者隨機平均分為2組,即利拉魯肽+替米沙坦組和替米沙坦組(n=100)。分別對治療前與治療10周后患者生化指標包括糖化血紅蛋白(HbA1c)、24小時尿白蛋白排泄率(UAER)、血肌酐(Cr)和血尿素(UA),以及血中TNF-α、IL-6和TGF-β1水平進行檢測。結果 經10周治療后2組患者UAER、Cr和UA以及血中炎癥介質TNF-α、IL-6和TGF-β1水平均較治療前均有顯著改善,差異均有計學意義(P均<0.05)。同時發現利拉魯肽+替米沙坦組較替米沙坦組改善更加顯著,差異均有統計學意義(P均<0.05)。治療前與治療后替米沙坦組患者HbA1c變化未見統計學差異(P>0.05)。而利拉魯肽+替米沙坦組患者HbA1c在治療10周后較治療前有顯著下降,差異有統計學意義(P<0.05)。結論 人胰高血糖素樣肽-1 (GLP-1)擬似物利拉魯肽聯合小劑量血管緊張素Ⅱ (ANG Ⅱ) AT1受體拮抗劑替米沙坦和單用小劑量替米沙坦均可有效改善糖尿病腎病患者的生化指標以及與糖尿病腎病相關的炎癥反應,且使用利拉魯肽聯合小劑量替米沙坦治療的患者改善更加顯著。該結果表明進一步加強血糖控制可以有效延緩糖尿病腎病的發展;同時也表明利拉魯肽可能可以通過獨立于降糖外的其他機制直接改善了糖尿病腎病相關的炎癥反應,但仍需大樣本的臨床研究進一步的證實其價值。
糖尿病腎病; 利拉魯肽; 替米沙坦
流行病學調查研究表明目前全球糖尿病(diabetes mellitus, DM)發病人數約為2.4億至3.0億人之間,同時根據世界衛生組織(world health organization, WHO)數據顯示糖尿病患者的患病率約以每年10%的速度遞增[1-6]。同時,研究表明糖尿病腎病(diabetic nephropathy, DN)是糖尿病最重要的并發癥之一,亦為最重要的死亡原因[1-6]。據WHO的數據分析至2030年糖尿病腎病的患病率將達到4.4%,患病總人數將有可能達到3.66億人[1-6]。基礎研究證實高糖代謝產生的終末糖基化產物(advanced glycation end products, AGE)是誘導糖尿病腎病發生和發展的根本原因,抑制AGE誘導的腎小球炎癥反應是治療的根本[7, 8]。目前研究顯示胰高血糖素樣肽-1 (glucagon-like peptide-1, GLP-1)擬似物具有促進胰腺β細胞分泌胰島素的作用,同時還具有抑制炎癥反應和器官保護等多種藥理學活性[9, 10]。Yi B等的研究發現在高糖狀態下GLP-1擬似物艾塞那肽(exendin-4)可以通過抑制AGE受體(receptor for advanced glycation end products, RAGE)的表達對心肌細胞產生保護作用[11]。本臨床研究的目的是觀察人胰高血糖素樣肽-1 (GLP-1)類似物利拉魯肽(liraglutide)聯合小劑量血管緊張素Ⅱ (ANG Ⅱ) AT1受體拮抗劑替米沙坦(telmisartan)對早期糖尿病腎病患者生化指標及血中炎癥介質TNF-α、IL-6及TGF-β1水平的影響。
1 病例診斷與排除標準
1.1 診斷標準 糖尿病的診斷標準和分型參照2010年WHO關于糖尿病的診斷標準[12]。同時參照國際糖尿病腎病診斷分期標準即糖尿病患者3個月內尿檢查連續2次尿白蛋白排泄率(UAE)穩定在20至200 μg/min (UAE為30至300 mg/24h)范圍內,并排除原發性高血壓、心力衰竭、泌尿系感染和酮癥酸中毒等引起尿白蛋白增加的因素[12]。
1.2 排除標準 排除標準包括:年齡小于30歲和大于70歲者;有嚴重糖尿病急性并發癥包括糖尿病酮癥酸中毒、高滲性昏迷和嚴重感染者;不愿意參加和不合作者(包括不按規定配合控制飲食及不按規定用藥和進行指標檢查者);心、肝和腦等臟器有嚴重器質性病變者;患有其他嚴重疾病者(包括惡性腫瘤、1年以內的心肌梗死、嚴重精神疾病、慢性乙醇中毒及重金屬中毒者等);孕婦及哺乳期婦女。
2 方法
2.1 干預方法 選取我院2012年05至2015年03月的DN 患者200例,研究前血糖均已控制在10 mmol/L以下且均為在三個月內未有使用DPP-4抑制劑或GLP-1擬似物治療的用藥史,凡血壓超過135/85mmHg者給予抗降壓藥治療(用鈣離子拮抗劑,均未在三個月內使用ACEI或ARB治療的歷史),控制血壓小于135/85mmHg。利拉魯肽+替米沙坦組(治療組) 100例患者,其中男45例,女55例,年齡(66.8±14.7)歲,在降血糖和控制血壓治療的基礎上加用小劑量替米沙坦(telmisartan美卡素,德國勃林格殷格翰,國藥準字J20090089,40 mg/天,每日1次)和利拉魯肽(liraglutide諾和力,諾和諾德(中國)制藥有限公司,國藥準字J20110026,第一周起始劑量0.6 mg/次,每日1次;第二周起1.2 mg/次,每日1次),共10 周。替米沙坦組(對照組)100例,其中男48例,女52例;年齡(67.4±13.5)歲,給予小劑量替米沙坦治療。兩組間年齡和性別等經統計學處理,差異無顯著性,具有可比性(P均>0.05)。干預過程中2組患者未見明顯的不良反應。
2.2 血液生化指標 在干預前和干預10周后分別留取空腹靜脈血。分別對糖化血紅蛋白(HbA1c)、24小時尿白蛋白排泄率(UAER)、血肌酐(Cr)和血尿素(UA)進行測定。
2.3 血中炎癥介質TNF-α、IL-6及TGF-β1 取患者治療前與治療10周后清晨空腹靜脈血。根據ELISA試劑盒(R&D Systems, USA)說明書方法,對血中炎癥介質TNF-α、IL-6及TGF-β1水平進行檢測。
2.4 統計學分析 應用SPSS 11.0統計軟件進行分析,計量資料用t檢驗,P<0.05為差異有統計學意義。
3 結果
3.1 生化指標比較 經10周治療后,兩組患者24h UAER、Cr和UA均較治療前有顯著降低,差異均有統計學意義(P<0.05)。替米沙坦組HbA1c與治療前比較未見差異(P>0.05)。與替米沙坦組比較,利拉魯肽+替米沙坦組HbA1c、24h UAER、Cr和UA降低更明顯,差異均有統計學意義(P<0.05),見表1。
3.2 血中炎癥介質TNF-α、IL-6和TGF-β1比較 經過10周的治療后,2組患者血中炎癥介質TNF-α、IL-6和TGF-β1水平均較治療前有顯著降低,差異均有統計學意義(P<0.05)。與替米沙坦組相比較,利拉魯肽+替米沙坦組血中炎癥介質TNF-α、IL-6和TGF-β1水平下降更明顯,差異有統計學意義(P<0.05),見表2。
4 討論
據流行病學調查發現糖尿病腎病(diabetic nephropathy, DN)已成為導致慢性腎臟病(chronic kidney disease, CKD)最重要的病因之一,同時發現糖尿病腎病亦成為糖尿病最常見的并發癥(累計率高達30%~35%)和致死因素[1-5]。吳云濤等的流調顯示我國糖尿病腎病約占終末期腎功能衰竭(end-stage renal disease, ESRD)的15%左右,并有逐年增加的趨勢。故研究和開發新的預防和治療糖尿病腎病的藥物將會具有重要的價值和意義[15]。
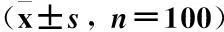
表1 生化指標比較
注:①與治療前相比較P<0.05;②與替米沙坦治療組相比較P<0.05
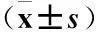
表2 血中TNF-α、IL-6和TGF-β1水平
注:①與治療前相比較P<0.05;②與替米沙坦治療組相比較P<0.05
目前研究發現高血糖(hyperglycemia)狀態誘導產生的的終末糖基化產物(AGE)通過其受體(RAGE)誘導的腎小球系膜細胞激活、腎小球足細胞和血管內皮細胞損傷及相關的腎小球異常的炎癥反應是導致糖尿病腎病的根本原因[7,8]。隨著病情的發展過度激活的系膜細胞將合成并分泌大量膠原纖維和層粘連蛋白等細胞外基質(ECM)最終導致腎小球硬化的發生,故糖尿病腎病又稱為糖尿病腎小球硬化癥(diabetic glomerulosclerosis),其主要的特征性病理學改變為腎小球系膜基質重度增生導致的結節狀硬化,由于該結節在PASM染色下呈同心圓排列,故稱為KW結節。KW結節的出現對于糖尿病腎病的病理診斷具有重要的診斷價值[7,8,16]。進一步的研究表明糖尿病時腎臟組織局部的腎素血管緊張素系統(renin-angiotensin system, RAS)過度的激活亦在糖尿病腎病的發生和發展過程中扮演著重要的角色[17]。目前血管緊張素轉化酶抑制劑(angiotensin converting enzyme inhibitors, ACEI)和血管緊張素Ⅱ (ANG Ⅱ) AT1受體拮抗劑已成為糖尿病腎病的重要治療藥物[17]。
胰高血糖素樣肽-1 (glucagon-like peptide-1, GLP-1)是一種腸道L-細胞合成和分泌的肽類樣激素。研究發現GLP-1通過其受體GLP-1R發揮生理學效應,GLP-1主要由二肽基肽酶IV (DPP-4)分解代謝[18]。當GLP-1與胰腺β細胞表面的GLP-1R結合后通過活化cAMP/PKA信號通路一方面誘導細胞膜KATP通道失活導致細胞出極化,另一方面使Ca2+通道開放導致Ca2+內流促進胰島素囊泡的胞吐過程,同時近期研究顯示GLP-1還可以直接誘導β細胞胰島素的合成[18-20]。目前GLP-1擬似物如利拉魯肽和艾塞那肽以及DPP-4抑制劑包括沙格列汀和西格列汀已廣泛應用于2型糖尿病的臨床治療。近來大量研究還發現GLP-1R在腎臟、心臟、神經和肺組織等胰腺外器官均有廣泛的表達[18-20]。Chang MW等人的研究發現西格列汀可以通過抑制MMP-9和TNF-α等炎癥介質以及NOX-1和NOX-2等活性氧化產物的合成和釋放有效減輕缺血-再灌注(ischemia-reperfusion, IR)誘導的大鼠腎功能損傷[19]。Kodera R等的研究還證實DPP-4抑制劑PKF275-055可以通過抑制NF-κB信號通路有效抑制糖尿病模型大鼠腎臟組織的病理改變[20]。此外,陳攀等人在一項糖尿病腎病的臨床觀察研究中顯示DPP-4抑制劑沙格列汀對于早期糖尿病腎病的治療和炎癥水平控制具有積極的價值和意義[12]。在本臨床研究中我們對患者的生化指標進行分析后發現經過10周的治療后,2組患者24h UAER、Cr和UA均較治療前有顯著降低 (P均<0.05)。替米沙坦組HbA1c與治療前比較未見差異(P>0.05)。與替米沙坦組相比較,利拉魯肽+替米沙坦組HbA1c、24h UAER、Cr和UA降低更明顯。該結果首先表明利拉魯肽有助于糖尿病患者的血糖控制,同時亦提示小劑量替米沙坦和利拉魯肽對早期糖尿病腎病患者腎小球均具有保護作用,且替米沙坦和利拉魯肽具有協同作用。同時,我們對糖尿病腎病導致的腎小球炎癥反應相關的炎癥介質TNF-α、IL-6和TGF-β1的表達水平進行了分析,結果表明利拉魯肽和替米沙坦均對糖尿病腎病導致的腎小球炎癥反應有顯著的抑制作用,且替米沙坦和利拉魯肽具有協同效應。
5 結論
人胰高血糖素樣肽-1 (GLP-1)擬似物利拉魯肽聯合小劑量血管緊張素Ⅱ (ANG Ⅱ) AT1受體拮抗劑替米沙坦和單用小劑量替米沙坦均可有效改善糖尿病腎病患者的生化指標,以及與糖尿病腎病相關的炎癥反應,利拉魯肽與小劑量替米沙坦治療具有協同效應。同時亦提示進一步加強血糖控制可以有效延緩糖尿病腎病的進展,且利拉魯肽可以通過獨立于降糖外的其他機制直接改善了糖尿病腎病相關的炎癥反應,且尚需大樣本的臨床研究證實其價值。
[1]姜軼. 黃芪聯合替米沙坦治療Ⅲ期糖尿病腎病的臨床觀察[J]. 西部醫學, 2010, 22(07): 1248-1249, 1252.
[2]Martínez-Castelao A, Navarro-González JF, Górriz JL,etal. The Concept and the Epidemiology of Diabetic Nephropathy Have Changed in Recent Years [J]. J Clin Med, 2015, 4(6): 1207-1216.
[3]Pasko N, Toti F, Strakosha A,etal. Prevalence of microalbuminuria and risk factor analysis in type 2 diabetes patients in Albania: the need for accurate and early diagnosis of diabetic nephropathy [J]. Hippokratia, 2013, 17(4): 337-341.
[4]王俊峰, 李宏輝, 林強. 纈沙坦聯合百令膠囊對老年糖尿病腎病尿微量白蛋白的影響[J]. 西部醫學, 2010, 22(09): 1698-1699.
[5]Lai X, Zhang AH, Chen SY,etal. Outcomes of stage 1-5 chronic kidney disease in Mainland China [J]. Ren Fail, 2014, 36(4): 520-525.
[6]郄會卿, 吳亞, 程麗娜, 等. 厄貝沙坦干預對糖尿病腎病大鼠IL-6和CRP水平的影響[J]. 西部醫學, 2010, 22(11): 1986-1987, 1991.
[7]Hagiwara S, McClelland A, Kantharidis P. MicroRNA in diabetic nephropathy: renin angiotensin, aGE/RAGE, and oxidative stress pathway [J]. J Diabetes Res, 2013, 2013: 173783.
[8]Tan AL, Forbes JM, Cooper ME. AGE, RAGE, and ROS in diabetic nephropathy [J]. Semin Nephrol, 2007, 27(2):130-143.
[9]Carris NW, Taylor JR, Gums JG. Combining a GLP-1 receptor agonist and basal insulin: study evidence and practical considerations [J]. Drugs, 2014, 74(18): 2141-2152.
[10] Prasad-Reddy L, Isaacs D. A clinical review of GLP-1 receptor agonists: efficacy and safety in diabetes and beyond [J]. Drugs Context, 2015, 4: 212283.
[11] Yi B, Hu X, Wen Z,etal. Exendin-4, a glucagon-like peptide-1 receptor agonist, inhibits hyperglycemia-induced apoptosis in myocytes by suppressing receptor for advanced glycation end products expression [J]. Exp Ther Med, 2014, 8(4): 1185-1190.
[12] 陳攀, 黃濤. 沙格列汀聯合小劑量厄貝沙坦對50例早期糖尿病腎病患者血中TNF-α、CRP、IL-6及TGF-β1水平的影響[J]. 華西藥學雜志, 2013, 28(04): 439-440.
[13] Justyna Siwy, Joost P. Schanstra, Angel Argiles,etal. Multicentre prospective validation of a urinary peptidome-based classifier for the diagnosis of type 2 diabetic nephropathy [J]. Nephrol Dial Transplant, 2014, 29(8): 1563-1570.
[14] Ghaderian SB, Hayati F, Shayanpour S,etal. Diabetes and end-stage renal disease; a review article on new concepts [J]. J Renal Inj Prev, 2015, 4(2): 28-33.
[15] 吳云濤, 劉亞男, 吳壽嶺, 等. 不同危險分層對糖尿病患者臨床終點事件的影響[J]. 中華流行病學雜志. 2012; 33(01): 88-91.
[16] 楊岳, 謝席勝, 馮勝剛, 等. 厄貝沙坦對糖尿病大鼠腎臟足細胞保護作用的研究[J]. 西部醫學, 2012, 24(02): 214-217.
[17] Yacoub R, Campbell KN. Inhibition of RAS in diabetic nephropathy [J]. Int J Nephrol Renovasc Dis, 2015, 8: 29-40.
[18] Zhu T, Wu XL, Zhang W,etal. Glucagon Like Peptide-1 (GLP-1) Modulates OVA-Induced Airway Inflammation and Mucus Secretion Involving a Protein Kinase A (PKA)-Dependent Nuclear Factor-κB (NF-κB) Signaling Pathway in Mice [J]. Int J Mol Sci, 2015, 16(9): 20195-20211.
[19] Chang MW, Chen CH, Chen YC,etal. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors [J]. Acta Pharmacol Sin, 2015, 36(1): 119-130.
[20] Kodera R, Shikata K, Takatsuka T,etal. Dipeptidyl peptidase-4 inhibitor ameliorates early renal injury through its anti-inflammatory action in a rat model of type 1 diabetes [J]. Biochem Biophys Res Commun, 2014, 443(3): 828-833.
Liraglutide combined with low dosage telmisartan decreases the serum levels of TNF-α, IL-6 and TGF-β1 in patients with early diabetic nephropathy
YANG Ran1, WANG Yunfang1, ZHANG Wei2
(1.TheSecondDepartmentofNephrology,JizhongEnergyFengfengGroupHospital,Handan056001,Hebei,China;2.TheFirstAffiliatedHospitalofChengduMedicalCollage,Chengdu610500,China)
Objective To explore the value of glucagon like peptide-1 (GLP-1) analog liraglutide combined with low dosage telmisartan on biochemical indicators and the serum levels of TNF-α, IL-6 and TGF-β1 in patients with early diabetic nephropathy. Methods 200 patients with early diabetic nephropathy with chosen standards were randomly divided into liraglutide combined with low dosage telmisartan treatment group (treatment group) and low dosage telmisartan treatment group (control group). Before and after 10 weeks interventions, HbA1c, UAER, CR, UA and the serum levels of TNF-α, IL-6 and TGF-β1 were analyzed.Results After 10 weeks interventions, UAER, CR, UA and the serum levels of TNF-α, IL-6 and TGF-β1 were noticeably improved in two groups (P<0.05 in all). Moreover, the improvements in treatment group were more significant than that in control group (P<0.05 in all). Then, our results also figured out that no difference on HbA1c was found in control group after 10 weeks treatments (P>0.05). Nevertheless, the level of HbA1c in treatment group was remarkably reduced after 10 weeks treatments (P<0.05). Conclusion Glucagon like peptide-1 (GLP-1) analog liraglutide combined with low dosage AT1R blocker telmisartan is a safe and effective method for the treatment of patients with early diabetic nephropathy in clinic practice.
Diabetic nephropathy; Liraglutide; Telmisartan
四川省教育廳課題(11ZB172)
R 587.2
A
10.3969/j.issn.1672-3511.2016.02.013
2015-10-08; 編輯: 張翰林)

