茶樹β-葡萄糖苷酶研究進展
周漢琛,雷攀登,丁勇安徽省農業科學院茶葉研究所,安徽 黃山 245000
?
茶樹β-葡萄糖苷酶研究進展
周漢琛,雷攀登,丁勇*
安徽省農業科學院茶葉研究所,安徽 黃山 245000
摘要:茶樹體內的各種物質代謝、能量傳遞以及生長發育等都必須有酶的參與,而且酶對茶葉品質的形成具有重要意義。β-葡萄糖苷酶能夠催化茶樹糖苷類香氣前體的水解反應,產生的茶樹香氣物質不僅參與茶樹對病蟲害的防御反應,還是茶葉重要的物質基礎。茶樹β-葡萄糖苷酶基因在表達部位、亞細胞定位、蛋白結構及系統發育進化等生物信息學方面,與擬南芥、水稻、玉米等植物的β-葡萄糖苷酶基因家族都存在相似性。在非生物和生物逆境脅迫下,茶樹β-葡萄糖苷酶基因表達在逆境初期均呈現上調。本文將主要圍繞茶樹β-葡萄糖苷酶基因生物信息學及基因表達等研究現狀,結合β-葡萄糖苷酶在茶葉加工中的變化作一概述。
關鍵詞:茶樹;β-葡萄糖苷酶;生物信息學;基因表達
茶樹(Camellia sinensis)是我國重要的經濟作物,起源于我國的云貴高原,為多年生常綠葉用植物。茶是世界上三大消費量最大的飲料之一,并被譽為21世紀的飲料之王[1]。茶樹中含有多種對人體有益的天然活性成分,如茶多酚、茶氨酸、芳香物質等,其中,茶多酚已經被證實可以抑制癌細胞,提高人體免疫力[2-3],而茶樹中的芳香物質具有調節精神狀態、抗菌、消炎等作用。目前,研究學者在茶樹基因組、茶葉加工過程代謝譜、茶葉品質化學等領域開展了深入研究,并取得了一些突破性進展[4]。
β-葡萄糖苷酶(β-glucosidase)是糖基水解酶家族Ⅰ(Glycosyl hydrolase family I)的成員,能夠通過催化β-糖苷鍵化合物的水解釋放,參與到植物的新陳代謝中,來調節植物的生長發育[5]。擬南芥β-葡萄糖苷酶BGLU10可以催化ABA-GE(ABA glucose ester)釋放出游離態的ABA,來增強植物對干旱、鹽害的耐受力[6]。在煙草中異源表達的β-葡萄糖苷酶基因bglA,可以作用于GSA(Glucosylsalicylic acid)來提高游離態水楊酸(Salicylic acid,SA)的水平,在TMV(Tobacco Mosaic Virus)侵染煙草后減少煙草損害程度[7]。目前,茶樹β-葡萄糖苷酶基因的克隆、鑒定以及基因表達等研究已有一定基礎,其中,在表達部位、蛋白結構等生物信息學方面,與擬南芥、水稻、玉米等植物的β-葡萄糖苷酶基因家族都存在相似性。在茶葉加工過程中,β-葡萄糖苷酶能夠促進糖苷類香氣前體的轉化,對成茶有增香作用。已有學者對茶樹β-葡萄糖苷酶的基礎研究、在茶葉加工過程中的研究、與茶增香及抗病蟲害的研究等作了相關綜述[8-11]。另外,近年來生物信息學對基因功能的預測越來越重要,而本文將主要著眼于近年來茶樹β-葡萄糖苷酶基因結構、定位及基因表達方面的研究現狀。
1 β-葡萄糖苷酶的特性
β-葡萄糖苷酶屬于水解酶類,多以單體酶或二聚體形式存在,可以催化含有β-糖苷鍵化合物的水解反應[12],如水解纖維二糖(Cellobiose)生成葡萄糖(圖1-A),或催化β-葡萄糖苷類物質釋放出糖苷配基(圖1-B)。在茶樹中,β-葡萄糖苷是許多香氣前體的存在形式,而β-葡萄糖苷酶可以促使這些香氣前體釋放,生成香氣物質[13-14]。植物β-葡萄糖苷酶存在許多同工酶,它們發揮著相同的水解作用,但所水解的底物卻不盡相同,如高粱β-葡萄糖苷酶基因SbDhr1具有底物專一性,只水解天然的蜀黍苷(Dhurrin)[15]。張正竹等[16]從茶樹鮮葉中分離出的兩個β-葡萄糖苷酶單體酶,不僅可以水解以β-D-葡萄糖苷形式存在的順-3-己烯醇和苯甲醇,還可以水解以苯乙腈的β-D-葡萄糖苷為前體存在的苯甲醛。
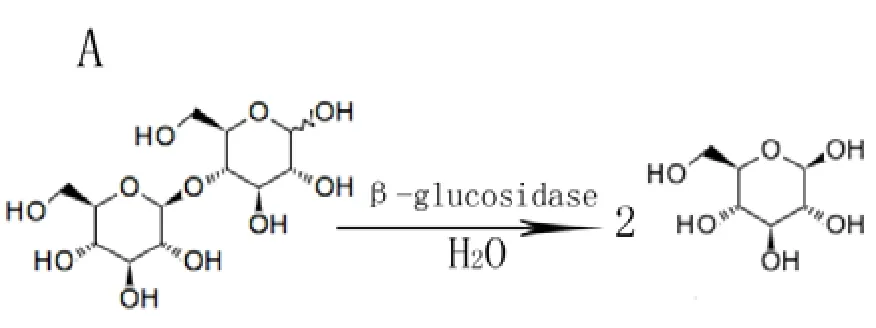
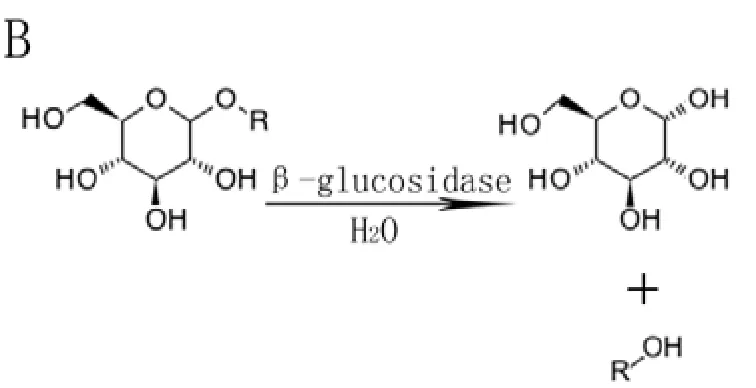
圖1 β-葡萄糖苷酶的酶促水解方式Fig.1 The hydrolysis pattern of β-Glucosidase
β-葡萄糖苷酶作用的β-糖苷鍵位置也有不同,如水稻β-葡萄糖苷酶基因Os4bglu12可以水解β-1,3鍵連接的昆布二糖(Laminaribiose),也可以水解β-1,4鍵連接的聚合度為3~6的低聚糖,但是卻不能水解β-1,4鍵連接的纖維二糖和β-1,6鍵連接的龍膽二糖(Gentiobiose)[17]。報道稱在土耳其茶樹品種中純化出兩個β-葡萄糖苷酶同工酶,可以水解β-1,4鍵連接的人工合成底物對硝基苯-β-D-吡喃葡萄糖苷[18]。由于β-葡萄糖苷酶具有的這些特殊性,使它在許多水解反應中成為限制因素,如Rodrigues 等[19]在綠色植物小球藻中分析內切葡聚糖酶與β-葡萄糖苷酶的協同水解作用,研究發現β-葡萄糖苷酶含量與水解生成的生物量成正比;內切葡聚糖酶含量不會限制水解速率,而β-葡萄糖苷酶含量是影響水解速率的決定因素。
2 茶樹β-葡萄糖苷酶基因的定位、結構與系統發育分析
2.1 苷酶基因的定位
Opassiri等[20]在水稻中鑒定出34個β-葡萄糖苷酶基因(OsBGLU),組織器官表達定位中,不同的OsBGLU表達部位不同,Northern雜交印記顯示Os3bglu7和Os9bglu30在幼苗嫩枝上都有高量表達,但是Os3bglu7在花中有表達,Os9bglu30卻沒有[17]。李遠華等[21]采用原位雜交技術對茶樹β-葡萄糖苷酶基因mRNA的表達進行了研究,結果表明β-葡萄糖苷酶基因mRNA主要在茶樹葉片柵欄組織、葉主脈的薄壁組織表達。擬南芥的47個β-葡萄糖苷酶基因(AtBGLU)分別在發芽的種子、葉片、花瓣、下胚軸等組織器官中表達[22]。在亞細胞定位中,Gómez-Anduro等[23]在自交系玉米B73中鑒定出的26個β-葡萄糖苷酶基因(ZmBGLU)分別被定位于質體、線粒體、細胞質和液泡中。擬南芥β-葡萄糖苷酶基因AtBGLU15亞細胞定位在細胞壁中[24],而AtBGLU37和AtBGLU38則被定位于液泡中[25]。茶樹β-葡萄糖苷酶基因mNRA在茶樹葉片柵欄組織細胞核中表達信號強,且在部分細胞質中也有表達信號[26]。目前,GENBANK中登錄的茶樹β-葡萄糖苷酶基因核苷酸序列有4個,其中HQ679938.2與AM285295.2登錄有氨基酸序列(表1)。茶樹β-葡萄糖苷酶基因CAK97604.2氨基酸序列WoLFPSORT亞細胞定位預測結果表明,它可能被定位于液泡、內質網或者葉綠體。
2.2 基因的結構
擬南芥β-葡萄糖苷酶基因的成熟多肽鏈長度大多為474~592個氨基酸,分子量為53~68 kD。Opassiri等預測OsBGLU前體編碼458~647個氨基酸,分子量為55.3~73.2 kD;預測成熟的OsBGLU與AtBGLU編碼的氨基酸數量相似。費月[27]鑒定出的兩個茶樹β-葡萄糖苷酶基因GluⅠ和GluⅡ分別編碼632和629個氨基酸,分子量為69.15 kD和68.87 kD。茶樹β-葡萄糖苷酶基因(登錄號:AF537127.1)編碼450個氨基酸,原核誘導表達的成熟蛋白分子量為37 kD,其氨基酸序列預測功能結構域有:4個N-豆蔻酰化位點、5個蛋白激酶C的磷酸化位點、2個酪蛋白激酶Ⅱ磷酸化位點以及5個N-糖基化位點,同時預測其二級結構可以形成14.33%的α-螺旋和25.43%的β-折疊 。AtBGLU中除了AtBGLU25和AtBGLU27外,都具有1~5個N-糖基化位點。ZmBGLU1-6都有1個質體靶向序列(Plastid targeting sequence),且除了ZmBGLU5和ZmBGLU7外,都至少含有一個N-糖基化位點。糖基化的結果中就有可以使酶類暫時失活而有利于保存[28]。植物β-葡萄糖苷酶蛋白質序列中大多都含有N-糖基化位點,這可能是其在植物中的代謝機制之一。
ZmBGLU基因家族在N端有高度保守序列SAYQXEG和AYRFSISWSR,在C端有高度保守序列IXENG和GANVXGYFXWSLLD NFE。擬南芥疑似β-葡萄糖苷酶基因At3g06510有保守序列TFNEP、IVTENG和GYIFWTISDNWEW。茶樹β-葡萄糖苷酶基因氨基酸序列多重序列比對中,有高度保守序列SFDFLGLN和YITENG,其中,SFDFLGLN為糖基水解酶家族Ⅰ信號區(Glycosyl hydrolase familyⅠ signature)[29],YITENG為糖基水解酶家族Ⅰ活性部位(Glycosyl hydrolase familyⅠ active site)(圖2)。據報道β-葡萄糖苷酶底物水解涉及酶的糖基化、去糖基化反應,同時還需要親核谷氨酸及谷氨酸殘基酸/堿催化劑分別參與到YITENG和TLNEP保守序列中[30]。

圖2 茶樹與其他植物β-葡萄糖苷酶基因的多重比對分析Fig.2 Multiple alignment of β-glucosidases in Camellia sinensis and other plant species
2.3茶樹β-葡萄糖苷酶的系統發育分析
茶樹經過長期的異花授粉,以及遺傳結構的差異等影響因素,導致不同類型的茶樹群體間存在著遺傳多樣性,尤其是野生茶樹資源的遺傳多樣性更是復雜[31]。在水稻β-葡萄糖苷酶基因系統發育分析中,表明其與擬南芥、大豆以及松屬β-葡萄糖苷酶基因都存在親緣關系。擬南芥47個β-葡萄糖苷酶基因根據系統發育分析以及內含子與外顯子間的結構組成,分成10個分支,各個分支間的基因表現出不同的底物專一性。在茶樹中,β-葡萄糖苷酶基因(登錄號:AF537127.1)與黃檀植物親緣關系最近,GluⅠ和GluⅡ與葡萄中的β-葡萄糖苷酶基因序列相似性最高,其中,GluⅠ與煙草、葡萄和蓖麻等植物的親緣關系較近。遺憾的是GluⅠ、GluⅡ基因序列都尚未登錄在GENBANK中。通過下載NCBI中已經登錄的茶樹β-葡萄糖苷酶基因氨基酸序列,以及與茶樹序列相似度高的基因,構建鄰接系統發育樹。結果表明,17個不同植物的β-葡萄糖苷酶基本上按照植物的種屬親緣關系聚到一起;茶樹β-葡萄糖苷酶基因CAK97604.2和ADV40931.2同在一個小分支上,并且與煙草屬、胡麻屬及溝酸漿屬聚到一個大分支上(圖3)。
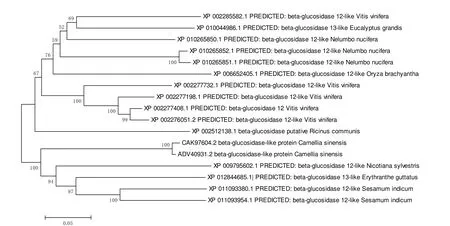
圖3 茶樹β-葡萄糖苷酶基因系統發育分析Fig.3 Phylogenetic analysis of β-glucosidases in Camellia sinensis and other plant species
3 茶樹β-葡萄糖苷酶基因的表達
3.1 非生物逆境下茶樹β-葡萄糖苷酶基因的表達
逆境脅迫包括非生物脅迫和生物脅迫。植物受到逆境脅迫后,內源水楊酸SA、乙烯ET和茉莉酸JA等信號分子介導的傳導途徑調控著植物對逆境的應激反應[32]。水稻噴施外源β-葡萄糖苷酶,提高了內源SA、ET及H2O2含量[33]。β-葡萄糖苷酶水解釋放的葡萄糖等物質可以促使植物激素的產生,同時還可以促進防御基因產物的生成,這表明β-葡萄糖苷酶與植物的逆境防御以及生長發育密切相關[34-35]。
據報道植物的干旱、低溫及生長發育應答途徑涉及到ABA依賴和ABA非依賴的信號傳導途徑。干旱脅迫下,擬南芥β-葡萄糖苷酶基因AtBG1水解釋放游離態的ABA[36]。在匍匐翦股穎中過量表達AtBG1,提高了植物的耐旱性[37]。而茶樹β-葡萄糖苷酶則參與了冬季休眠芽中赤霉素GA的含量變化過程[38]。Shi J等[39]人以0.25%茉莉酸甲酯(MeJA)處理茶樹24 h后,分析茶樹幼葉中β-葡萄糖苷酶、多酚氧化酶(Polyphenol oxidase,PPO)等基因表達水平的變化,發現PPO與β-櫻草糖苷酶基因表達水平均呈現上調,而β-葡萄糖苷酶基因表達水平卻呈現微下調。在耐鹽性水稻中,β-葡萄糖苷酶基因Os3bglu7和Os4bglu12在高鹽逆境下基因表達均呈現上調[40]。玉米β-葡萄糖苷酶基因Zmbglu1在鹽脅迫和機械損傷初期基因表達升高,而3 h后基因表達水平開始下降,24 h后基因表達水平回到初值。通過分析Zmbglu1的啟動子序列,發現它具有順式元件WBOXNTCHN48,而WBOXNTCHN48被證實是一些轉錄因子誘導響應元件[41]。茶樹葉片離體后,呈現脫水狀態,β-葡萄糖苷酶基因mRNA的表達信號在初期3 h內逐漸增強,而在后期已經沒有表達信號。在非生物逆境脅迫下,茶樹β-葡萄糖苷酶基因表達水平升高,但只表現在脅迫初期,之后隨時間的延長,基因表達回到正常水平,這些研究表明茶樹β-葡萄糖苷酶基因對非生物逆境脅迫是積極響應的,并且有可能在脅迫防御反應中位于上游部位。
3.2 生物逆境下茶樹β-葡萄糖苷酶基因的表達
食草性昆蟲、真菌及細菌等微生物對植物造成的脅迫為生物逆境脅迫。生物與非生物逆境脅迫間的信號傳導途徑相互作用而又相互拮抗,因此植物內源基因表達水平在兩種脅迫下有相似也會有所差異[42]。植物β-葡萄糖苷酶基因已經被證實參與了對病蟲害的防御反應,如蔥芥屬植物β-葡萄糖苷酶基因催化釋放的硫代葡萄糖苷和羥腈葡萄糖苷可以影響菜青蟲的新陳代謝以及種群數量[43]。
茶樹β-葡萄糖苷酶可促進糖苷類香氣前體的轉化,產生芳樟醇、香葉醇等香氣物質[44],且芳樟醇、香葉醇為茶樹重要的萜類化合物,都屬于揮發性有機物(Volatile organic components,VOCs)。VOCs可以抵御食草性昆蟲、細菌等微生物對植物造成的損傷,并能調解共生菌、寄生植物與寄主植物間的相互關系[45]。王瑾等[46]研究表明,芳樟醇、香葉醇、苯甲醇和苯乙醇等茶樹游離態香氣成分對茶炭疽病、茶云紋葉枯病等致病菌的生長具有抑制作用,且抑制率為10%~100%,其中,香葉醇對致病菌的抑制作用最強。真菌侵染以后,茶樹β-葡萄糖苷酶基因GluⅠ和GluⅡ的表達水平在不同茶樹品種中的變化趨勢基本一致,GluⅠ在舒茶早中上調倍數為1.14~11.82;GluⅡ在多抗香中的上調倍數為4.43~5.65,且基因表達水平上調多發生于染病初期。Mageroy 等[47]發現對卷葉蛾具有防御反應的白云杉中β-葡萄糖苷酶基因Pgβglu-1表達水平比正常的白云杉高出1 000倍。Pgβglu-1可以通過釋放相應糖苷配基,促進乙酰苯的積累來抵御卷葉蛾的侵襲。青豆β-葡萄糖苷酶基因可以通過生氰作用來抵御食草性昆蟲的襲擊[48]。在大吉嶺茶樹上的研究表明[49],受葉蟬和薊馬危害后,茶樹葉片中的β-葡萄糖苷酶基因表達水平升高顯著。與非生物逆境相似的是,茶樹β-葡萄糖苷酶基因在生物逆境下的表達升高,而且上調也是出現在逆境初期,這表明茶樹β-葡萄糖苷酶基因對兩種脅迫的響應機制具有相似性。
4 茶樹β-葡萄糖苷酶與茶葉加工
在茶葉加工的生化變化中,主要的酶類是水解酶和氧化還原酶。Yang Z等[50]指出與茶葉香氣形成有關的酶類中,β-葡萄糖苷酶、PPO 及β-櫻草糖苷酶尤其重要。在紅茶制造化學中,以糖苷形式存在的結合型香氣化合物前體,如香葉醇、青葉醇、芳樟醇等的糖苷,及其水解酶β-糖苷酶以及與C6-醛、醇等生成有關的亞麻酸、脂肪氧合酶及醇脫氫酶等對紅茶香氣生成非常重要[1]。茶樹鮮葉在攤放階段中細胞內部結構沒有被破壞,細胞中的β-葡萄糖苷酶與糖苷類香氣前體接觸的機會仍然很小,因此香氣前體的水解可能主要是在茶葉加工的后續工序中,通過進一步破壞葉細胞結構實現[51]。在紅碎茶加工過程中,β-葡萄糖苷酶在萎凋結束時活性達到最高值,以后持續下降,而在工夫紅茶加工中,在揉捻階段酶活升至最高[52]。紅茶加工中,隨著萎凋時間延長β-葡萄糖苷酶活性呈現不同程度的增加,萎凋14 h后β-葡萄糖苷酶活性達到鮮葉的2.1倍。在揉捻、發酵、干燥工藝中,酶活性開始不同程度地下降,結果推斷β-葡萄糖苷酶對紅茶香氣品質的影響主要表現在萎凋過程及發酵早期[53]。
5 總結
茶樹β-葡萄糖苷酶基因表達不僅在非生物逆境初期有上調,而且在生物逆境中也有相似表達,這都表明β-葡萄糖苷酶在茶樹抵御逆境反應中具有積極響應作用。在茶葉加工過程中,β-葡萄糖苷酶可以促進糖苷類香氣前體的水解并釋放出揮發性苷元,為茶葉香氣成分的積累提供物質基礎。因此,茶樹β-葡萄糖苷酶基因的克隆、鑒定與表達對促進抗病與高香茶樹良種的培育,豐富和完善茶葉加工和茶園管理,以及深入了解茶葉香氣形成的機理,都具有重要的理論意義和應用價值。目前,茶樹基因的克隆與表達還處在初級階段,仍有許多需要學者研究與鑒定,如β-葡萄糖苷酶在茶樹中的同工酶基因以及β-葡萄糖苷酶在茶樹逆境中的反應機制等。
參考文獻
[1]宛曉春.茶葉生物化學[M].3版.北京:中國農業出版社,2003.
[2]Li Y,Yuan Y Y,Meeran S M,et al.Synergistic epigenetic reactivation of estrogen receptor-α(ERα)by combined green tea polyphenol and histone deacetylase inhibitor in ERα-negative breast cancer cells[J].Molecular Cancer,2010,9:274.DOI:10.1186/1476-4598-9-274.
[3]Lin C H,Shen Y A,Hung P H,et al.Epigallocathechin gallate,polyphenol present in green tea,inhibits stem-like characteristics and epithelial-mesenchymal transition in nasopharyngeal cancer cell lines[J].BMC Complementary and Alternative Medicine,2012,12(1):220-222.
[4]宛曉春,李大祥,張正竹,等.茶葉生物化學研究進展[J].茶葉科學,2015,35(1):1-10.
[5]Henrissat B,Davies G.Structural and sequence-based classification of glycoside hydrolases[J].Current Opinion in Structural Biology,1997,7(5):637-44.
[6]Wang P T,Liu H,Hua H J,et al.A vacuole localized β-glucosidase contributes to drought tolerance in arabidopsis[J].Chinese Science Bulletin,2011,56(33):3538-3546.
[7]Yao J,Huot B C,Doddapaneni H,et al.Expression of a beta-glucosidase gene results in increased accumulation of salicylic acid in transgenic Nicotiana tabacum cv.Xanthi-nc NN genotype[J].Plant Cell Reports,2007,26(3):291-301.
[8]陸建良,林晨,駱穎穎.茶樹重要功能基因克隆研究進展[J].茶葉科學,2007,27(2):11-16.
[9]段云裳,鄒中偉,成浩,等.茶葉β-葡萄糖苷酶的研究進展[J].中國茶葉,2008,30(6):15-17.
[10]黃瑜萍,郭雅玲,林瑜玲,等.β-葡萄糖苷酶在茶葉加工過程中的研究進展[J].福建茶葉,2015(2):2-4.
[11]王曉,沈程文,周躍斌.β-葡萄糖苷酶與茶增香及抗病蟲害的研究進展[J].茶葉通訊,2014,41(4):8-12.
[12]Ketudat-Cairns J R,Esen A.β-Glucosidases[J].Cellular and Molecular Life Sciences,2010,67(20):3389-3405.
[13]Rawat R,Gulati A.Seasonal and clonal variations in some major glycosidic bound volatiles in Kangra tea(Camellia sinensis(L.)O.Kuntze)[J].European Food Research & Technology A,2008,226(6):1241-1249.
[14]Morita K,Wakabayashi M,Kubota K,et al.Aglycone constituents in fresh tea leaves cultivated for green and black tea[J].Bioscience,Biotechnology,and Biochemistry,1994,58(4):687-690.
[15]Verdoucq L,Morinière J,Bevan D R,et al.Structural determinants of substrate specificity in family 1 β-Glucosidases[J].Journal of Biological Chemistry,2004,279(30):31796-31803.
[16]張正竹,宛曉春,坂田完三.茶葉β-葡萄糖苷酶親和層析純化與性質研究[J].茶葉科學,2005,25(1):16-22.
[17]Opassiri R,Pomthong B,Onkoksoong T,et al.Analysis of rice glycosyl hydrolase family 1 and expression of Os4bglu12 beta-glucosidase[J].BMC Plant Biology,2006,6(1):33.DOI:10.1186/1471-2229-6-33.
[18]Sener A.Extraction,partial purification and determination of some biochemical properties of β-glucosidase from tea leaves(Camellia sinensis L.)[J].Journal of Food Science & Technology,2015.DOI:10.1007/s13197-015-1915-z.
[19]Rodrigues M A,Teixeira R S,Ferreira-Leit?o V S,et al.Untreated Chlorella homosphaera biomass allows for high rates of cell wall glucan enzymatic hydrolysis when using exoglucanase-free cellulases[J].Biotechnology for Biofuels,2015,8(1):25.DOI:10.1186/s13068-015-0215-1.
[20]Opassiri R,Cairns J R K,Akiyama T,et al.Characterization of a rice β-glucosidase genes highly expressed in flower and germinating shoot[J].Plant Science,2003,165(3):627-638.
[21]李遠華,江昌俊,余有本.茶樹β-葡萄糖苷酶基因mRNA的表達[J].南京農業大學學報,2005,28(2):103-106.
[22]Xu Z,Escamilla-Trevino L,Zeng L H,et al.Functional genomic analysis of Arabidopsis thaliana glycoside hydrolase family1[J].Plant Molecular Biology,2004,55(3):343-367.
[23]Gómez-Anduro G,Ceniceros-Ojeda E A,Casados-Vázquez L E,et al.Genome-wide analysis of the beta-glucosidase gene family in maize(Zea mays L.var B73)[J].Plant Molecular Biology,2011,77:159-183.
[24]Chivasa S,Ndimba B K,Simon W J,et al.Proteomic analysis of the arabidopsis thaliana cell wall[J].Electrophoresis,2002,23(11):1754-1765.
[25]Andréasson E,J?rgensen L B,H?glund A S,et al.Different myrosinase and idioblast distribution in arabidopsis and Brassica napus[J].Plant Physiology,2001,127(4):1750-1763.
[26]李遠華.茶樹β-葡萄糖苷酶基因克隆、表達和分布定位[D].合肥:安徽農業大學,2003.
[27]費月.與茶葉香氣形成相關的三個內源糖苷酶基因的克隆和原核表達[D].合肥:安徽農業大學,2012.
[28]Henrissat B,Bairoch A.New families in the classification of glycosyl hydrolases based on amino acid sequence similarities[J].Biochemical Journal,1993,293(Pt3):781-788.
[29]Jones P,Vogt T.Glycosyltransferases in secondary plant metabolism:tranquilizers and stimulant controllers[J].Planta,2001,213(2):164-174.
[30]Turan Y.A pseudo-beta-glucosidase in Arabidopsis thaliana:correction by site-directed mutagenesis,heterologous expression,purification,and characterization[J].Biochemistry2008,73(8):912-919.DOI:10.1134/S0006297908080099.
[31]Yao M Z,Ma C L,Qiao T T,et al.Diversity distribution and population structure of tea germplasms in China revealed by EST-SSR markers[J].Tree Genetics & Genomes,2012,8(1):205-220.
[32]Koornneef A,Pieterse C M J.Cross-talk in defense signaling[J].Plant Physiology,2008,146:839-844.
[33]Wang X,Zhou G X,Xiang C Y,et al.β-Glucosidase treatment and infestation by the rice brown planthopper Nilaparvata lugens elicit similar signaling pathways in rice plants[J].Chinese Science Bulletin,2008,53(1):53-57.
[34]Babcock G D,Esen A.Substrate specificity of maize β-glucosidase[J].Plant Science,1994,101(94):31-39.
[35]Brzobohaty B,Moore I,Kristoffersen P,et al.Release of active cytokinin by a beta-glucosidase localized to the maize root meristem[J].Science,1993,262(5136):1051-1054.
[36]Kwang Hee L,Lan P H,Ho-Youn K,et al.Activation of glucosidase via stress-induced polymerization rapidly increases active pools of abscisic acid[J].Cell,2006,126(6):1109-1120.
[37]Han Y J,Cho K C,Hwang O J,et al.Overexpression of an Arabidopsis β-glucosidase gene enhances drought resistance with dwarf phenotype in creeping bentgrass[J].Plant Cell Reports,2012,31(9):1677-1686.
[38]Nagar P K,Kumar A.Changes in endogenous gibberellin activity during winter dormancy in tea[Camellia sinensis(L.)O.Kuntze][J].Acta Physiologiae Plantarum,2000,22(4):439-443.[39]Shi J,Wang L,Cheng-Ying M A,et al.Aroma changes of black tea prepared from methyl jasmonate treated tea plants[J].Journal of Zhejiang University:science b,2014,15(4):313-321.
[40]Kawasaki S,Borchert C,Deyholos M,et al.Gene expression profiles during the initial phase of salt stress in rice[J].Plant Cell,2001,13(4):889-905.
[41]Yamamoto S,Nakano T,Suzuki K,et al.Elicitor-induced activation of transcription via W box-related cis-acting elements from a basic chitinase gene by WRKY transcription factors in tobacco[J].Biochimica et Biophysica Acta Gene Structure and Expression,2004,1679(3):279-287.
[42]Nicky J Atkinson,Catherine J Lilley,Peter E Urwin,et al.Identification of genes involved in the response of Arabidopsis to simultaneous biotic and abiotic stresses[J].Plant Physiology,2013,162:2028-2041.
[43]Frisch T,Agerbirk N,Davis S,et al.Glucosinolate-related glucosides in Alliaria petiolata:sources of variation in the plant and different metabolism in an adapted specialist herbivore,Pieris rapae[J].Journal of Chemical Ecology,2014,40(10):1063-1079.
[44]Takeo T.Variation in amounts of linalol and geraniol produced in tea shoots by mechanical injury[J].Phytochemistry,1981,20(9):2149-2151.
[45]Rasmann S,K?llner T G,Degenhardt J,et al.Recruitment of entomopathogenic nematodes by insect-damaged maize roots[J].Nature,2005,434(7034):732-737.
[46]王瑾,戚麗,張正竹.真菌侵染引發的茶樹內源糖苷酶基因差異表達[J].植物學報,2011,46(5):552-559.
[47]Mageroy M H,Parent G,Germanos G,et al.Expression of the β-glucosidase gene Pgβglu-1 underpins natural resistance of white spruce against spruce budworm[J].Plant Journal for Cell & Molecular Biology,2015,81(1):68-80.
[48]Ballhorn D J,Heil M,Lieberei R.Phenotypic plasticity of cyanogenesis in lima bean Phaseolus lunatus-activity and activation of beta-glucosidase[J].Journal of Chemical Ecology,2006,32(2):261-275.
[49]Gohain B,Borchetia S,Bhorali P,et al.Understanding Darjeeling tea flavour on a molecular basis[J].Plant Molecular Biology,2012,78(6):577-597.
[50]Yang Z,Baldermann S,Watanabe N.Recent studies of the volatile compounds in tea[J].Food Research International,2013,53(2):585-599.
[51]張正竹,宛曉春,施兆鵬,等.鮮茶葉攤放過程中呼吸速率、β-葡萄糖苷酶活性、游離態香氣和糖苷類香氣前體含量的變化[J].植物生理學通訊,2003,39(2):134-136.
[52]劉莉華,宛曉春,文勇,等.祁門紅茶加工過程中β-葡萄糖苷酶活性變化研究[J].安徽農業大學學報,2003,30(4):386-389.
[53]豐金玉,劉昆言,秦昱,等.紅茶加工中多酚氧化酶、過氧化物酶和β-葡萄糖苷酶活性變化[J].農學學報,2014,4(11):96-99.
Research Advance on β-Glucosidase of Tea Plant
ZHOU Hanchen,LEI Pandeng,DING Yong*
Tea Research Institution,Anhui Academy of Agricultural Sciences,Huangshan 245000,China
Abstract:All material metabolisms,energy transfer,growth and development in tea plant require the participation of enzymes,which are also of great importance for tea quality formation.β-glucosidase catalyzes the hydrolysis of tea glycoside precursors.The produced aroma substances are not only involved in plant defense reaction against diseases and pests,but also important for tea quality.The β-glucosidase of Camellia sinensis is highly similar to β-glucosidase gene family members of arabidopsis,rice and maize in expression sites,subcellular localization,protein structure and phylogenetic evolution.Under biotic and abiotic stresses,the β-glucosidase of Camellia sinensis is immediately induced in the early stage.This paper mainly focused on the bio-informatic and gene expression in tea plant studies of Camellia sinensis β-glucosidase.Meanwhile,the changes of β-glucosidase in tea processing were also reviewed.
Keywords:tea plant(Camellia sinensis),β-glucosidase,bioinformatics,gene expression
作者簡介:周漢琛,女,碩士研究生,主要從事茶葉生物化學方面的研究。*通訊作者:ahtdy@163.com
基金項目:安徽省農業科學院院長基金項目(15B0837)、安徽省科技攻關計劃(1501031100)、安徽省農業科學院名優茶現代化加工關鍵技術與設備科技創新團隊(12C0803)。
收稿日期:2015-08-13
修訂日期:2015-10-13
中圖分類號:S571.1;S233.75
文獻標識碼:A
文章編號:1000-369X(2016)02-111-08

