EGCG抑制波羅的海希瓦氏菌生物被膜和腐敗活性的研究
葉曉鋒,張芳,朱軍莉,張蕾,謝杜梅浙江工商大學食品與生物工程學院,浙江 杭州 310035
?
EGCG抑制波羅的海希瓦氏菌生物被膜和腐敗活性的研究
葉曉鋒,張芳,朱軍莉*,張蕾,謝杜梅
浙江工商大學食品與生物工程學院,浙江 杭州 310035
摘要:以海產品腐敗菌波羅的海希瓦氏菌(Shewanella baltica)為對象,評價了兒茶素單體抑制生物被膜的效果,并分析效果最佳的單體對該菌生物被膜和腐敗活性的影響。結果表明,5種兒茶素單體均能抑制S.baltica生物被膜形成,其中表沒食子兒茶素沒食子酸酯(Epigallocatechin gallate,EGCG)抑制率最高,其最小抑菌質量濃度為40 μg·mL(-1),亞抑菌質量濃度10~30 μg·mL(-1)的EGCG對細菌生長無顯著影響。在30 μg·mL(-1)EGCG作用下,群體感應(Quorum sensing,QS)信號分子呋喃酮酰硼酸二酯(Autoinducer-2,AI-2)、二酮哌嗪類化合物(Diketopiperazine,DKPs)cyclo-(L-Pro-L-Leu)和cyclo-(L-Pro-L-Phe)活性顯著下降(P<0.05),其抑制率分別為63.95%、27.43%和21.94%。亞抑菌濃度EGCG能顯著抑制S.baltica生物被膜形成、泳動能力和蛋白酶活性(P<0.05),呈現濃度依賴性,在30 μg·mL(-1)時抑制率分別為55.18%,66.71%和46.67%。因此,EGCG在亞抑菌濃度下能夠干擾S.baltica的QS系統,有效抑制生物被膜形成,減弱致腐能力,研究為EGCG作為新型的QS抑制劑調控食品腐敗菌奠定基礎。
關鍵詞:波羅的海希瓦氏菌;EGCG;生物被膜;腐敗;群體感應;抑制
波羅的海希瓦氏菌(Shewanella baltica)為希瓦氏菌屬(Shewanella)、交替單胞菌科(Alteromonadaceae),革蘭氏陰性嗜冷菌,產H2S,具有還原氧化三甲胺為三甲胺的能力,是大黃魚等多種海產品在冷藏過程中品質下降的特定腐敗菌[1-2]。生物被膜是指細菌嵌入自身分泌的多糖、蛋白質和DNA等多聚物所組成的一種結構化聚合體,是細菌為適應自然環境而特有現象,極易在食品加工器材的表面形成。研究表明,希瓦氏菌、假單胞菌等水產品腐敗菌均以生物被膜形式生長,被膜菌對保鮮劑、抑菌劑及物理損傷的抵抗能力可以提高數百倍,很難被清除,從而導致持續性污染,給水產品加工和保鮮帶來嚴重危害[3-4]。
已有大量研究表明,群體感應(Quorum sensing,QS)參與多種細菌的生物被膜形成以及調控致病和致腐能力[5-6]。QS是一種細菌種間和種內信息交流的調控機制,細菌產生信號分子(Autoinducer,AI)并釋放到環境中去,當環境中的信號分子濃度達到一定閾值后,開啟細胞密度依賴的特定基因的表達[7]。QS調控多種基因的表達,包括生物被膜形成、發光、毒力因子釋放、泳動能力、蛋白酶活性等[8]。研究表明,大多數革蘭氏陰性菌能夠產高絲氨酸內酯(N-acyl-L-homoserine lactones,AHLs)以及用于種間交流的AI-2。近年來,在S.baltica中還檢測到AI-2活性,并發現了新型信號分子——二酮哌嗪類化合物(Diketopiperazine,DKPs)[6,9]。
干擾細菌的QS來抑制生物被膜形成和致腐能力,這一途徑的利用為食品保鮮提供一了種嶄新、有效的思路。已有報道發現,植物提取物能通過抑制細菌QS來減弱致病菌毒力或腐敗菌致腐能力[10-12]。表沒食子兒茶素沒食子酸酯(EGCG)是綠茶中含量最豐富的一種多酚類抗氧化物,綠茶的抑菌、抗氧化等生物活性均與EGCG密切相關[13]。EGCG分子中有多個酚羥基,具有很強的抗氧化、清除自由基、抑菌和抑制細菌毒力的性能[14-15]。目前,針對EGCG的研究主要集中在抑菌和抗氧化活性方面,而鮮有報道EGCG對腐敗菌生物被膜形成以及QS的影響。鑒于此,本研究評價EGCG在亞抑菌濃度下對S.baltica生物被膜形成、QS活性、游動能力、胞外蛋白酶活性的抑制效果,以期為EGCG在海產品貯藏保鮮中的應用提供理論基礎。
1 材料與方法
1.1 試劑和培養基
兒茶素(C)、表兒茶素(EC)、沒食子兒茶素(EGC)、表兒茶素沒食子酸酯(ECG)和表沒食子兒茶素沒食子酸酯(EGCG)均為分析純(阿拉丁公司),DKPs化合物[cyclo-(L-Pro-L-Phe),cyclo-(L-Pro-L-Leu)](上海生工生物工程股份有限公司),純度高于98%。LB、TSB培養基、蛋白胨、瓊脂等培養基成分(青島海博生物有限公司)。
1.2 儀器與設備
酶標儀:VICTOR X,美國Perkin Elmer公司;氣相色譜儀:Agilent 6890N,美國Agilent公司;旋轉蒸發儀:EYELA N-1100,東京理化公司;24孔平板:美國Costar公司;紫外可見分光光度計:UV-2550,日本島津公司;生化培養箱:LRH-250A,廣東省醫療器械廠;滅菌鍋:LDZM-40KCS,上海申安醫療器械廠。
1.3方法
1.3.1 菌種的活化
腐敗菌S.baltica XH2從大黃魚中分離,并鑒定為特定腐敗菌[16]。取S.baltica XH2甘油菌100 μL于5 mL無菌LB肉湯中,28℃,200 r·min-1搖床培養12 h,重復活化兩次,備用。
1.3.2 茶多酚單體篩選
將C、EC、EGC、ECG、EGCG 5種單體分別溶解于二甲基亞砜(DMSO)。取1%過夜活化菌接種于TSB培養基中,分裝至24孔板,加入質量濃度為30 μg·mL-15種兒茶素單體,以DMSO為空白對照組,25℃靜置培養48 h后,采用結晶紫法定量測定生物被膜[10]。具體為:培養后的生物被膜棄去培養基,加入PBS漂洗3次去除浮游菌,在60℃固定30 min后,每孔加入0.2%的結晶紫溶液,染色15 min后棄去,再用PBS漂洗3次,干燥后,用33%冰乙酸溶解,于波長600 nm測定OD值,每組5個平行。
1.3.3 最小抑菌濃度(MIC)測定
參考王艷等[17]的方法,取1%過夜活化的菌液接種于LB肉湯,分別加入質量濃度為5、10、20、40、80、160 μg·mL-1的EGCG,以DMSO為對照,于28℃培養24 h,在波長600 nm處測定吸光度,每組3個平行。
1.3.4 生物被膜定量分析
取1%過夜活化的菌液于TSB培養基,搖勻分裝至24孔板,分別加入質量濃度為10、20、30 μg·mL-1的EGCG,以DMSO為空白對照,25℃靜置培養48 h,采用1.3.2方法定量測定生物被膜。
1.3.5 AI-2活性分析
參考趙二科等[18]的方法。具體為S.baltica在含有濃度為0、10、20、30 μg·mL-1EGCG的LB肉湯中搖床培養9 h后,離心(10 465 r·min-1,10 min),取上清,過膜(0.22 μm)。取過夜活化后的V.harveyi BB170報告菌株用AB培養基以1∶5 000進行稀釋,取90 μL稀釋的報告菌液和10 μL上述無菌上清液加到96孔酶標板中,AB培養基為空白對照。在熒光酶標儀測定,模式為OPS,檢測熒光值,溫度選擇30℃,間隔時間為0.5 h,連續測定7 h。
1.3.6 DKPs活性分析
參考Gu等[9]的方法,稍作修改。將DKPs化合物[cyclo-(L-Pro-L-Phe)、cyclo-(L-Pro-LLeu)]配置成單一及混合標準液,采用氣相色譜(Gas chromatography,GC)測定其種類及濃度,并繪制標準曲線。GC條件:HP-5ms毛細柱(30 m×0.25 mm×0.25 nm,Agilent),高純氦氣(>99.999%)作為載氣,載氣恒流流速1.0 mL·min-1,分流比20∶1,進樣口溫度為260℃,進樣量為l μL。升溫程序為:起始溫度50℃,保持2 min,以15℃·min-1的速率上升至260℃,保持8 min。取1%活化菌液接種于50 mL LB培養基中,分別加入工作濃度為10,20,30 μg·mL-1EGCG,對照組加入等量DMSO,在28℃搖床培養12 h,離心(10 465 r·min-1,10 min),取上清液,用等體積氯仿萃取3次,收集有機相,37℃下旋轉蒸發,用氯仿重新溶解,定容至1 mL,過膜后樣品經GC分析,并計算DKPs的含量變化。
1.3.7 游動能力分析
參考Packiavathy等[10]方法,略作修改。取20 mL Swimming培養基(蛋白胨1%,NaCl 0.25%,瓊脂0.3%),冷卻至45℃,分別加入質量濃度為10、20、30 μg·mL-1的EGCG,以DMSO為對照,混合倒在平板上,待凝固干燥后,吸取5 μL活化菌液點在平板中央上,在25℃培養36 h觀察細菌泳動性。
1.3.8 胞外蛋白酶測定
取20 mL的脫脂奶培養基(脫脂奶粉1%,瓊脂糖1%,105℃下滅菌10 min),冷卻至45℃,分別加入質量濃度為10、20、30 μg·mL-1的EGCG,以DMSO為對照,混合倒在平板上,待凝固干燥后,吸取5 μL活化菌液點在平板中央上,在25℃培養36 h觀察透明圈。
1.3.9 數據分析
每組樣品至少3次重復,采用Microsoft Excel和Origin 8.5進行數據處理和作圖,并用SPSS17.0的ANOVA進行方差分析,P<0.05為差異顯著。
2 結果與分析
2.1 茶多酚單體篩選
如圖1所示,兒茶素(C)、表兒茶素(EC)、兒茶素沒食子酸酯(ECG)、沒食子兒茶素(EGC)、沒食子兒茶素沒食子酸酯(EGCG)5種單體在質量濃度30 μg·mL-1時對S.baltica生物被膜均具有抑制作用,抑制率分別為42.85%、18.73%、50.75%、51.86%和59.26%,其中EGCG的抑制作用最為顯著(P<0.05)。因此,選用EGCG為后續實驗的兒茶素單體。
2.2 EGCG對S.baltica的最小抑菌濃度
如圖2所示,通過二倍稀釋法測定EGCG 對S.baltica的最小抑菌濃度。結果顯示EGCG 對S.baltica最小抑菌質量濃度為40 μg·mL-1,隨著濃度的增加抑制效果顯著增強。5~20 μg·mL-1的EGCG對細菌生長無顯著影響,因此,選取10、20、30 μg·mL-1亞抑菌濃度的EGCG進行后續實驗。
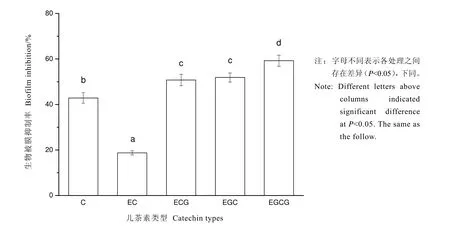
圖1 5種兒茶素單體對S.baltica生物被膜的抑制Fig.1 Inhibition of five catechin monomers on S.baltica biofilm
2.3 EGCG對S.baltica AI-2信號分子的影響
亞抑菌濃度下EGCG對S.baltica AI-2信號分子的影響如圖3所示。在質量濃度10、20、30 μg·mL-1時,EGCG對S.baltica AI-2活性的抑制率分別為44.53%、50.09%和63.95%。與DMSO對照組相比,亞抑菌濃度下的EGCG對S.baltica AI-2活性表現出顯著的抑制作用(P<0.05),呈現濃度依賴性。
2.4 EGCG對S.baltica DKPS信號分子的影響
圖4為DKPs化合物[(cyclo-(L-Pro-L-Phe),cyclo-(L-Pro-L-Leu)]混合標準溶液和S.baltica上清液中DKPs的氣相色譜圖譜。在該GC條件下樣品中cyclo-(L-Pro-L-Leu)和cyclo-(L-Pro-L-Phe)得到有效分離,保留時間分別為15.26、18.73 min,且基線穩定,干擾峰少。亞抑菌濃度EGCG對S.baltica DKPS信號分子的影響,結果如圖3所示,在30 μg·mL-1EGCG作用下,cyclo-(L-Pro-L-Leu)和cyclo-(L-Pro-L-Phe)抑制率分別為27.43%、21.94%。
2.5 EGCG抑制S.baltica生物被膜形成
通過結晶紫染色法評價亞抑菌濃度下EGCG對S.baltica生物被膜形成的影響,如圖5所示。結果發現EGCG對S.baltica生物被膜形成起顯著的抑制作用(P<0.05)。經48 h培養后,10、20、30 μg·mL-1的EGCG對S.baltica生物被膜抑制率分別達到了16.15%、32.55%、55.18%。
2.6 EGCG抑制S.baltica的游動能力
圖6為亞抑菌濃度下EGCG對S.baltica泳動能力的影響。EGCG對S.baltica游動能力具有抑制作用,并且隨著濃度的增加,抑制作用更加明顯。S.baltica對照組在平板上擴散圈直徑約為(64±0.3)mm,10、20、30 μg·mL-1的EGCG作用后,S.baltica游動能力明顯受到抑制,其抑制率分別為8.34%、20.86%和66.71%。
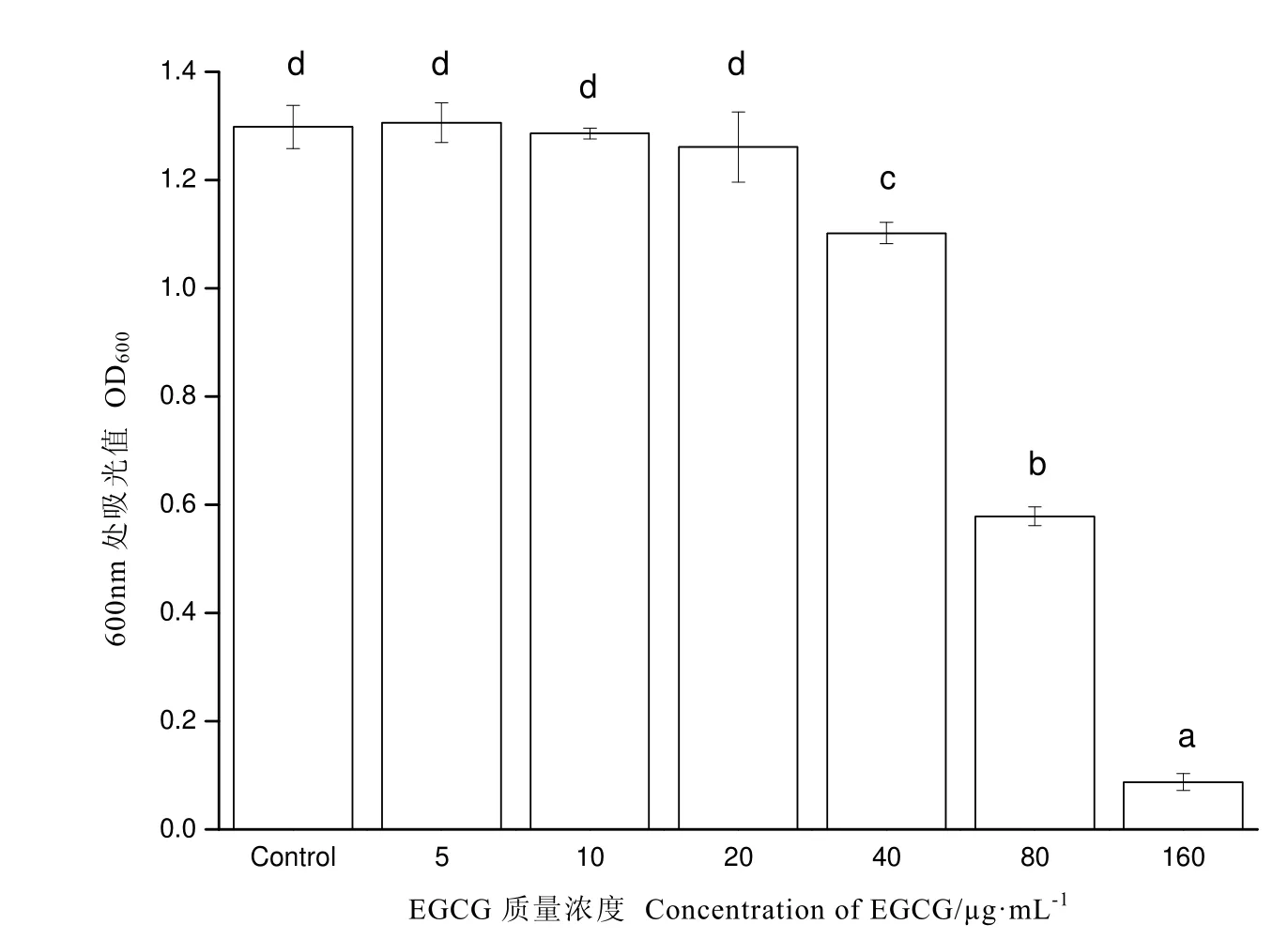
圖2 EGCG對S.baltica的最小抑菌濃度Fig.2 MIC of EGCG against S.baltica
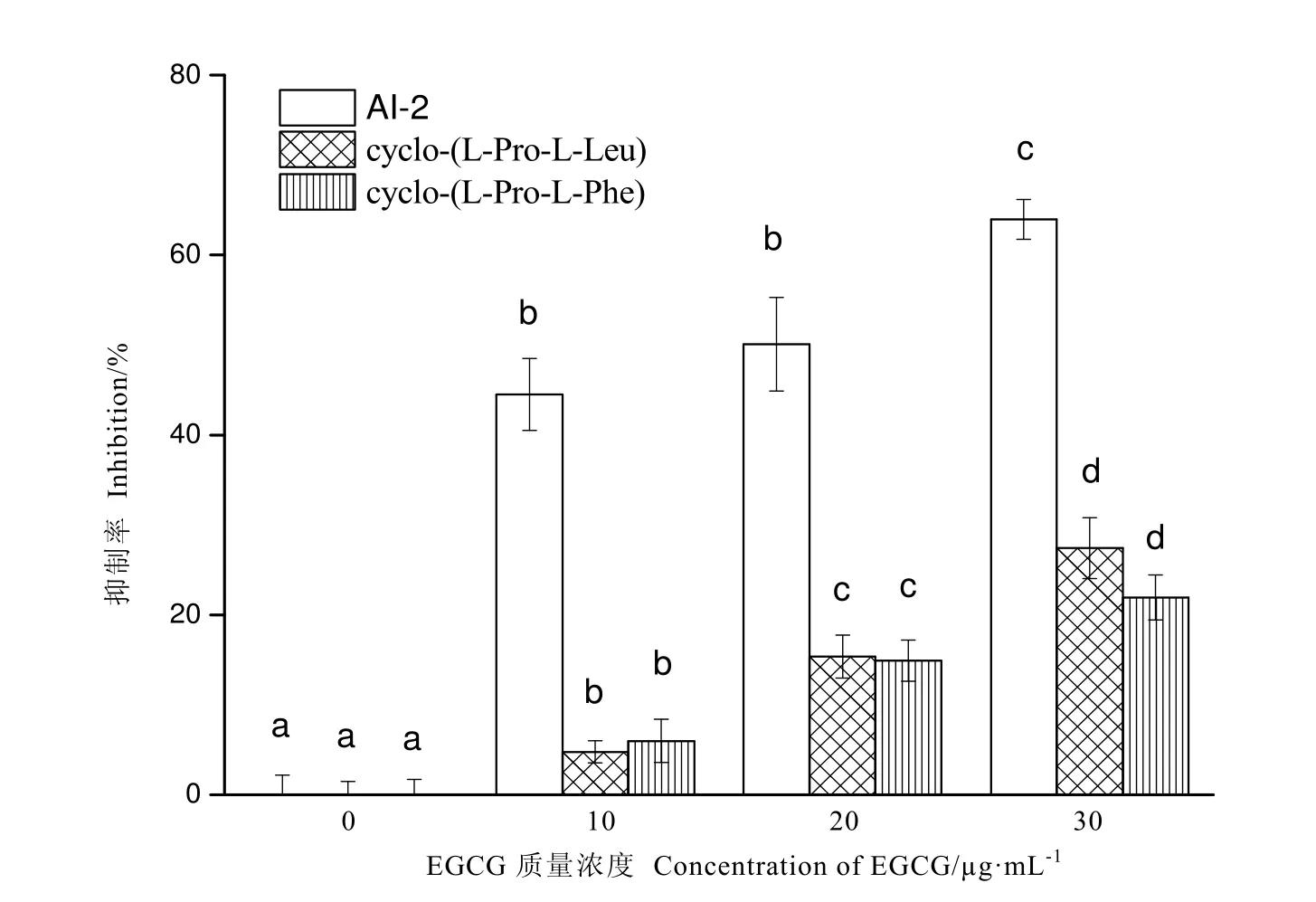
圖3 亞抑菌濃度EGCG對S.baltica AI-2活性的影響Fig.3 Effect of EGCG at sub-MIC on AI-2 activities in S.baltica
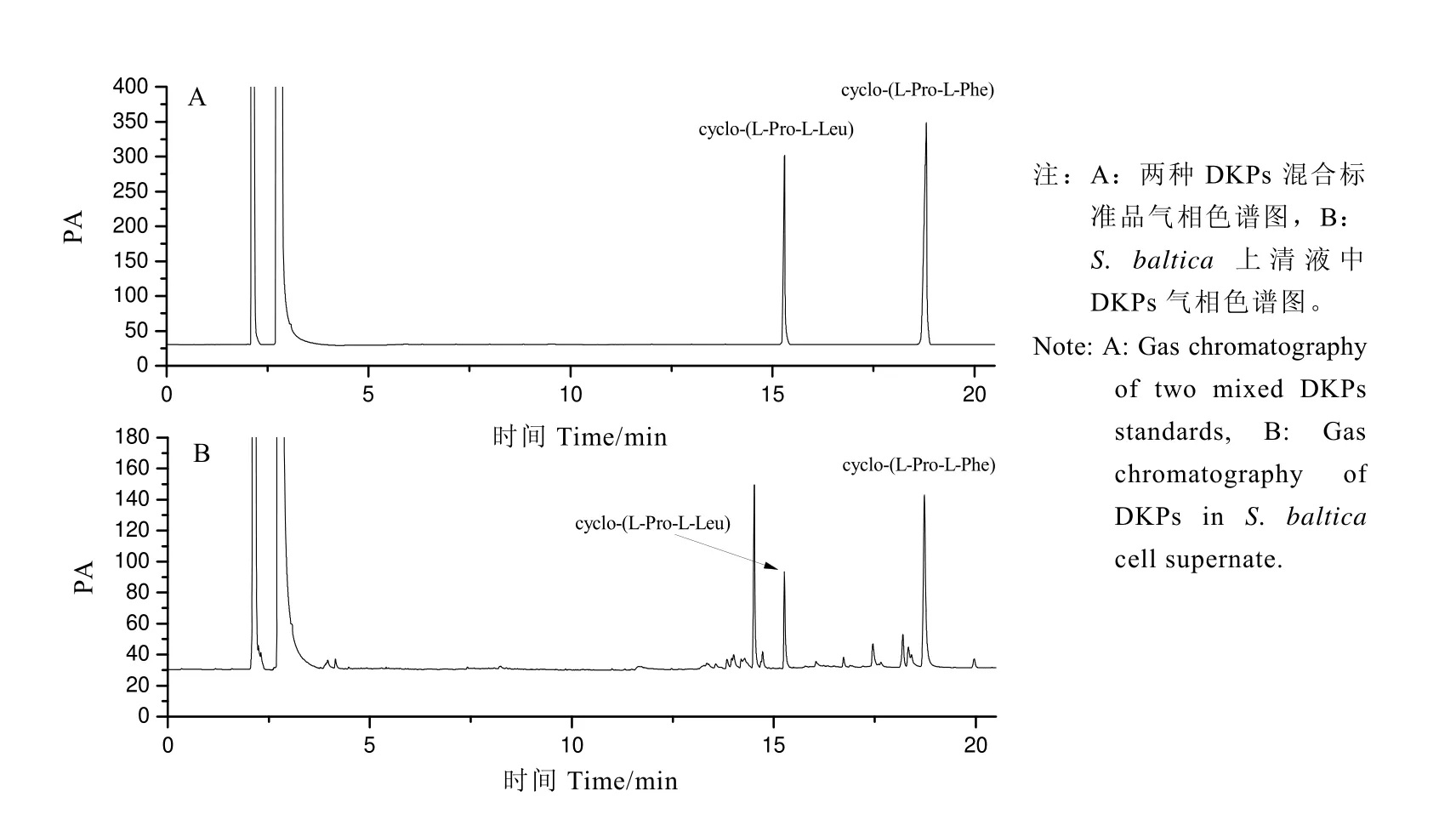
圖4 DKPs混合標準品和S.baltica上清液中DKPs氣相色譜圖Fig.4 Gas chromatography of DKPs mixed standards and DKPs in S.baltica cell supernate
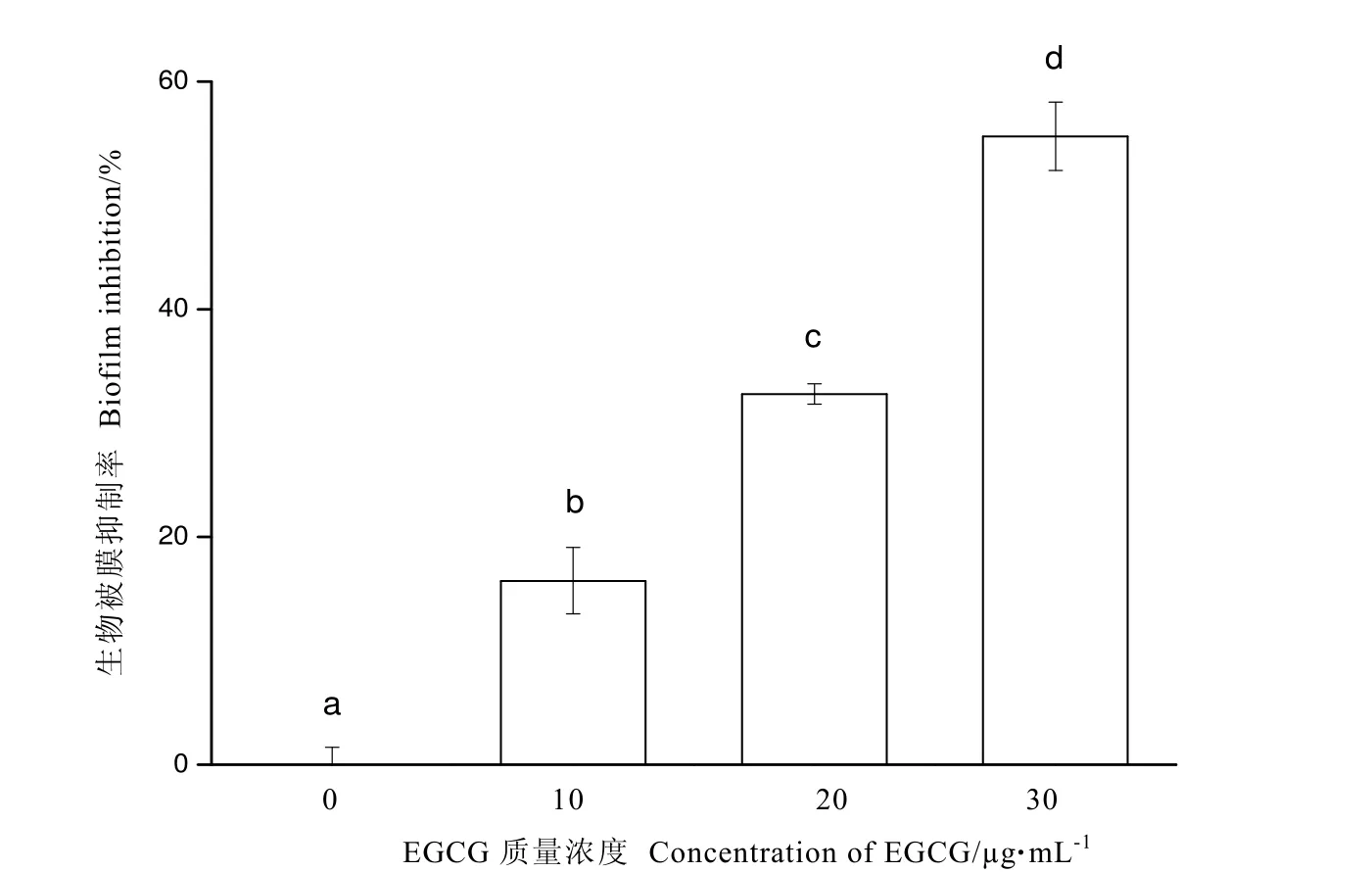
圖5 亞抑菌濃度EGCG對S.baltica生物被膜的影響Fig.5 Effect of EGCG at sub-MIC on biofilm development of S.baltica
2.7 EGCG抑制S.baltica胞外蛋白酶活性
采用脫脂奶平板法初步評價S.baltica蛋白酶活性。如圖7所示,S.baltica對照組在脫脂奶平板上形成的水解透明圈直徑約有(30±0.2)mm,而添加10、20、30 μg·mL-1EGCG的脫脂奶平板中,形成的水解透明圈直徑明顯減小,分別為(30±0.2)mm、(22±0.2)mm、(16±0.2)mm,抑制率最大達到46.67%。提示亞抑菌濃度的EGCG能夠有效抑制S.baltica胞外蛋白酶活性,并且也呈現濃度依賴性。
3 討論
S.baltica是多種海產品中的特定腐敗菌,生物被膜和QS系統在其腐敗過程中起著重要作用,因此急需尋找一種良好的抗S.baltica生物被膜及抗QS活性的物質。本研究發現茶多酚5種單體在亞抑菌濃度下均表現出一定的生物被膜抑制作用,其中EGCG抑制能力最強。Asahi等[19]也發現EGCG能夠有效抑制生物被膜形成,其中10 μg·mL-1的EGCG亞抑菌濃度對牙齦卟啉單胞菌(Porphyromonas gingivalis)生物被膜抑制率達到60%。
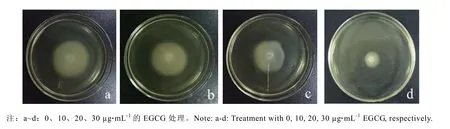
圖6 不同濃度EGCG對S.baltica游動能力影響Fig.6 Effect of EGCG at sub-MIC on swimming motility of S.baltica
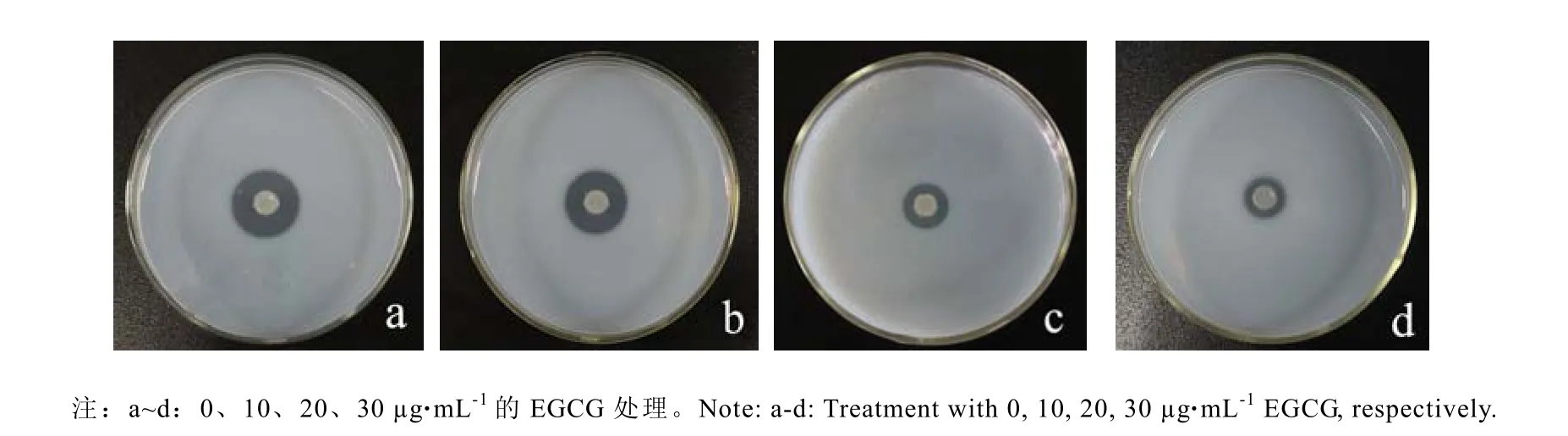
圖7 不同濃度EGCG對S.baltica胞外蛋白酶活性的影響Fig.7 Effect of EGCG at sub-MIC on exoprotease activity of S.baltica
信號分子是細菌QS系統中的重要組成部分。本研究發現亞抑菌濃度下EGCG對S.baltica的AI-2和DKPs化合物[cyclo-(L-Pro-L-Phe)和cyclo-(L-Pro-L-Leu)]信號分子均有顯著抑制,特別是抑制AI-2活性。Lee等[11]報道在亞抑菌濃度下(25 μg·mL-1)的EGCG對大腸桿菌(Escherichia coli)O157:H7 AI-2的抑制率達到了85%。然而,EGCG對細菌DKPs的抑制報道仍較少。許多植物提取物在亞抑菌濃度下均有QS抑制活性,如姜黃素、肉桂醛等,通過減少胞外上清液中信號分子的含量,以達到減弱致病菌毒力或腐敗菌腐敗能力的目的[10,12]。
生物被膜的形成與細菌QS密切相關。本研究表明S.baltica經EGCG處理后,其生物被膜的形成受到顯著抑制,并且其抑制效果呈現明顯的濃度依賴效應。該趨勢與S.baltica信號分子的抑制呈現一定相關性,提示了EGCG對S.baltica生物被膜形成的抑制可能通過干擾QS系統實現。Packiavathy等[10]也報道姜黃素抗生物被膜與QS干擾能力存在相關性。鞭毛調控的泳動能力參與細菌在介質表面粘附,與生物被膜的形成聯系緊密,并且在腐敗過程中也起著重要的作用[20]。研究發現,EGCG對S.baltica游動能力具有很強的抑制作用,推測EGCG可能影響S.baltica粘附至介質表面,減少生物被膜的形成。Niu等[21]也發現肉桂醛能夠通過干擾大腸桿菌的泳動能力來減少生物被膜的形成。研究認為細菌的泳動能力受QS系統的調控[22],并且通過干擾細菌QS系統可以減弱細菌的泳動性。Rader 等[23]發現敲除幽門螺桿菌的LuxS基因能顯著抑制由AI-2調控的泳動能力。
胞外蛋白酶活性是評價高蛋白食品中腐敗菌腐敗能力的重要指標。Lokender等[24]報道姜油酮能夠通過減少信號分子的產生以及干擾信號分子受體蛋白等方式干擾銅綠假單胞菌(Pseudomonas aeruginosa)QS系統,從而進一步減弱蛋白酶活性。本研究中也發現,EGCG對S.baltica胞外蛋白酶活性的抑制趨勢與EGCG對信號分子的抑制趨勢相似。因此,推測EGCG可能可以作為QS抑制劑降低S.baltica蛋白酶活性。
綜上所述,研究以QS信號分子為切入點分析EGCG對S.baltica生物被膜和腐敗活性的抑制能力,發現亞抑菌濃度下的EGCG能有效地減少生物被膜形成,降低AI-2和DKPs的活性干擾其QS系統,并顯著抑制細菌泳動性和胞外蛋白酶活性等腐敗表型。本研究為富含EGCG的植物多酚在海產品腐敗菌調控和貯藏保鮮中的應用奠定一定的理論基礎。
參考文獻
[1]張雯,倪莉,呂旭聰,等.大黃魚鮮度評價及鮮度與細菌菌群的關系[J].中國食品學報,2013,13(7):181-188.
[2]Vogel B,Venkateswaran K,Satomi M,et al.Identification of Shewanella baltica as the most important H2S-producing species during iced storage of danish marine fish[J].Applied Environmental Microbiology,2005,71(11):6689-6697.
[3]Simoes M,Simoes L C,Vieira M J.Species association increases biofilm resistance to chemical and mechanical treatments[J].Water Research,2009,43(1):229-237.
[4]鄧旗,孫力軍,王雅玲,等.環境條件對腐敗希瓦氏菌生物被膜形成能力的影響[J].中國食品學報,2013,13(10):43-50.
[5]Novak E A,Shao H J,Daep C A,et al.Autoinducer-2 and QseC control biofilm formation and in vivo virulence of Aggregatibacter actinomycetemcomitans[J].Infection and Immunity,2010,78(7):2919-2926.
[6]Zhu S,Wu H,Zeng M,et al.The involvement of bacterial quorum sensing in the spoilage of refrigerated Litopenaeus vannamei[J].International Journal of Food Microbiology,2015,192:26-33.
[7]Ng W L,Bassler B L.Bacterial quorum-sensing network architectures[J].Annual Review of Genetics,2009,43:197-222.
[8]Waters C M,Bassler B L.Quorum sensing:cell-to-cell communication in bacteria[J].Annual Review of Cell and Developmental Biology,2005,21:319-346.
[9]Gu Q,Fu L,Wang Y,et al.Identification and characterization of extracellular cyclic dipeptides as quorum-sensing signal molecules from Shewanella baltica,the specific spoilage organism of Pseudosciaena crocea during 4℃ storage[J].Journal of Agriculture and Food Chemistry,2013,61(47):11645-11652.
[10]Packiavathy I A,Sasikumar P,Pandian S K,et al.Prevention of quorum-sensing-mediated biofilm development and virulence factors production in Vibrio spp.by curcumin[J].Applied Microbiology and Biotechnology,2013,97(23):10177-10187.
[11]Lee K M,Kim W S,Lim J,et al.Antipathogenic properties of green tea polyphenol epigallocatechin gallate at concentrations below the MIC against enterohemorrhagic Escherichia coli O157:H7[J].Journal of Food Protection,2009,72(2):325-331.
[12]Truchado P,Tomás-Barberán F A,Larrosa M,et al.Food phytochemicals act as quorum sensing inhibitors reducing production and/or degrading autoinducers of Yersinia enterocolitica and Erwinia carotovora[J].Food Control,2012,24(1):78-85.
[13]Si W,Gong J,Tsao R,et al.Bioassay-guided purification and identification of antimicrobial components in Chinese green tea extract[J].Journal of Chromatography A,2006,1125(2):204-210.
[14]趙麗萍,邵宛芳.茶葉中EGCG功效研究進展[J].中國農學通報,2007,23(7):143-147.
[15]王慧敏,陸海霞,朱軍莉,等.茶多酚抑制腐敗希瓦氏菌機理研究[J].茶葉科學,2014,34(2):149-155.
[16]趙二科,朱軍莉,馮立芳,等.冷藏大黃魚SSO希瓦氏菌致腐能力差異機制初探[J].水產學報,2015,39(2):274-281.
[17]王艷,程慧娟,朱玲玲,等.魚腥草素鈉對銅綠假單胞菌生物被膜的影響[J].食品科學,2013,34(11):173-178.
[18]趙二科,黃旭鎮,朱軍莉,等.冷藏大黃魚腐敗菌群和群體感應信號分子的動態變化規律[J].中國食品學報,2015,15(4):175-181.
[19]Asahi Y,Noiri Y,Miura J,et al.Effects of the tea catechin epigallocatechin gallate on Porphyromonas gingivalis biofilms[J].Journal of Applied Microbiology,2014,116(5):1164-1171.
[20]梁慧,周明旭,朱國強,等.鞭毛對F18+大腸桿菌體外生物被膜形成影響的研究[J].中國預防獸醫學報,2014,36(8):624-627.
[21]Niu C,Gilbert E.Colorimetric method for identifying plant essential oil components that affect biofilm formation and structure[J].Applied Environmental Microbiology,2004,70(12):6951-6956.
[22]Atkinson S,Chang C Y,Sockett R E,et al.Quorum sensing in Yersinia enterocolitica controls swimming and swarming motility[J].Journal of Bacteriology,2006,188(4):1451-1461.
[23]Rader B A,Wreden C,Hicks K G,et al.Helicobacter pylori perceives the quorum-sensing molecule AI-2 as a chemorepellent via the chemoreceptor TlpB[J].Microbiology,2011,157(9):2445-2455.
[24]Lokender K,Sanjay C,Rajnish K,et al.Zingerone silences quorum sensing and attenuates virulence of Pseudomonas aeruginosa[J].Fitoterapia,2015,102:84-95.
Inhibition of Biofilm Development and Spoilage Potential in Shewanella baltica by Epigallocatechin Gallate
YE Xiaofeng,ZHANG Fang,ZHU Junli*,ZHANG Lei,XIE Dumei
College of Food Science and Biotechnology,Zhejiang Gongshang University,Hangzhou 310035,China
Abstract:The anti-biofilm activity of catechin monomers from tea polyphenols against S.baltica,as the specific spoilage organism in marine product,was investigated.Effects of catechin monomer with the highest inhibitory activity on biofilm formation and spoilage potential of S.baltica were further assessed.The results showed that all five monomer of catechins significantly repressed biofilm formation of S.baltica,in which epigallocatechin gallate(EGCG)exhibited the highest activity.The minimum inhibitory concentration(MIC)of EGCG against S.baltica was 40 μg·mL(-1),and EGCG at the sub-inhibitory concentration of 10-30 μg·mL(-1)had no effect on its growth.EGCG at 30 μg·mL(-1)inhibited significantly the activity of quorum sensing(QS)autoinducers,AI-2,cyclo-(L-Pro-L-Leu)and cyclo-(L-Pro-L-Phe)(P<0.05),with reduction by 63.95%,27.43% and 21.94% respectively.The biofilm development,swimming motility and protease activity also decreased considerably after incubation with sub-MIC of EGCG,and exhibited a dose dependent effect,which presented the reduction by 55.18%,66.71% and 46.67% in thebook=202,ebook=95presence of 30 μg·mL(-1)EGCG.Hence,our results indicated that the sub-MIC of EGCG could interfere with S.baltica QS system,and inhibit the biofilm formation and spoilage potential of S.baltica.The present study suggested the potential of EGCG as QS inhibitor in controlling food spoilage bacterial.
Keywords:Shewanella baltica,EGCG,biofilm,spoilage,quorum sensing,inhibition
作者簡介:葉曉鋒,男,碩士研究生,主要從事水產品品質與安全控制研究。*通訊作者:junlizhu0305@163.com
基金項目:國家自然科學基金(31271954)、浙江省自然科學基金(LY15C200001)、研究生創新項目(14060101014)。
收稿日期:2015-11-23
修訂日期:2015-12-16
中圖分類號:TS272;Q946.84+1
文獻標識碼:A
文章編號:1000-369X(2016)02-201-09

