補(bǔ)腎活血固齒方對MC3T3-E1細(xì)胞BMP2表達(dá)及TRPV5/TRPV6通道影響的實(shí)驗(yàn)研究
高 毅,穆春暉,刁志虹,李 敏,王雙雙,楊 琳(⒈河北省中醫(yī)院口腔科,河北 石家莊 05007;.北京市東城區(qū)第一人民醫(yī)院口腔科,北京 0000;3.河北省石家莊市第一醫(yī)院口腔科,河北 石家莊 0500)
?
·論著·
補(bǔ)腎活血固齒方對MC3T3-E1細(xì)胞BMP2表達(dá)及TRPV5/TRPV6通道影響的實(shí)驗(yàn)研究
高毅1,穆春暉2,刁志虹3*,李敏1,王雙雙1,楊琳1(⒈河北省中醫(yī)院口腔科,河北 石家莊 050017;2.北京市東城區(qū)第一人民醫(yī)院口腔科,北京 100010;3.河北省石家莊市第一醫(yī)院口腔科,河北 石家莊 050011)
[摘要]目的觀察補(bǔ)腎活血固齒方對小鼠顱頂前成骨細(xì)胞(MC3T3-E1細(xì)胞)骨形態(tài)發(fā)生蛋白2(bone morphogenetic protein 2,BMP2)表達(dá)及TRPV5/TRPV6通道的影響,探討補(bǔ)腎活血固齒方成骨的作用機(jī)制。方法按體表面積折算等效劑量的補(bǔ)腎活血固齒方灌胃大鼠,制備含藥血清;等劑量生理鹽水灌胃大鼠,制備無藥血清作為對照。用10%含藥血清、無藥血清分別培養(yǎng)MC3T3-E1細(xì)胞24、48、72 h,RT-PCR法檢測MC3T3-E1細(xì)胞BMP2、TRPV5/TRPV6 mRNA的表達(dá)。結(jié)果含藥血清組MC3T3-E1細(xì)胞的BMP2、TRPV6 mRNA表達(dá)量較無藥血清組增加(P<0.05),且隨時間延長有逐漸增加趨勢,但差異無統(tǒng)計(jì)學(xué)意義(P>0.05)。含藥血清組和無藥血清組MC3T3-E1細(xì)胞中均未檢測到TRPV5 mRNA的表達(dá)。結(jié)論補(bǔ)腎活血固齒方可能是通過鈣離子通道TRPV6上調(diào)BMP2的表達(dá)、誘導(dǎo)成骨細(xì)胞分化的。
[關(guān)鍵詞]牙周疾病;補(bǔ)腎活血固齒方;實(shí)時聚合酶鏈反應(yīng)
doi:10.3969/j.issn.1007-3205.2016.03.009
牙周炎是以牙周袋形成、袋壁炎癥、牙槽骨進(jìn)行性吸收和破壞、牙齒松動為主要癥狀的口腔常見病、多發(fā)病,牙周炎不僅導(dǎo)致成人牙齒過早喪失,并可誘發(fā)各種全身性疾病,嚴(yán)重影響其健康。中醫(yī)運(yùn)用中藥,尤其是補(bǔ)腎中藥治療牙周炎引起的牙齒松動有著悠久歷史。根治牙周炎的關(guān)鍵是通過成骨細(xì)胞和破骨細(xì)胞的調(diào)節(jié)作用阻止牙槽骨吸收或促進(jìn)牙槽骨的再生,成骨細(xì)胞在這一過程中發(fā)揮重要作用。成骨細(xì)胞表達(dá)的骨形態(tài)發(fā)生蛋白(bone morphogenetic proteins, BMPs)是骨修復(fù)中最主要的誘導(dǎo)因子,其亞型BMP2的誘導(dǎo)成骨能力較為明顯,BMP2通過Smads和p38MAPK信號通路促進(jìn)成骨細(xì)胞表達(dá)多種特異性成骨因子如堿性磷酸酶(alkaline phosphatase, ALP)、骨鈣素(osteocalcin,OCN),產(chǎn)生相應(yīng)蛋白分泌到細(xì)胞外基質(zhì)中,使細(xì)胞外基質(zhì)礦化,進(jìn)而完成成骨。鈣離子通道TRPV5/TRPV6通過調(diào)節(jié)成骨細(xì)胞內(nèi)鈣離子含量的變化,激活p38MAPK通路,促進(jìn)成骨細(xì)胞分化。本研究采用中藥血清體外培養(yǎng)小鼠顱頂前成骨細(xì)胞(MC3T3-E1細(xì)胞),觀察補(bǔ)腎活血固齒方對細(xì)胞BMP2及TRPV5/TRPV6通道表達(dá)的影響,探討補(bǔ)腎活血固齒方對成骨細(xì)胞分化的作用機(jī)制,旨在為臨床用藥提供理論依據(jù)。
1材料與方法
1.1實(shí)驗(yàn)動物清潔級健康雄性SD系大鼠20只,體質(zhì)量280~300 g,由河北省實(shí)驗(yàn)動物中心提供(實(shí)驗(yàn)動物許可證號:冀醫(yī)動管字號1312020)。飼養(yǎng)條件:室溫保持在18~25 ℃,空氣流通,12 h維持光照,動物在籠中自由攝食飲水。
1.2中藥制備淫羊藿15 g、補(bǔ)骨脂15 g、熟地黃10 g、當(dāng)歸10 g、丹參10 g、知母10 g、甘草3 g。藥物加10倍量蒸餾水煎煮1.5 h過濾,加同量蒸餾水重煎1.5 h過濾,合并濾液濃縮至150 mL裝袋備用(含生藥量 0.487 g/mL)。
1.3細(xì)胞株小鼠顱頂前成骨細(xì)胞亞克隆14 (MC3T3-E1 Subclone14),購自中國科學(xué)院上海細(xì)胞庫 (ATCC CRL-2594)。
1.4主要試劑和儀器α-MEM培養(yǎng)基(GIBCO公司),胎牛血清(PAA Laboraties GmbH),葉酸(Amresco), β-疏基乙醇(北京鼎國生物技術(shù)有限責(zé)任公司),肌醇(北京索萊寶科技股份有限公司),胰酶(Amresco),乙二胺四乙酸(ethylene diamine totraacetic acid,EDTA)(天津市永大化學(xué)試劑開發(fā)公司),戊巴比妥(華北制藥股份有限公司),TAE緩沖液(Solarbio公司),溴化乙錠(ethidium bromide,EB)(Solarbio公司),瓊脂糖(Solarbio公司),Trizol(Solarbio公司),反轉(zhuǎn)錄試劑盒(Invitrogen公司),PCR SuperMix擴(kuò)增試劑盒(Invitrogen公司),100 bp DNA Ladder(TANGEN)。HF240二氧化碳培養(yǎng)箱(上海力申科學(xué)儀器有限公司),BSC-1100ⅡA2生物安全柜(北京東聯(lián)哈爾儀器制造有限公司),TE2000-U熒光倒置顯微鏡(NiKon),B40型醫(yī)用低速離心機(jī)(安新縣白洋離心機(jī)廠),D-37520高速離心機(jī)(Thermo ELECTRON CORPORATION),HKA-A2450-230精密電子天平(BEL Engineering),DDY-7C型電泳儀(北京市六一儀器廠),一體化凝膠成像分析儀(北京賽智創(chuàng)業(yè)科技有限公司),96孔PCR儀(Applied Biosystems)。
1.5血清制備20只SD大鼠按隨機(jī)數(shù)字表法分為含藥血清組和無藥血清組,每組10只。含藥血清組的血清制備:補(bǔ)腎活血固齒方經(jīng)煎制后,按體表面積折算等效劑量,0.487 g(生藥)/kg(體質(zhì)量)計(jì)算用藥量。SD大鼠10只每日灌胃2次,連續(xù)灌胃7 d,第7天第2次灌胃后間隔2 h再次灌胃,末次灌胃1 h后,腹主動脈取血,3 000 r/min離心20 min,取上清,56 ℃水浴滅活30 min,抽濾除菌后,-20 ℃保存?zhèn)溆谩o藥血清組的血清來自等劑量生理鹽水灌胃的大鼠,灌胃操作及血清制備方法同前。
1.6細(xì)胞培養(yǎng)MC3T3-E1細(xì)胞培養(yǎng)于α-MEM培養(yǎng)基(含10%胎牛血清,100 U/mL青霉素,100 g/L鏈霉素),5% CO2,95%濕度,恒溫37 ℃的細(xì)胞培養(yǎng)箱中培養(yǎng),每3 d換液1次,1周左右細(xì)胞基本鋪滿瓶底后傳代。吸去原培養(yǎng)液,PBS溶液清洗2遍,0.25%胰酶1 mL,37 ℃消化1 min,鏡下觀察細(xì)胞收縮,變圓,α-MEM培養(yǎng)基1.5 mL終止消化,反復(fù)吹打細(xì)胞,使其懸浮,移至離心管,1 000 r/min離心5 min,吸去上清液,加入適量α-MEM培養(yǎng)基,混懸細(xì)胞,每個培養(yǎng)瓶接種細(xì)胞30 000個。
1.7RT-PCR法檢測MC3T3-E1細(xì)胞中BMP2、TRPV5/TRPV6 mRNA的表達(dá)
1.7.1分組按“1.6”方法培養(yǎng)細(xì)胞2 d后分別換用含藥血清(培基含10%含藥血清)和無藥血清(培基含10%無藥血清),繼續(xù)培養(yǎng)24、48、72 h,分別檢測不同時間點(diǎn)MC3T3-E1細(xì)胞BMP2、TRPV5/TRPV6 mRNA的表達(dá)。
1.7.2細(xì)胞總RNA的提取每瓶細(xì)胞,倒掉培基,PBS洗2遍,加入Trizol試劑1 mL,吹打混勻細(xì)胞,加入大EP管,冰上靜置10 min。加入氯仿200 μL,劇烈振蕩12 s,冰上靜置3 min,4 ℃,12 000 r/min離心15 min。吸取上層無色液相加入新的EP管中。新EP管加入500 μL異丙醇,混勻,冰上靜置10 min。12 000 r/min離心10 min,棄上清。EP管中加入1 mL 75%乙醇,振蕩使沉淀懸浮,靜置1 min。9 000 r/min離心10 min。吸干剩余乙醇。白色透明狀沉淀加入去核酶水20 μL,吹打混勻即為提取的總RNA,-20 ℃保存。
1.7.3逆轉(zhuǎn)錄反應(yīng)分別取各樣品總RNA 5 μg,使用逆轉(zhuǎn)錄試劑盒進(jìn)行逆轉(zhuǎn)錄,所得溶液即為cDNA,置冰浴待用。
1.7.4擴(kuò)增反應(yīng)TRPV5、TRPV6、BMP2、GAPDH引物序列及反應(yīng)條件,見表1。

表1 TRPV5、TRPV6、BMP2、GAPDH引物序列及反應(yīng)條件
1.7.5產(chǎn)物檢測PCR產(chǎn)物1 μL與5×100 bp DNA Ladder 5μL混勻加入瓊脂糖膠孔, 110 mV電壓電泳40 min,自動凝膠成像分析儀進(jìn)行輝度掃描并觀察拍照,QuatityOne軟件進(jìn)行輝度值比較。以GAPDH作為內(nèi)對照,計(jì)算TRPV5、TRPV6、BMP2的相對含量,結(jié)果以TRPV5、TRPV6、BMP2條帶灰度值占GAPDH條帶灰度值的百分率表示mRNA的表達(dá)量。
1.8統(tǒng)計(jì)學(xué)方法應(yīng)用SPSS 13.0統(tǒng)計(jì)學(xué)軟件進(jìn)行數(shù)據(jù)分析,計(jì)量資料比較分別采用t檢驗(yàn)和F檢驗(yàn)。P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2結(jié)果
2.1RT-PCR法檢測BMP2 mRNA表達(dá)2組MC3T3-E1細(xì)胞中均有BMP2 mRNA表達(dá),且表達(dá)量隨時間的延長有增加趨勢,但組內(nèi)24、48、72 h之間差異無統(tǒng)計(jì)學(xué)意義(P>0.05);而含藥血清組24、48、 72 h BMP2 mRNA表達(dá)量均較無藥血清組高,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。見表2。
表22組不同時間BMP2 mRNA表達(dá)比較
Table 2BMP2 mRNA expression level at different time
points in two groups

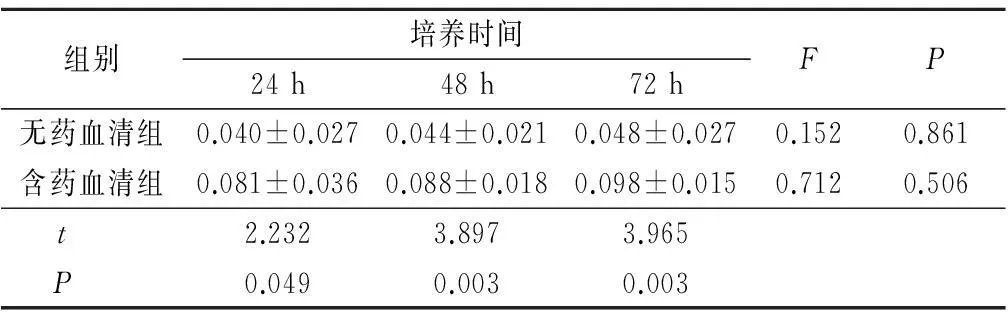
組別培養(yǎng)時間24h48h72hFP無藥血清組0.040±0.0270.044±0.0210.048±0.0270.1520.861含藥血清組0.081±0.0360.088±0.0180.098±0.0150.7120.506t 2.2323.8973.965P 0.0490.0030.003
2.2RT-PCR法檢測TRPV5/TRPV6 mRNA表達(dá)2組MC3T3-E1細(xì)胞中均無TRPV5 mRNA表達(dá)。2組MC3T3-E1細(xì)胞中均有TRPV6 mRNA表達(dá),且表達(dá)量均隨時間的延長有逐漸增加趨勢,但組內(nèi)24、48、72 h之間差異無統(tǒng)計(jì)學(xué)意義(P>0.05);而含藥血清組24、48和72 h TRPV6 mRNA表達(dá)量均較無藥血清組高,差異有統(tǒng)計(jì)學(xué)意義(P<0.01)。見表3。
表32組不同時間TRPV6 mRNA表達(dá)比較
Table 3TRPV6 mRNA expression level at different time
points in two groups
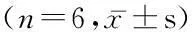
組別培養(yǎng)時間24h48h72hFP無藥血清組0.094±0.0310.106±0.0230.115±0.0290.8570.444含藥血清組0.292±0.0690.301±0.0420.311±0.0360.2080.815t 6.4129.97510.380P 0.0000.0000.003
3討論
“血清藥理學(xué)”由田代真一于1988年提出,原理是使用中藥或中藥復(fù)方給動物灌服一定時間后采集、分離動物血清,用含有藥物成分的血清進(jìn)行體外實(shí)驗(yàn)的一種半體內(nèi)實(shí)驗(yàn)方法[1]。該方法可有效防止中藥制劑自身理化性質(zhì)對實(shí)驗(yàn)的干擾,反映中藥在胃腸道內(nèi)的消化吸收、生物轉(zhuǎn)化、產(chǎn)生藥效的真實(shí)過程,克服了中藥制劑的體內(nèi)代謝物或機(jī)體反應(yīng)物等有效成分引起的假陰性和機(jī)體非吸收物的體外作用造成的假陽性[2],客觀模擬了藥物與機(jī)體的相互作用,代表了藥物在體內(nèi)產(chǎn)生作用的真正有效成分。
BMPs是促進(jìn)骨形成和誘導(dǎo)成骨細(xì)胞分化的重要細(xì)胞因子[3]。BMPs可以誘導(dǎo)前成骨細(xì)胞向成骨細(xì)胞分化,誘導(dǎo)未定型和定型的成骨細(xì)胞經(jīng)過趨化、分裂、分化等過程,不可逆的分化成骨[4]。BMPs的亞型BMP2的誘導(dǎo)成骨能力較為明顯,研究表明BMP2通過Smads和p38MAPK信號通路調(diào)控成骨細(xì)胞分化,BMP2與Ⅱ型受體(type Ⅱ bone morphogenetic protein receptor,BMPR-Ⅱ)結(jié)合后磷酸化Ⅰ型受體(BMPR-Ⅰ),磷酸化的BMPR-Ⅰ進(jìn)一步磷酸化與BMPs特異作用的Smads蛋白,Smads蛋白進(jìn)入細(xì)胞核后通過增加特異性轉(zhuǎn)錄因子Runx2的表達(dá)促進(jìn)ALP合成,進(jìn)而促進(jìn)成骨細(xì)胞分化[5-6]。BMP2也可以與BMPR-Ⅰ形成復(fù)合體,復(fù)合體與橋蛋白作用,介導(dǎo)下游信號分子TAB1的活化,活化的TAB1激活TAK1信號途徑,TAK1信號途徑進(jìn)而激活p38MAPK通路,從而促進(jìn)成骨細(xì)胞表達(dá)ALP[7-8]。ALP是骨形成所必需的酶,ALP 的表達(dá)標(biāo)志成骨細(xì)胞分化的開始,ALP活性是成骨細(xì)胞功能及分化程度的指標(biāo)[9-10]。ALP表達(dá)升高是啟動礦化的必備條件,作用是水解磷酸酯為沉積羥基磷灰石提供必要的磷酸,水解焦磷酸鹽,解除其對礦物質(zhì)形成的抑制作用,從而促進(jìn)羥磷灰石的形成,促進(jìn)細(xì)胞成熟、鈣化[11-12]。本研究結(jié)果顯示,含藥血清和無藥血清培養(yǎng)的MC3T3-E1細(xì)胞均有BMP2 mRNA表達(dá),含藥血清BMP2 mRNA表達(dá)量較無藥血清高。表明含藥血清可顯著地增加BMP2 mRNA的表達(dá)水平。因此,認(rèn)為補(bǔ)腎活血固齒方可通過提高BMP2 mRNA表達(dá)水平誘導(dǎo)MC3T3-E1細(xì)胞的成骨分化。
TRPV5/TRPV6通道是高選擇性鈣離子通道,細(xì)胞內(nèi)鈣離子濃度較低時,鈣離子通過該通道進(jìn)入細(xì)胞,參與多種信號通路調(diào)控成骨細(xì)胞的分化、成熟以及骨的形成[13]。Hoenderop等[14]研究表明,TRPV5/TRPV6通道通過調(diào)節(jié)成骨細(xì)胞內(nèi)鈣離子含量的變化,調(diào)節(jié)p38MAPK信號通路,最終調(diào)節(jié)成骨細(xì)胞增殖及骨代謝;p38MAPK通路可以調(diào)節(jié)成骨細(xì)胞分化過程中ALP的表達(dá),促進(jìn)成骨細(xì)胞分化成熟。本研究發(fā)現(xiàn)含藥血清和無藥血清培養(yǎng)的MC3T3-E1細(xì)胞中均有TRPV6 mRNA表達(dá),且表達(dá)量均隨時間的延長而增加,含藥血清組的表達(dá)量較無藥血清高(P<0.05);而含藥血清及無藥血清培養(yǎng)的MC3T3-E1細(xì)胞中均未檢測到TRPV5 mRNA的表達(dá)。李富春等[15]實(shí)驗(yàn)發(fā)現(xiàn),大鼠成骨細(xì)胞分化過程中 TRPV5/TRPV6 通道均有不同程度陽性表達(dá),且TRPV5/TRPV6 的表達(dá)隨誘導(dǎo)分化時間的延長逐漸增強(qiáng)。van der Eerden等[16]在人股骨分離的成骨細(xì)胞中沒有檢測到TRPV5 mRNA。這些研究結(jié)果與本研究結(jié)果相符,但這些結(jié)果無法確定TRPV5通道在MC3T3-E1細(xì)胞中不存在,TRPV5 mRNA的表達(dá)是否存在窗口期或者需要特定的激活條件,需要進(jìn)一步研究。
本研究結(jié)果表明,補(bǔ)腎活血固齒方可提高M(jìn)C3T3-E1細(xì)胞中BMP2、TRPV6 mRNA的表達(dá)水平,進(jìn)而通過p38MAPK信號通路調(diào)節(jié)成骨細(xì)胞分化和骨代謝。
[參考文獻(xiàn)]
[1]韋振源.中藥血清藥理學(xué)在藥效研究中的應(yīng)用[J].北方藥學(xué),2012,9(9):31-33.
[2]米永杰,李健.中藥血清藥理學(xué)研究概述[J].四川解剖學(xué)雜志,2006,14(4):34-35.
[3]Chenard KE,Teven CM,He TC,et al. Bone morphogenetic proteins in craniofacial surgery: current techniques,clinical experiences,and the future of personalized stem cell therapy[J]. J Biomed Biotechnol,2012,2012:601549.
[4]朱曉峰,張榮華,孫升云,等.淫羊藿素通過雌激素受體和骨形態(tài)發(fā)生蛋白信號誘導(dǎo)MC3T3-E1 subclone 14細(xì)胞分化[J].中國病理生理雜志,2011,27(12):2351-2356.
[5]Li W,Dunmore BJ,Morrell NW. Bone morphogenetic protein type Ⅱ receptor mutations causing protein misfolding in heritable pulmonary arterial hypertension[J]. Proc Am Thorac Soc,2010,7(6):395-398.
[6]Conidi A,Cazzola S,Beets K,et al. Few Smad proteins and many Smad-interacting proteins yield multiple functions and action modes in TGFβ/BMP signaling in vivo[J]. Cytokine Growth Factor Rev,2011,22(5/6):287-300.
[7]黃潔,程云英.大鼠成骨細(xì)胞的體外培養(yǎng)和生物學(xué)特性的研究[J].南京鐵道醫(yī)學(xué)院學(xué)報,2000,19(2):88-90.
[8]陳坤,高飛.Wnt信號通路對Vaspin誘導(dǎo)大鼠骨髓間充質(zhì)干細(xì)胞成骨分化的影響[J].中國臨床研究,2015,28(11):1415-1417,1421.
[9]Pagani F,Francucci CM,Moro L. Markers of bone turnover:biochemical and clinical perspectives[J]. J Endocrinol Invest,2005,28(10 Suppl):8-13.
[10]高杰,張吉霞.淫羊藿苷在口腔分子生物學(xué)及細(xì)胞生理學(xué)研究進(jìn)展[J].口腔醫(yī)學(xué)研究,2015,31(10):1053-1056.
[11]甕媛媛,續(xù)惠云,安龍,等.骨樣細(xì)胞MLO-Y4與成骨樣細(xì)胞MC3T3-E1生物學(xué)特性的比較[J].中國細(xì)胞生物學(xué)學(xué)報,2010,32(2):261-267.
[12]Chen D,Ji X,Harris,MA,et al.Differential roles for bone morphogenetic protein(BMP) receptor type IB and IA in differeniiation and specification of mesenehymal precursor cells to osteoblast and adipocyte lineages[J]. J Cell Biol,1998,142(1):295-305.
[13]那健,馬超,霍維玲,等.新型Ca2+通道TVRP5和TVRP6的研究[J].吉林大學(xué)學(xué)報:醫(yī)學(xué)版,2013,39(3):634-638.
[14]Hoenderop JG,Müller D,Van Der Kemp AW,et al. Calcitriol controls the epithelial calcium channel in kidney [J]. J Am Soc Nephrol,2001,12(7):1342-1349.
[15]李福春,谷貴山,孫大輝,等.新型鈣離子通道 TRPV5 和 TRPV6 與成骨細(xì)胞信號傳遞的關(guān)系[J].吉林大學(xué)學(xué)報:醫(yī)學(xué)版,2007,33(3):600-603.
[16]van der Eerden BC,Hoenderop JG,de Vries TJ,et al. The epithelial Ca2+channel TRPV5 is essential for proper osteoclastic bone resorption[J]. Proc Natl Acad Sci U S A,2005,102(48):17507-17512.
(本文編輯:許卓文)
The experimental study of effects of Bushen Huoxue Guchi formula on BMP2 and TRPV5/TRPV6 channels expressions in MC3T3-E1 cells
GAO Yi1, MU Chun-hui2, DIAO Zhi-hong3*, LI Min1,WANG Shuang-shuang1, YANG Lin1
(1.Department of Stomatology, the Hospital of Traditional Chinese Medicine, Hebei Province, Shijiazhuang 050017, China; 2.Department of Stomatology,the First People′s Hospital of Beijing Dongcheng District, Beijing100010, China; 3.Department of Stomatology,the First Hospital of Shijiazhuang City,Hebei Province, Shijiazhuang 050011, China)
[Abstract]ObjectiveTo observe the effect of Bushen Huoxue Guchi Formula on bone morphogenetic protein 2(BMP2) and TRPV5/TRPV6 channel expressions, and to explore the mechanism of Bushen Huoxue Guchi Formula in bone formation. MethodsHerb-contained serum was prepared from rats by gavage with Bushen Huoxue Guchi Formula by using body surface area converted equivalent dose. Blank-contained serum as control group was prepared by gavage with normal saline. The BMP2 and TRPV5/TRPV6 mRNA expressions were detected in MC3T3-E1 cells by RT-PCR after the cells were treated with 10% herb-contained serum or blank-contained serum for 24 h, 48 h and 72 h, respectively. ResultsBMP2, TRPV6 mRNA were significantly increased in herb-contained serum treatment group compared with blank-contained serum treatment group(P<0.05). With the prolongation of time, the mRNA expression of BMP2 and TRPV6 had a gragually increased tendency, but there was no statistically significant difference(P>0.05). TRPV5 mRNA was not detected either in herb-contained serum treatment group or blank-contained serum treatment group. ConclusionBushen Huoxue Guchi Formula may upregulate BMP2 expression through TRPV6 channels to induce differentiation of osteoblast.
[Key words]periodontal diseases; Bushen Huoxue Guchi Formula; real-time polymerase chain reaction
[中圖分類號]R781.4
[文獻(xiàn)標(biāo)志碼]A
[文章編號]1007-3205(2016)03-0280-05
[作者簡介]高毅(1965-),女,河北行唐人,河北省中醫(yī)院主任醫(yī)師,醫(yī)學(xué)博士,從事口腔疾病診治研究。*通訊作者。E-mail:yanjingshe651130@163.com
[基金項(xiàng)目]河北省科學(xué)技術(shù)研究與發(fā)展計(jì)劃項(xiàng)目(13277730D);河北省中醫(yī)藥管理局科研計(jì)劃項(xiàng)目(2014028)
[收稿日期]2016-01-29;[修回日期]2016-03-01

