稀土離子摻雜合成LiFePO4/C材料低溫性能研究
李向南,張會雙,曹朝霞,張 瑾,尹艷紅
(1.河南師范大學化學化工學院,河南新鄉453007;2.動力電源及關鍵材料國家地方聯合工程實驗室,河南新鄉453007;3.動力電源及關鍵材料河南省協同創新中心,河南新鄉453007)
稀土離子摻雜合成LiFePO4/C材料低溫性能研究
李向南1,2,3,張會雙1,2,3,曹朝霞1,2,3,張 瑾1,尹艷紅1,2,3
(1.河南師范大學化學化工學院,河南新鄉453007;2.動力電源及關鍵材料國家地方聯合工程實驗室,河南新鄉453007;3.動力電源及關鍵材料河南省協同創新中心,河南新鄉453007)
以Gd2O3作為摻雜化合物,分別采用Fe2O3和FeC2O4·2 H2O作為鐵源固相法合成LiFePO4/C材料。采用X射線衍射(XRD)、掃描電子顯微鏡(SEM)、能量散射光譜(EDS)、LAND電池測試系統及電化學工作站等對材料的晶體結構、形貌和電化學性能進行測試,重點分析了材料的低溫特性。結果表明:以FeC2O4·2 H2O為鐵源合成的LiFePO4/C展示出較好的電化學性能,尤其是低溫性能。25℃下,0.1C、5C首次放電比容量分別為146.1、108.8 mAh/g,-20℃時相同倍率下放電比容量為99.8、73.9 mAh/g,分別為25℃時放電比容量的68.3%和67.9%,具有較好的低溫性能。
LiFePO4/C;稀土摻雜;低溫性能;鋰離子電池
橄欖石型磷酸鐵鋰(LiFePO4)是新一代綠色鋰離子電池正極材料,以其安全無毒、價格低廉、比容量高、循環性能及熱穩定性好等優點,成為鋰離子電池特別是動力鋰離子電池的理想正極材料之一。然而,LiFePO4存在明顯的缺點:該材料的鋰離子擴散速率比較低,嚴重制約了LiFePO4材料的大規模應用。Prosini等[1]通過低阻相的包覆或者與高分子物質共燒有效降低材料的電阻,通過增加材料的比表面積來增大LiFePO4正極材料中鋰離子擴散面積,提高鋰離子的擴散速率。但是這些表面修飾及改性工藝不能顯著提高材料中鋰離子擴散系數,并且較多的添加物反而降低了電極中活性物質含量和能量密度。而通過合適的離子摻雜[2]在晶格中形成空位,增加離子擴散通道,以提高鋰離子在正極材料中的擴散速率,被證明是一種有效的方法。
當然,并不是所有的離子都適合作為摻雜離子,因此在選擇摻雜離子時應考慮一定的影響因素,主要是以下兩個方面:(1)摻雜離子的半徑:摻雜離子半徑的選擇應適中,應與所替代的離子半徑相接近,這樣摻雜離子較容易進入所替代離子的位置;(2)摻雜離子的化合價:摻雜離子的化合價態高,形成的空穴就會越多,有利于離子的通過。
本實驗選用Gd2O3作為摻雜化合物,分別采用Fe2O3和FeC2O4·2H2O作為鐵源,固相法制備正極LiFePO4/C復合材料。分析了不同鐵源摻雜稀土離子合成的LiFePO4材料的微觀形貌和電化學性能,并考察了材料的低溫性能。
1 實驗
1.1 材料的合成
以Li2CO3、Fe2O3、NH4H2PO4(均為分析純)為原料,按化學計量比混合,分別加入預合成LiFePO4摩爾質量1%的稀土化合物Gd2O3和10%的葡萄糖,以乙醇為介質球磨6 h,置于干燥箱內80℃干燥8 h,取出,研磨,在N2保護下,于馬弗爐中350℃保溫4 h,取出,研磨,氮氣氣氛下升溫至700℃保溫2 h,得到LiFePO4/C材料,記為樣品S1。以同樣制備方法不添加稀土元素合成LiFePO4/C材料,記為樣品S0。
以Li2CO3、FeC2O4·2H2O、NH4H2PO4(均為分析純)為原料,按化學計量比混合,分別加入預合成LiFePO4摩爾質量1%的稀土化合物Gd2O3,以乙醇為介質球磨6 h,置于干燥箱內80℃干燥8 h,取出,研磨,在N2保護下,于馬弗爐中450℃保溫4 h,取出,分別加入預合成LiFePO4質量10%的葡萄糖,充分混合均勻后,氮氣氣氛下升溫至700℃保溫2 h,得到LiFe-PO4/C材料,記為樣品Y1。以同樣制備方法不添加稀土元素合成LiFePO4/C材料,記為樣品Y0。
1.2 實驗電池的組裝
在制備的正極材料中加入導電劑乙炔黑,粘結劑聚偏氟乙烯,按質量比80∶10∶10混合均勻,調成漿糊狀,采用涂覆機在鋁箔(0.02 mm)上均勻涂覆,厚度為0.02 mm,真空干燥箱中100℃干燥8 h,6 MPa壓力下壓片,作為工作電極。以金屬鋰片作為對電極及參比電極,隔膜選用Celgard 2400,電解液為1mol/L LiPF6/(DMC+EC)(體積比1∶1),在充滿氬氣的手套箱中組裝實驗電池。
1.3 分析表征
材料的X射線衍射(XRD)測試(管壓40 kV,管流20 mA,Cu靶Kα射線,D8X射線衍射儀,德國布魯克AXS公司);掃描電子顯微鏡(SEM)測試(電壓15 kV,SU-8010,日立);能量散射光譜(EDS)測試(SU-8010/XFlash SVE6);充放電和循環性能測試(CT2001A型LAND電池測試系統,武漢市金諾電子有限公司);交流阻抗(CHI660B型電化學工作站,上海辰華儀器公司);低溫測試(BE-HL-100M8型微電腦恒溫恒濕試驗機,東莞貝爾試驗設備有限公司)。
2 結果與討論
2.1 不同鐵源摻雜Gd3+對LiFePO4/C材料結構及形貌的影響
圖1顯示的是以Fe2O3、FeC2O4·2H2O為鐵源摻雜稀土化合物Gd2O3合成的LiFePO4/C材料的XRD圖譜。樣品S1、Y1分別是添加預合成LiFePO4摩爾質量1%的Gd2O3制備的LiFePO4/C材料,S0、Y0作為對比樣。從圖1中可以看出,四種合成材料與LiFePO4標準比對卡 (JCPDS card no.40-1499)相符,沒有雜質峰。Gd3+的半徑相對較小,較易進入晶格,進入晶格的金屬離子與周圍的金屬離子排斥力較小,有利于原子的有序排列[3],因此摻雜離子的兩個樣品S1、Y1結晶度較高、晶體缺陷較少。

圖1 不同鐵源摻雜稀土離子樣品的XRD圖

圖2 四種樣品的SEM圖
圖2顯示的是四種樣品的SEM圖。圖2(a)是以Fe2O3為鐵源沒有摻雜稀土離子合成的樣品,樣品顆粒大小分布不均勻,粒徑較大,顆粒形貌不規則。圖2(b)是以Fe2O3為鐵源摻雜稀土離子合成的樣品,對比圖2(a)可以看到摻雜Gd3+合成的樣品,一次顆粒粒徑明顯減小,由一次顆粒堆積成的二次顆粒具有較大的表面積,達到微米級。圖2(c)是以FeC2O4·2H2O為鐵源沒有摻雜稀土離子的樣品,顆粒粒徑較小,形貌較為規則,但大小分布不均勻,出現團聚現象。圖2(d)是以FeC2O4· 2H2O為鐵源添加Gd3+合成的樣品,對比其他樣品,該樣品顆粒粒徑最小,達到納米級,顆粒分布最均勻,樣品形貌較好,成類球形,規則的形貌有利于電解液與材料充分接觸,提高活性物質的嵌脫鋰深度;另外,較小的粒徑縮短了鋰離子擴散路徑,減少了電極反應動力學限制,有利于改善材料的電化學性能。由此可見,稀土離子的引入,顯著改善了LiFePO4/C材料顆粒的形貌,減小了顆粒的粒徑。
圖3為樣品S1、Y1的能量散射光譜(EDS)分析,以及C、Gd元素的面分布圖。從兩個樣品的EDS譜圖中可以看到明顯的Fe、P、O、C及Gd元素的特征峰,從C元素和Gd元素的面分布圖可以看出,碳和釓的分布較為均勻,說明固相法能夠將碳和釓比較均勻地分布在LiFePO4材料表面。
2.2 不同鐵源摻雜Gd3+對LiFePO4/C材料電化學性能的影響
圖4為四個樣品S0、S1、Y0、Y1在25℃,0.1C的第二次充放電性能曲線,電壓范圍在2.7~4.2 V。從圖4中可以看出,四個樣品的電壓平臺曲線都較平滑;放電比容量分別為115.1、139.9、112.1、146.1 mAh/g;樣品的放電平臺為3.27、3.37、3.29、3.39 V。可以看出樣品S1、Y1電壓平臺平緩且有較長的延伸,充放電之間的電位差較小,極化較低,放電比容量較高,這可能與材料顆粒的大小有關,摻雜Gd3+離子后合成的LiFePO4/C材料,顆粒粒徑較小,縮短了鋰離子擴散路徑,有效減少了電極反應動力學限制,有助于提高材料的容量及穩定性,這一點在循環容量曲線圖中進一步反映。
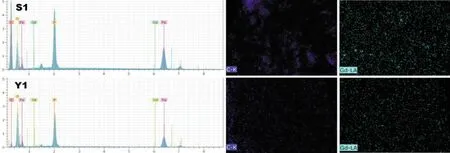
圖3 樣品S1、Y1的EDS及C元素和Gd元素的面分布圖
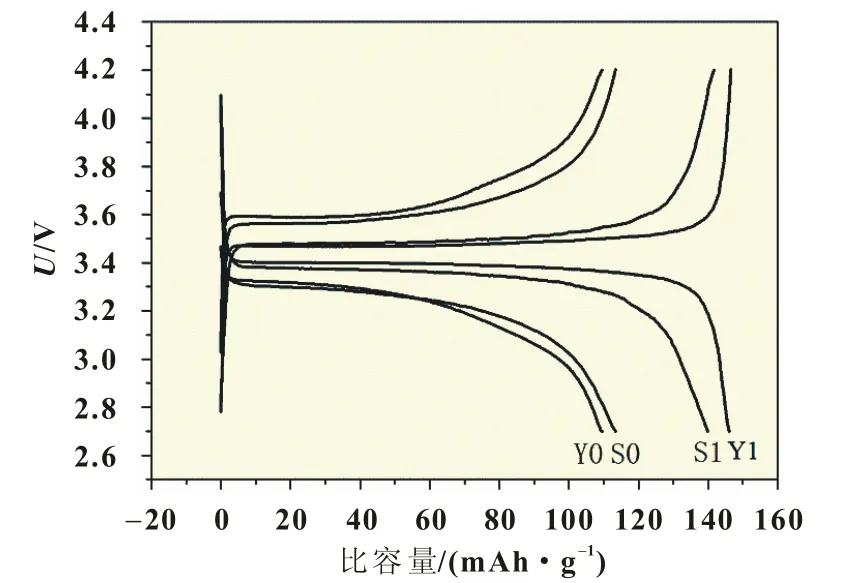
圖4 四種樣品25℃0.1C下第二次充放電性能曲線
圖5所示為四種樣品在25℃,0.1C的循環性能。四個樣品的初始比容量分別為116.5、139.6、114.6、146.1 mAh/g,50次循環后比容量分別為31.4、134.4、116.3、144 mAh/g,可以看出樣品樣品S1、Y1具有較好的放電性能和循環穩定性。尤其是樣品Y1,50次循環容量保持率在98.5%,平均每次循環僅衰減0.042 mAh/g,這充分說明稀土離子的摻雜對于改善材料的電性能和循環穩定性有顯著的影響。
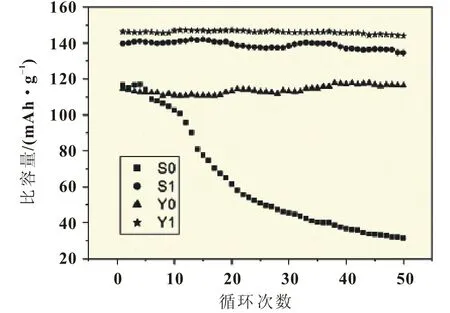
圖5 四種樣品在25℃0.1C下的循環性能
2.3 Gd3+摻雜LiFePO4/C材料的低溫性能
圖6為樣品S1和Y1在不同溫度、0.1C下第二次充放電性能曲線。兩種不同鐵源合成的樣品,在25、-20℃下的充放電曲線都較平滑,隨著溫度降低,兩個樣品電極的極化現象明顯。樣品S1在25、-20℃的放電平臺分別是3.37、3.24 V,放電電壓平臺下降0.13 V,放電比容量逐漸減少,分別為139.9、86.7 mAh/g。樣品Y1在25、-20℃的放電平臺分別3.39、3.27 V,平臺下降0.12 V;放電比容量分別為146.1、99.8 mAh/g。放電容量的降低和極化的增加可能有很多原因,比如低溫時電解液粘度增大,正極活性材料體積收縮致使導電劑與活性物質接觸不充分等,都使材料的導電能力降低,電極極化增大,放電容量降低[4]。此外,在低溫環境下,正極材料顆粒內外層極化增大,鋰離子在正負極之間傳輸阻抗增加,導致放電過程中電池電壓過早達到放電終止電壓[5],造成容量降低,放電電壓平臺下降。
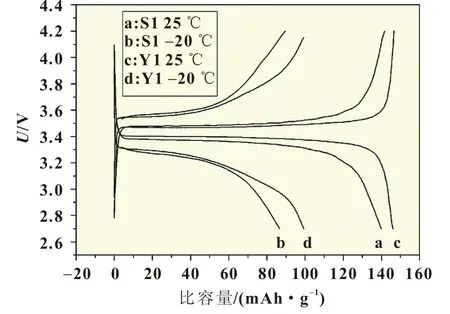
圖6 樣品S1和Y1在不同溫度下的電壓平臺
圖7所示為樣品S1、Y1在不同溫度不同倍率下的循環性能。從圖7中不同溫度放電比容量數據可以看出,隨著溫度的降低,放電比容量在逐漸衰減,但在不同溫度下電池的循環穩定性較好。樣品S1在25℃時0.1C、1C、5C下首次放電比容量分別為139.6、113.6、95.4 mAh/g,而在同樣溫度和倍率下,樣品Y1表現出較高的放電比容量,分別為146.1、122.5、108.8 mAh/g。在-20℃下,樣品S1在0.1C、1C、5C下首次放電比容量分別為84.8、79.8、66.7 mAh/g,樣品Y1在低溫下也展示出優異的電化學性能,其在同樣放電倍率下的比容量分別是98.8、87.1、73.9 mAh/g。馮祥明等[6]使用固相法合成的LiFePO4/ C,在-20℃,0.1C時的放電比容量為91 mAh/g,僅為25℃時比容量的58%。尹艷紅等[7]用模板水熱法合成片狀結構聚集體形貌的LiFePO4/C,-20℃,5C下放電比容量為70.3 mAh/g。相比而言,Gd3+摻雜FeC2O4·2H2O作為鐵源固相法合成LiFe-PO4/C具有較好的低溫性能。
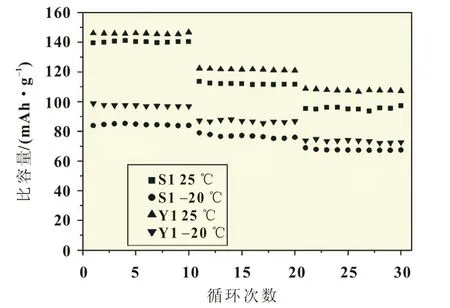
圖7 樣品S1和Y1在不同溫度不同倍率下的循環性能
本實驗對稀土化合物Gd2O3摻雜不同鐵源合成的LiFe-PO4/C材料在不同溫度下進行交流阻抗測試,電化學阻抗譜的頻率范圍在0.1~100 kHz。圖8為樣品S1、Y1的交流阻抗圖譜。從圖8中可知,交流阻抗由一個半圓和一條斜線組成,高頻區的半圓對應于界面電荷轉移電阻(Rct),低頻區的斜線對應于鋰離子在氧化物電極界面擴散引起的Warburg阻抗[8]。
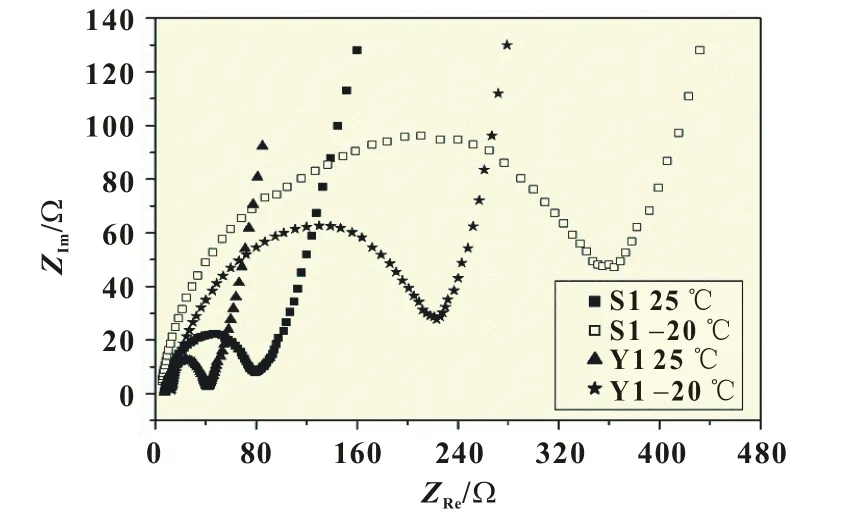
圖8 樣品S1和Y1在不同溫度下的交流阻抗
阻抗圖譜相對應的等效電路如圖9所示,圖中R1為電解液和電極的歐姆電阻,R2為異相間的電荷轉移電阻,CPE1為雙電層電容和鈍化膜電容;W1為Li+在正極材料中的擴散阻抗。從表1中數據可以看出,在不同溫度下,兩個樣品的歐姆電阻R1數值比較相近,這是因為電極極片制作過程中加入了相同的導電劑乙炔黑,致使電極的導電性接近,但異相間的電荷轉移電阻R2數值差別較大,這可能是由于在充電過程中負極出現鋰金屬的析出沉積,沉積出的鋰金屬比表面積大,具有高反應活性,與電解液發生不可逆反應,鋰與電解液的反應產物不具有電子導電性,覆蓋在電極表面,負極的阻抗增大,極化增強,電壓降低。多次循環后,凈鋰含量減少,SEI膜加厚,極大地破壞電池的低溫性能。
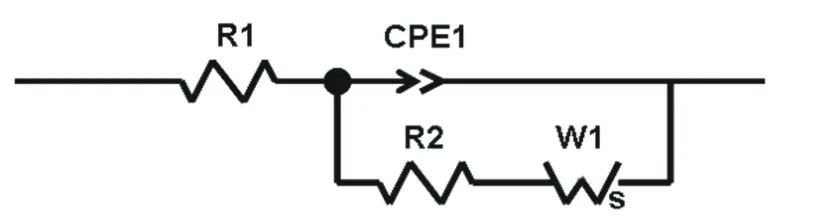
圖9 交流阻抗數據擬合等效電路
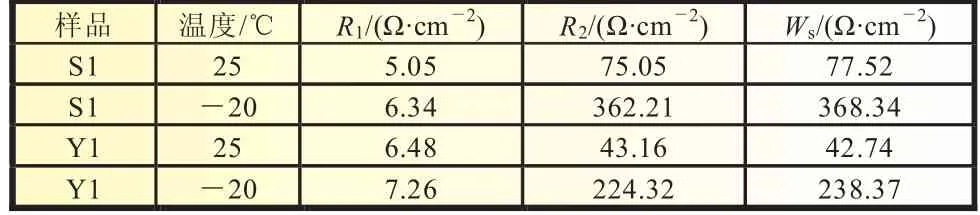
表1 電極動力學參數擬合等效電路實驗數據分析
3 結論
本實驗選用 Gd3+作為摻雜離子,分別采用Fe2O3和FeC2O·42H2O作為鐵源,固相法制備出性能較高的正極LiFe-PO4/C復合材料。結果表明以FeC2O4·2H2O為鐵源合成的樣品,具有較低的交流阻抗和較好的電化學性能。25℃時樣品Y1放電電壓平臺3.39 V,0.1C、5C首次放電比容量分別為146.1、108.8 mAh/g,-20℃時下降到3.27 V,相同倍率下比容量分別為99.8、73.9 mAh/g,電壓平臺下降0.12 V,比容量分別下降了46.3和34.9 mAh/g,分別為25℃時放電比容量的68.3%和67.9%,具有較好的低溫性能。
[1]PROSINI P P,LISI M,ZANE D,et al.Determination of the chemical diffusion coefficient of lithium in LiFePO4[J].Solid State Ionics,2002,148(1/2):45-48.
[2]NOVIKOVA S,YAROSLAVTSEV S,RUSAKOV V,et al.(MII=Co,Ni,Mg)as cathode materials for lithium-ion batteries[J].Electrochem Acta,2014,122:180-186.
[3]王春雄,向楷雄,龔文強.鋰離子電池正極材料Li0.97Re0.01FePO4的合成及性能[J].湖南工業大學學報,2010,24(4):5-8.
[4]XIE X H,ZHANG J,LI J,et al.Study on the low temperature performance of the LiFePO4/Li batteries[C]//第28屆全國化學與物理電源學術年會論文選.廣州:華南師范大學,2009:113-114.
[5]謝曉華,陳立寶,解晶瑩.鋰離子蓄電池低溫性能研究進展[J].電源技術,2007,31(3):576-577.
[6]FENG X M,ZHANG J J,LI R F,et al.Low temperature performance of LiFePO4Li-ion battery[J].Battery Bimonthly,2009,39 (1):36-37.
[7]尹艷紅,李向南,苗春輝,等.水熱法合成LiFePO4/C低溫性能研究[J].電源技術,2013,37(4):543-546.
[8]ROA M G,GALICIA L,ROJAS H A,et al.Electrochmical study on the selective formation of[Pb(cyclodextrin)2+]surface inclusion complexes at the carbon paste electrode/Cl-O4-1M interphace[J].Electrochemica Acta,2005,50(9):1925-1930.
Low temperature performance of LiFePO4/C material doped by rare-earth ion
Fe2O3and FeC2O4·2 H2O were used as iron source to synthesize LiFePO4/C compound materials,respectively.And the Gd2O3were doped to improve its electrochemical properties.Crystalline structure,morphology and electrochemical performance of the samples were characterized by X-ray diffraction,SEM,EDS,charge-discharge tests and AC impedance techniques.Low-temperature performances of the synthesized material were discussed.Results show that the LiFePO4/C cathode material using FeC2O4·2 H2O as iron source shows improved electrochemical performance,especially low temperature.At 25℃,the specific capacities of the sample reach 146.1 mAh/g(0.1C),108.8 mAh/g(5C).At-20℃,the specific capacities of the sample are 99.8 mAh/g(0.1C),73.9 mAh/g(5C),which reach about 68.3%,67.9%of that at room temperature,respectively.
LiFePO4/C;rare-earth ion doping;low-temperature performance;Li-ion batteries
TM 912
A
1002-087 X(2016)06-1163-04

2015-12-20
河南省重點攻關項目(72102230008);河南省基礎與前沿技術研究計劃項目 (102300410256);新鄉市科技發展計劃(15GY03)
李向南(1985—),男,河南省人,碩士,助理實驗師,主要研究方向為鋰離子電池及關鍵材料。
曹朝霞,尹艷紅

