高海拔地區進展期胃癌切除修復交叉互補基因1 mRNA及蛋白表達與化療療效的相關性研究*
祁玉娟,韓靜綺,才保加,駱玉霜,冀保妍,袁青玲,宋曉燕,張文彥,白麗艷,劉五甲(.青海省人民醫院,青海西寧80007;.青海大學附屬醫院,青海西寧8000;.青海大學,青海西寧8006)
?
高海拔地區進展期胃癌切除修復交叉互補基因1 mRNA及蛋白表達與化療療效的相關性研究*
祁玉娟1,韓靜綺2,才保加2,駱玉霜2,冀保妍1,袁青玲1,宋曉燕1,張文彥1,白麗艷3,劉五甲3
(1.青海省人民醫院,青海西寧810007;2.青海大學附屬醫院,青海西寧810001;3.青海大學,青海西寧810016)
摘要:目的研究高海拔地區進展期胃癌切除修復交叉互補基因1(ERCC1)mRNA和蛋白表達,及其與化療療效的相關性。方法逆轉錄-聚合酶鏈反應(RT-PCR)檢測60例進展期胃癌患者ERCC1 mRNA的表達,免疫組織化學法檢測ERCC1蛋白的表達并予以FOLFOX4方案化療,分析ERCC1 mRNA及蛋白表達與化療客觀反應率(ORR)和無進展生存期(PFS)的相關性。結果進展期胃癌ERCC1 mRNA的表達與化療療效(ORR)、PFS呈負相關(P=0.038和0.032);ERCC1蛋白表達與FOLFOX4化療療效(ORR)無關(P= 0.089),與PFS呈負相關(P=0.039)。結論高海拔地區,進展期胃癌ERCC1 mRNA與化療療效呈負相關,ERCC1蛋白表達與化療療效無關;ERCC1 mRNA及蛋白表達與PFS呈負相關。
關鍵詞:進展期胃癌;切除修復交叉互補基因1;化療;高海拔地區
胃癌在中國屬高發腫瘤,其死亡率占所有惡性腫瘤的23.02%,青海、寧夏、甘肅3省的胃癌死亡率超過35/10萬。青海省西寧市海拔2295m,地處西北地區,胃癌具有發病率高、手術切除率低、生存期短、死亡率高等特點。大部分患者就診時已屬進展期,無手術機會;化療是胃癌治療的重要手段之一,是胃癌綜合治療的重要組成部分[1]。目前為止,鉑類及5-氟尿嘧啶(5-fluorouracil,5-FU)為治療胃癌的基本用藥。本研究探討高海拔地區進展期胃癌切除修復交叉互補基因1(excision repair cross-complementation group 1,ERCC1)mRNA和蛋白表達水平,及其與化療療效的相關性。
1 資料與方法
1.1研究對象
選取2010年12月-2013年12月本院經病理學檢查確診的進展期胃癌70例進行研究。入選標準:①經證實具有可測量腫瘤病灶;②距離最后一次放化療≥3個月;③化療前血常規、肝、腎功能在正常范圍內;④心電圖正常;⑤美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)評分≤2分。排除標準:①ECOG評分≥3分;②腫瘤病灶不可測量;③風濕瓣膜性心臟病及器質性心臟病。入選患者手術切除的腫瘤組織置于-196℃液氮中保存,部分組織經過梯度酒精及二甲苯脫水后包埋于石蠟中,制備組織的石蠟標本。
所有患者有CT、B超及MRI證實的可測量腫瘤病灶。其中4例失訪,3例不能按規定評估療效,3例因不良反應未完成規定的治療方案。最終60例患者符合標準,進行統計學分析。60例患者中,男性39例(65%),女性21例(35%);年齡<55歲22例(36.7%),≥55歲38例(63.3%);體力評價:0分40例(66.7%),1、2分20例(33.3%)。病理類型:腺癌46例(76.7%),黏液癌5例(8.3%),印戒細胞癌7例(11.7%),其他2例(3.3%);分化程度:中、高分化23例(38.3%),低分化34例(56.7%),其他3例(5.0%);民族:漢族49例(81.7%),回族6例(10%),藏族3例(5%),蒙古族2例(3.3%)。所有患者系長期居住高海拔地區(海拔2 200 m左右)。
1.2方法
1.2.1化療方案和療效評價所有患者采用FOLFOX4方案治療。奧沙利鉑(連云港江蘇恒瑞醫藥股份有限公司,商品名:艾恒)85 mg/m2,第1天靜脈滴注2 h;亞葉酸鈣200 mg/m2,第1、2天化療前靜脈滴注2 h;5-氟尿嘧啶400 mg/m2,第1、2天靜脈沖入;5-氟尿嘧啶600 mg/m2,第1、2天靜脈持續泵入,14 d為1個周期。治療前l周完成各項基線檢查。近期療效的評價按照實體瘤的療效評價標準(response evaluation criteria in solid tumors,RECIST),分為完全緩解(complete response,CR)、部分緩解(complete response,PR)、疾病穩定(stable disease,SD)和疾病進展(progressive disease,PD)。以CR+PR為客觀緩解率(objective response rate,ORR)。腫瘤無進展生存期(progress free survival,PFS)從治療開始計算,終止日期為局部區域復發/遠處轉移或末次隨訪日。每兩個周期評價療效1次,若出現可能為病情進展的臨床表現可提前評價療效。所有患者進行隨訪。
1.2.2ERCC1蛋白檢測采用免疫組織化學鏈霉菌抗生物素蛋白-過氧化物酶連接法(streptavidinperosidase,SP)檢測胃癌石蠟切片組織中ERCC1的表達。ERCC1鼠抗人多克隆抗體為ab43(美國Abcam公司)。組織切片經高壓處理,修復暴露抗原。每批染色設陽性和陰性對照,以已知陽性切片作陽性對照組,以磷酸鹽緩沖溶液(phosphate buffer saline,PBS)代替一抗作空白對照組,嚴格按照試劑盒說明書進行操作,二氨基聯苯胺(Diaminobenzidine,DAB)顯色。免疫組織化學結果判斷標準參照文獻[2],采用二級評分法進行,由2位病理醫師判定。每張切片隨機觀察5個高倍鏡視野,每個視野計數100個癌細胞。按顯色強度分為4級:陰性(不著色)、弱陽性(著淡黃色)、陽性(著棕黃色)及強陽性(著棕褐色或者出現粗大的棕褐色顆粒),0~3分分別代表不同顯色強度。同時計算陽性腫瘤細胞百分數,對陽性腫瘤細胞比例評分(陽性細胞0%為0.0分,1%~9%為0.1分,10%~49%為0.5分,>50%為1.0分),用陽性強度評分乘以陽性腫瘤細胞比例評分得到最后的半定量H值來衡量最終的蛋白表達強度。按照每個指標各自中位H值來確定胃癌組織中指標表達的高低。
1.2.3ERCC1 mRNA檢測逆轉錄-聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)檢測ERCC1 mRNA的表達。Trizol試劑一步法提取胃癌組織總RNA,檢測組織總RNA濃度及完整度,cDNA第一鏈合成,PCR擴增ERCC1和內參基因β-actin。ERCC1正向引物:5'-GCCTCC GCTACCACAACCT-3',反向引物:5'-TCTTCTCTTGA TGCGGCGA-3',產物長度313bp;β-actin正向引物:5'-CGGGACCTGACTGACTACCTC-3',反向引物:5'-TCGTCATACTCCTGCTTGCTG-3',產物長度545 bp。引物由上海英駿生物工程公司合成。反應體系為25μl,其中2μl cDNA模板,正、反向引物各1μl,2×PCR Master Mix 12.5μl,加雙蒸水至25μl。反應條件:95℃預變性2 min,96℃變性20 s,60℃退火30 s,72℃延伸30 s,共35個循環,72℃繼續延伸10 min。反應結束后,取5μl PCR反應產物加1μl加樣緩沖液在1.5%瓊脂糖凝膠上電泳。紫外光下觀察電泳結果,使用凝膠成像系統拍照記錄。
1.3統計學方法
采用SPSS 17.0統計軟件進行數據分析,計數資料用χ2檢驗,生存分析用Kaplan-Meier法,各因素水平的比較用Log-rank法,P<0.05為差異有統計學意義。
2 結果
2.1進展期胃癌ERCC1蛋白及mRNA的表達
ERCC1蛋白陽性表達定位于腫瘤細胞核內,呈棕黃色或棕紅色顆粒,偶見于胞漿內。60例標本中,ERCC1蛋白陽性表達率為35%。見圖1。

圖1 進展期胃癌組織中ERCC1陽性表達(免疫組織化學法×400)
以一個內體間標記60例進展期胃癌ERCC1 mRNA的表達變量,ERCC1/β-actin比率為0.160~0.821,中位比率為0.290。60例患者以中位值為界,分為ERCC1 mRNA高、低表達兩組。進展期胃癌組織ERCC1 mRNA與β-actin表達見圖2。

圖2 部分胃癌組織ERCC1 RT-PCR檢測結果
2.2ERCC1蛋白及mRNA表達與進展期胃癌臨床特征的相關性
60例胃癌檢測標本中,ERCC1蛋白及mRNA的表達與進展期胃癌患者臨床病理參數,如不同年齡、性別、組織學類型及分級比較,差異無統計學意義(P>0.05)。見表1、2。

表1 進展期胃癌臨床病理參數與ERCC1蛋白表達的相關性 例(%)
2.3進展期胃癌ERCC1蛋白與mRNA表達
青海地區60例進展期胃癌患者中,ERCC1蛋白陽性患者ERCC1 mRNA高表達為40%,ERCC1mRNA低表達為30%;ERCC1蛋白與mRNA的陽性表達比較差異無統計學意義(P>0.05)。見表3。

續表1

表2 進展期胃癌臨床病理參數與ERCC1 mRNA表達的相關性 例(%)

表3 進展期胃癌中ERCC1 mRNA與蛋白表達的相關性例
2.4ERCC1蛋白及mRNA表達與FOLFOX4化療療效的相關性
所有60例患者完成≥4個周期的化療后進行療效評價并4周后確認。進展期胃癌ERCC1蛋白表達與化療療效無關(P=0.089)(見表4);ERCC1蛋白陽性表達者ORR為19.0%,陰性者為43.6%。ERCC1 mRNA高表達ORR為20.0%,低表達為50.0%,ERCC1 mRNA的表達與化療療效呈負相關(P=0.038)(見表5)。
2.5進展期胃癌ERCC1蛋白及mRNA表達與FOLFOX4治療無進展生存期的療效分析
對完成化療方案的患者進行隨訪。ERCC1蛋白陽性表達者無進展生存期(6.24個月)較陰性者(7.23個月)短,差異有統計學意義(P=0.039)。以ERCC1 mRNA表達水平中位值為界,將患者分為高表達組和低表達組。ERCC1 mRNA低表達組的中位PFS為7.32個月,與高表達組的6.3個月比較,差異有統計學意義(P=0.032)(見圖3)。Cox比例回歸模型將年齡、性別、淋巴結轉移、分化程度、ECOG評分等可能影響的因素進行多步驟校正后發現,ERCC1蛋白及mRNA表達仍然與PFS有關(P<0.05)。

表4 高海拔地區進展期胃癌化療療效與ERCC1蛋白表達的相關性 例(%)

表5 高海拔地區進展期胃癌化療療效與ERCC1 mRNA表達的相關性 例(%)
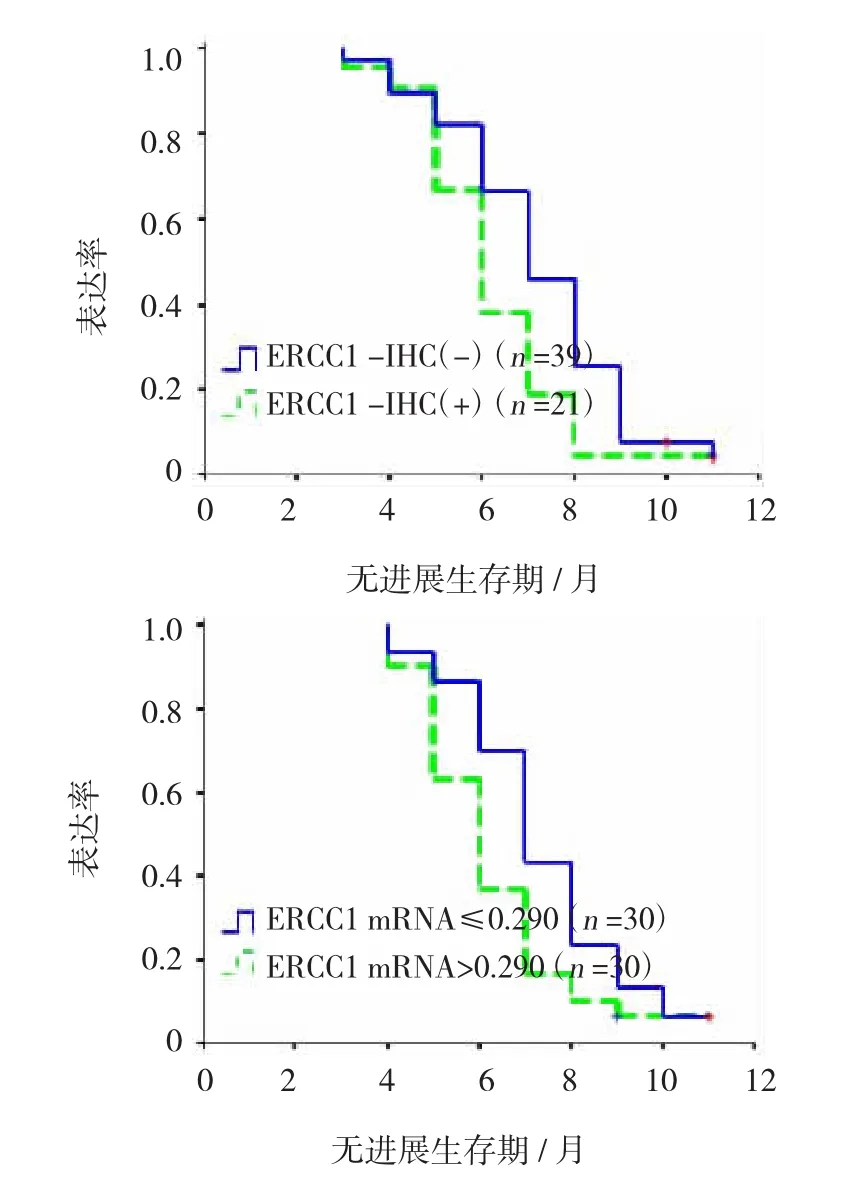
圖3 進展期胃癌ERCC1蛋白及mRNA表達與FOLFOX4化療后PFS
3 討論
ERCC1是第1個被發現的人類DNA損傷修復基因,是一種高度保守的單鏈DNA核酸內切酶。定位于染色體19q13.2~13.3,包含10個外顯子,基因全長15×10 bp,編碼含297個氨基酸的蛋白質[3]。化學藥物造成的DNA損傷主要通過核苷酸切除修復(nucleotide excision repair,NER)途徑修復,目前已明確ERCC1基因是核苷酸切除修復的關鍵基因[4]。
奧沙利鉑是第3代鉑類抗癌藥物,其形成的鉑-DNA復合物體積更大,能有更效地抑制DNA合成。然而腫瘤患者個體對草酸鉑的敏感性迥然不同,耐藥者與敏感者比較,生存期減少幾倍甚至十幾倍[5]。鉑類耐藥是因DNA的修復能力造成,其包含減少細胞毒的鉑-DNA復合物形成,以及與鉑-DNA復合物形成后防止細胞死亡[6]。其通過NER去除鉑類藥物導致DNA鏈內加合物被認為是鉑類藥物耐藥的主要機制[7],NER增強是導致順鉑耐藥的一個重要機制。腫瘤細胞的DNA損傷修復能力不同會導致其對草酸鉑的敏感性差異。
Kwon等[8]對韓國進展期胃癌患者接受奧沙利鉑聯合5-氟尿嘧啶化療的研究顯示,ERCC1蛋白陽性率為70.3%,ERCC1蛋白陰性表達者有更好的化療反應率及長的無進展總生存期(P=0.045和0.040)。Yun等[9]的一項對韓國進展期胃癌患者行一線鉑類為基礎的療效及生存研究提示,ERCC1陽性表達率為66%,ERCC1陰性較ERCC1陽性患者有更高的治療反應率(44% vs 28%),但差異無統計學意義(P=0.420),ERCC1的表達與總生存期無關(P= 0.570)。但是也有不一致的研究,Baek等[10]對韓國>Ⅱ期胃癌患者行鉑類術后輔助化療的研究表明,ERCC1蛋白陽性組的無病生存期和總生存期明顯較陰性組長。本研究結果顯示,ERCC1蛋白表達陽性率為35%;進展期胃癌ERCC1蛋白表達與化療客觀有效率無關,與無進展生存期呈負相關;青海地區ERCC1蛋白陽性率表達較低,其治療反應差可能與本實驗入組患者分期晚及低分化腺癌比例較高有關,以及與不同地區胃癌的發病因素、發病機制及腫瘤的異質性相關,需要在以后的研究中擴大病例、分層分析。
黃朝暉等[11]在蘇州地區用半定量RT-PCR檢測62例胃癌組織ERCC1 mRNA表達水平的中位值為0.672;ERCC1 mRNA高表達組的無復發生存率和總生存率顯著低于低表達組(P<0.05)。多因素分析結果顯示,ERCC1 mRNA水平是影響患者預后的獨立危險因素(P<0.05),與本研究結果相似,沒有顯示區域的差異。
Matsubara等[12]報道,140例進展期胃癌患者中43例接受鉑類為基礎的一線化療,結果表明,ERCC1 mRNA低表達化療反應率為55.6%,高表達化療反應率為18.8%(P=0.008),所有患者多變量生存分析顯示,ERCC1 mRNA高表達可預測不良預后。本研究顯示,在高海拔地區,進展期胃癌ERCC1 mRNA表達與化療客觀有效率、PFS呈負相關。但是也有不同的報道,Huang等[13]研究長沙地區實施DCF方案化療的48例進展期胃癌患者,TUBB3、TS和ERCC1 mRNA采用多通路Branched-DNA液態芯片技術測定,ERCC1 mRNA的表達高低與化療反應率、中位疾病進展時間及中位總生存期無關。
總之,本研究探討青海地區進展期胃癌ERCC1蛋白及mRNA的表達,分析其與化療的相關性,發現其與國內外研究的不同之處,所以在以后的研究中,既要擴大樣本研究,又要將不同民族、不同分期進行分析,從而指導本地區進展期胃癌的個體化治療。
參考文獻:
[1] Peter S.Adjuvant chemotherapy in gastric cancer[J].World Journal of Surgery, 1987, 11(4): 473-477.
[2] Olaussen KA, Dunnant A, Fouret P, et al.DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy[J].N Engl J Med, 2006, 355(10): 983-991.
[3] Reed E.ERCC1 and clinical resistance to platinum-based therapy[J].Clin Cancer Res, 2005, 11(17): 6100-6102.
[4] Olaussen KA, Mountzios G, Soria JC.ERCC1 as a risk stratifier in platinum-based chemotherapy for non-small-cell lung cancer[J].Curr Opin Pulm Med, 2007, 13(4): 284-289.
[5] Kawakami K, Watanabe G.Identification and functional analysis of single nucleotide polymorphism in the tandem repeat sequence of thymidylate synthase[J].Gene Cancer Res, 2003, 63(18): 6004-6007.
[6] Steven W, Johnson, James P, et al.Cancer: principles and practice of oncology [M].6th ed.Philadelphia: Lippincott Williams Wilkins, 2001: 380-382.
[7] Su D, Ma S, Liu P, et al.Genetic polymorphisms and treatment response in advanced non-small cell lung cancer[J].Lung Cancer, 2007, 56(2): 281-288.
[8] Kwon HC, Roh MS, Oh SY, et al.Prognostic value of expression of ERCC1, thymidylate synthase, and glutathione S-transferase P1 for 5-fluorouracil/oxaliplatin chemotherapy in advanced gastric cancer[J].Annals of Oncology, 2007, 18(3): 504-509.
[9] Yun J, Kim KM, Kim ST, et al.Predictive value of the ERCC1 expression for treatment response and survival in advanced gastric cancer patients receiving cisplatin-based first-line chemotherapy[J].Cancer Res Treat, 2010, 42(2): 101-106.
[10] Seo BG, Kwon HC, Oh SY, et al.Comprehensive analysis of excision repair complementation group 1, glutathione S-transferase, thymidylate synthase and uridine diphosphate glucuronosyl transferase 1A1 polymorphisms predictive for treatment outcome in patients with advanced gastric cancer treated with FOLFOX or FOLFIRI[J].Oncol Rep, 2009, 22(1): 127-136.
[11]黃朝暉,華東,李莉華,等.ERCC1 mRNA表達及基因多態性對胃癌輔助化療預后的影響[J].南京醫科大學學報, 2008, 28(4): 453-455.
[12] Matsubara J, Nishiina T, Yamada Y, et al.Impacts of excision repair cross-complementing gene 1 (ERCC1), dihydropyrimidine dehydrogenase, and epidermal growth factor receptor on the outcomes of patients with advanced gastric cancer [J].British Journal of Cancer, 2008, 98(4): 832-839.
[13] Huang J, Hu HB, Xie YC, et al.Effects of TUBB3, TS and ERCC1 mRNA expressions on chemoresponse and clinical outcome of advanced gastric cancer by multiplex branched-DNA liquid chip technology[J].Translational Gastrointestinal Cancer, 2014, 3(1): 21-28.
(童穎丹編輯)
Correlation of ERCC1 mRNA and protein expression in advanced gastric cancer with chemotherapy effect in high-altitude areas*
Yu-juan Qi1, Jing-qi Han2, Bao-jia Cai2, Yu-shuang Luo2, Bao-yan Ji1, Qing-ling Yuan1, Xiao-yan Song1, Wen-yan Zhang1, Li-yan Bai3, Wu-jia Liu3
(1.Qinghai Provincial Peoples' Hospital, Xining, Qinghai 810007, China; 2.The Affiliated Hospital of Qinghai University, Xining, Qinghai 810001, China; 3.Qinghai University, Xining, Qinghai 810016, China)
Abstract:Objective To investigate the values of mRNA and protein of excision repair cross-complementation group 1 (ERCC1) in predicting the prognosis of advanced gastric cancer patients treated with FOLFOX4 regime in high-altitude areas.Methods Seventy patients with advanced gastric cancer were enrolled in this study, 60 patients were eligible for analysis.All patients received FOLFOX4 regime repeated every two cycles.RT-PCR was used for analysis of ERCC1 mRNA; immunohistochemistry was used for analysis of ERCC1 protein expression.The relationships of mRNA and protein of ERCC1 with objective response rate (ORR) and progression-free survival (PFS) time were analyzed.Results ERCC1 mRNA expression was negatively associated with objective response rate (P= 0.038) and progression-free survival (P= 0.032).ERCC1 protein expression was not correlated with ORR of FOLFOX4 treatment (P= 0.089), but was negatively correlated with PFS (P= 0.039).Conclusions In high-altitude areas, the expression of ERCC1 mRNA in advanced gastric cancer patients is negatively correlated with PFS and ORR of FOLFOX4 treatment; the expression of ERCC1 proteinbook=1,ebook=82is not associated with ORR, but has correlation with PFS in advanced gastric cancer patients.
Keywords:advanced gastric cancer; excision repair cross-complementation group 1; chemotherapy; highaltitude area
*基金項目:青海省人力資源和社會保障廳2014年度留學人員科技活動擇優資助項目(No:青人社廳函2014-414)
收稿日期:2015-09-14
文章編號:1005-8982(2016)01-0076-06
中圖分類號:R735.2
文獻標識碼:A

