微污染原水加氯處理條件下氯胺生成特性及動力學
代杏滿,李新杰,張躍軍,唐淑娟,章秋菊,謝 珊
(南京理工大學化工學院,南京 210094)
水環境是人類賴以生存的主要條件之一。由于受生活污水、工農業生產污水的污染,大量氨氮、尿素和氨基酸等含氮化合物被排入地表水中,致使許多水源處于高含氮的微污染狀態[1]。2014中國環境狀況公報顯示,我國十大水系中,Ⅳ~劣Ⅴ類水體占38.8%,氨氮排放總量為238.5萬t[1]。在以氯為預氧化劑和消毒劑的制水工藝中,氯會與原水中的氨氮或有機氮反應,生成氯胺(無機或有機氯胺)[2,3]。有機氯胺的滅菌能力很弱或不具滅菌能力,并有一定的生物毒性,部分有機氯胺還是某些致癌物的前驅物[4,5]。無機氯胺(NH2Cl、NHCl2和NCl3)是一種比氯弱的消毒劑,在水中也比氯穩定且停留時間長[2];但是,近期的一些研究表明,無機氯胺是致癌物質N,N-二甲基亞硝胺(NDMA)的前驅物之一,尤其在以含二甲胺基團的高分子絮凝劑強化混凝處理微污染原水的過程中,含二甲胺基團的化合物、氧化劑氯和無機氨(或由氯和氨生成的氯胺)已被證實是形成NDMA的必要條件[7]。雖然我國的飲用水制水工藝很少采用氯胺,但以上述高含氮的水源為原水生產飲用水,加氯處理過程不可避免會產生氯胺,這不僅會增加氯的消耗,并可能形成產生NDMA的基本條件。
微污染原水中可生成氯胺的含氮物質較多,主要包括氨氮和有機氮如蛋白質、氨基酸、多肽、核酸、尿素和腐殖質等[3-6,8,9],其主要來源有工業源、生活源、農業源(施用化肥和農家肥)以及水生生物尸體的分解和藻類的代謝等[8-11]。尿素作為主要氮肥是有機氮的重要來源之一[11];水中常見的氨基酸有20多種[12],其中甘氨酸是最簡單的氨基酸,而且作為一種重要原料在醫藥、食品、農藥和飼料行業應用廣泛且用量較大[13]。因此,本文選取NH3、尿素和甘氨酸作為微污染原水中含氮物質的代表物,在模擬微污染原水的含氮量及加氯消毒條件下,研究氯與其生成氯胺的特性及影響因素,為微污染原水加氯處理制水工藝加氯量的設計及消毒副產物的控制提供參考,同時也為進一步研究NDMA的生成條件、規律和機理提供參考。
1 材料和方法
1.1 儀器與試劑
主要實驗儀器:722型分光光度計(上海光科分光儀器有限公司);恒溫水浴 (江蘇省東臺市電器廠);PHS-2C型數顯酸度計(上海雷磁分析儀器廠);電子天平(上海光正醫療儀器有限公司);碘量法及容量分析玻璃儀器等。
實驗試劑:次氯酸鈉,鹽酸鹽N,N-二乙基對苯二胺(DPD),十二水合磷酸氫二鈉,磷酸二氫鉀,硫酸亞鐵銨,二苯胺磺酸鋇,碘化鉀,氨水,納氏試劑,四水合酒石酸鉀鈉,尿素,甘氨酸,淀粉,硫代硫酸鈉,濃硫酸等,均為分析純試劑;實驗用水為無氨和無需氯的去離子水。
1.2 分析方法
氨氮測定采用納氏分光光度法[14],氯胺(以有效氯計)測定采用DPD滴定法[15]。
1.3 實驗方法
表1列出了文獻報道的我國常見微污染原水含氮量及常規加氯處理條件范圍,依據該數據或作適當擴展選取的為本實驗條件也在表1中列出。以去離子水添加適量的氨水、尿素或甘氨酸模擬含氮微污染原水,并模擬氯(用次氯酸鈉代替)與原水快速混合-接觸反應過程,考察反應時間、溫度、pH以及氯氮質量比δ(Cl2∶N)(簡稱氯氮比)對氯胺生成的影響及其較佳的生成條件,并在此基礎上用初始濃度法進行氯胺生成動力學實驗,測定反應級數、速率常數等動力學參數。

表1 我國常見微污染原水含氮量及常規加氯處理條件Tab.1 Nitrogen content and conventional chlorination conditions of common slightly-polluted raw water in China
2 結果和討論
2.1 氯胺生成影響因素
2.1.1反應時間影響
在25±1 ℃、pH=6.5±0.2、 (Cl2∶N)=5:1的條件下,反應時間(t)對氯胺生成濃度(ρ)的影響見圖1。圖1表明,氨、甘氨酸及尿素在加氯條件下都會生成氯胺,且分別在20、20和30 min以后各自的氯胺生成量基本趨于穩定。其中,NH3-N在加氯條件下可生成NH2Cl、NHCl2和NCl3,初始濃度為0.5 mg/L的NH3-N生成的總氯胺最多可達5.32 mg/L,構成比例:NH2Cl>NHCl2>NCl3;初始濃度為0.5 mg/L甘氨酸-N最大可產生5.96 mg/L的有機氯胺,而初始濃度為5 mg/L的

圖1 反應時間對氯胺生成的影響Fig.1 Effect of reaction time on chloramines formation
尿素-N產生的最大有機氯胺量僅為1.82 mg/L;可見,NH3和甘氨酸在水中生成氯胺的潛能遠大于尿素。氯對水中尿素的氯化作用不顯著,原因在于氯不易取代其氨基上的氫生成氯胺[21]。
從圖1可看出,在同樣氯氮比下3種含氮物質生成氯胺量的大小順序為:甘氨酸> NH3>尿素。為保證反應的充分性,選取30 min作為后序實驗的反應時間。
2.1.2氯氮比的影響
在25±1 ℃、pH=6.5±0.2和反應30 min的條件下,氯氮比對氯胺生成濃度(ρ)的影響見圖2。

圖2 氯氮比對氯胺生成的影響Fig.2 Effect of Cl2∶N mass ratio on chloramines formation
圖2表明,氨、甘氨酸和尿素的氯胺生成量均隨氯氮比的增大呈先增加后減小的趨勢。圖2(a)顯示,氨與氯生成的氯胺種類及濃度受氯氮比的影響較大;當 (Cl2∶N)≤6∶1時以NH2Cl為主,并在5∶1處其生成量達到最大; (Cl2∶N)在7∶1~8∶1時以NHCl2為主,在8∶1處其生成量最大; (Cl2∶N)大于8∶1,NH2Cl、NHCl2生成量均快速降低,原因在于當氯氮比大于8∶1后,氯與氨反應開始生成N2與硝酸[2];因本實驗的pH(6.5)不足以提供生成NCl3的條件[22],故基本無NCl3生成。這是氯與氨典型的折點反應,且反應是連續的,如公式(1)~(4)所示[2,22]。
Cl2+H2O→HOCl+HCl
(1)
NH3+HOCl→NH2Cl+H2O
(2)
NH2Cl+HOCl→NHCl2+H2O
(3)
NHCl2+ HOCl→NCl3+H2O
(4)
圖2(b)顯示,甘氨酸氯胺在δ(Cl2∶N)=5∶1處有最大值;因為甘氨酸在α-氨基位點生成的有機氯胺不穩定,當氯胺生成量達到最大值后,隨著氯氮比的繼續增大,生成的氯胺可進一步發生氯化水解、脫羧等反應生成氯代亞胺、氰酸或腈類等產物[23-25]。從圖2(c)可以看出,尿素氯胺的生成量也在(Cl2∶N)=5∶1處最大, (Cl2∶N)大于5∶1時生成量降低;原因在于過大的加氯量,也會促使尿素發生氯化水解反應而生成CO2、N2或NO-3等物質[21]。可見,氨、甘氨酸或尿素與氯生成氯胺(或有機氯胺)的較佳氯氮質量比在5∶1左右。
2.1.3pH的影響
在25±1 ℃、 (Cl2∶N)=5∶1和反應30 min的條件下,pH對氯胺生成濃度(ρ)的影響見圖3。

圖3 pH對氯胺生成的影響Fig.3 Effect of pH on chloramines formation
圖3(a)表明,氯與氨生成氯胺的種類與pH有很大關系;pH≤3時主要生成三氯胺(占總氯胺60%以上),pH值在3.5~5.5之間以二氯胺為主,pH≥5.5以一氯胺為主,pH到8以上,主要生成一氯胺(占總氯胺99%以上);其原因可能與水中HClO量及活性有關,pH越小HClO量越多、活性越大[2],越能促進氯胺的進一步氯代反應,如公式(1)~(4)所示。圖3(b)顯示,pH=6時,甘氨酸氯胺的生成量最大,pH<6或pH>6時,甘氨酸氯胺生成量均有不同程度降低。根據Mehrsheikha等人的研究,甘氨酸氯胺在水中有兩種水解趨勢[25]:pH<6時,會發生酸性水解首先生成甲二醇,進而在氯胺的作用下繼續水解成N2和NO-3;pH>6時,會發生堿性水解逐步生成CNCl、CNO-和CO2等;這兩種水解的結果使甘氨酸氯胺生成量在pH小于或大于6時均有降低趨勢。從圖3(c)可以看出,pH值在2~4之間,隨著pH的減小,尿素氯胺生成量快速增加;pH>4時,其生成量隨pH的增加雖呈減少趨勢,但減幅較小;原因在于尿素在酸性條件易發生酸性水解而產生NH+4[26],NH+4與氯生成無機氯胺導致尿素氯胺生成量驟增。本實驗結果表明,氯氮比同為5∶1的情況下,在pH接近于中性的水中有利于NH2Cl和甘氨酸氯胺的生成,pH<4時則更有利于尿素氯胺的生成。
2.1.4溫度的影響
在pH=6.5±0.2、 (Cl2∶N)=5∶1和反應30 min的條件下,溫度(T)對氯胺生成濃度(ρ)的影響見圖4。
圖4(a)顯示,溫度在5~45 ℃范圍變化,對NH3-N的氯胺生成量基本無影響;圖4(b)和圖4(c)則顯示,甘氨酸氯胺、尿素氯胺生成量均隨溫度的升高而減小;由此可見,溫度升高不利于有機氯胺的生成。由于尿素和甘氨酸的分解溫度較高(≥100 ℃)[27],本實驗溫度下不會造成其分解,造成其氯胺生成量下降的原因可能是:溫度升高,HClO穩定性變差,取代尿素和甘氨酸氨基上H的能力降低;溫度升高,甘氨酸和尿素分子上氨基水解趨勢大于與氯反應的趨勢。

圖4 溫度對氯胺生成的影響Fig.4 Effect of temperature on chloramines formation
2.2 氯胺生成動力學
2.2.1動力學實驗結果
在25±1 ℃、pH=6.5±0.2的條件下,采用初始濃度法(即保持反應物1的初始濃度不變并≥10倍反應物2的濃度,改變反應物2的濃度)進行氯與氨、尿素、甘氨酸反應生成氯胺的動力學實驗,根據圖1各反應的速度快慢,分別選取1、1、10 min為各自的初始反應時間,實驗結果見表2(數據為3組平行實驗中偏差較小的2組結果的平均值)。
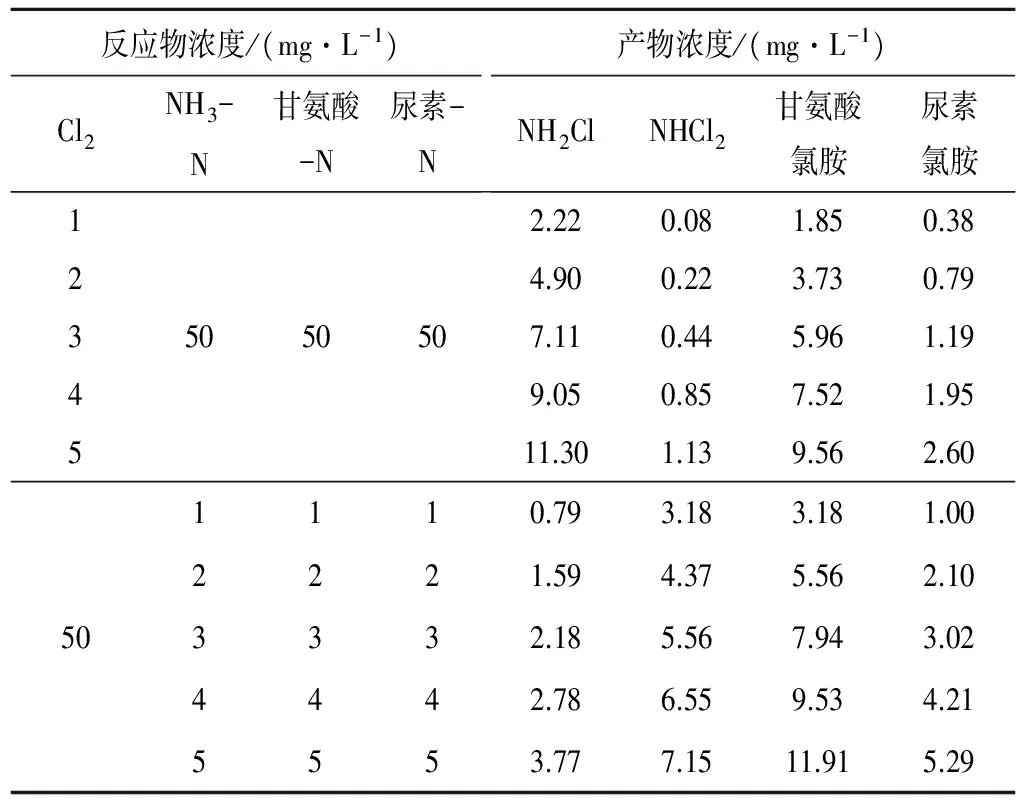
表2 氯胺生成動力學實驗結果(25±1 ℃, pH=6.5±0.2)Tab.2 Experimental result of chloramines formation kinetics
2.2.2反應級數及速率常數考察
根據反應式(1)~式(4),假定氯胺生成反應速率方程形式如下:
v=kCα1Cβ2
(5)
lnv=lnk+αlnC1+βlnC2(對數式)
(6)
式中:v為反應速率(以初始平均速率代替,即初始濃度/初始反應時間);k為速率常數;C1、C2為反應物1、2的濃度(反應物1為氯,反應物2為含氮物質);α、β分別為反應物1、2的級數。
若反應物1濃度不變,相當于kCα1為常數,則以lnv對lnC2作圖,根據擬合直線的斜率和截距,即可求出k和β,依次類推。按此法對表2數據進行擬合,得到的擬合曲線方程和動力學參數分別見表3和表4。
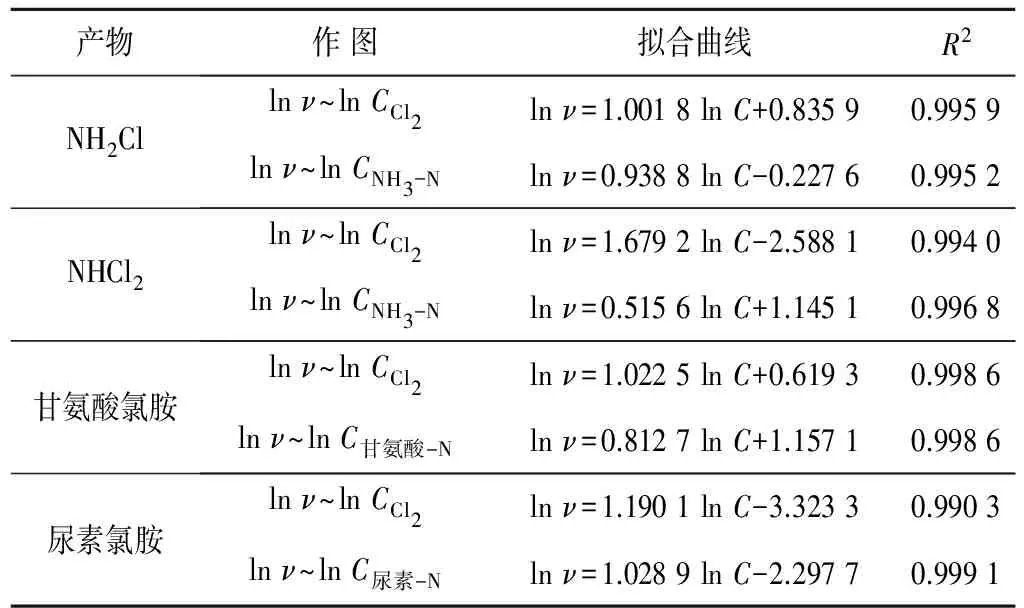
表3 氯胺生成動力學擬合曲線(25±1℃, pH=6.5±0.2)Tab.3 Fitting curve of chloramines formation kinetics
表3顯示,lnv與lnC有較好的線性關系(R2>0.99),表明本實驗氯胺生成反應的速率方程符合式(6)的形式。從表4的動力學數據可以看出,生成NH2Cl、甘氨酸氯胺或尿素氯胺的各反應物的級數均接近1,生成NHCl2的各反應物級數分別為1.68和0.52,因此各反應的總級數均接近2,表明氯與氨、尿素和甘氨酸生成氯胺的反應可能是2級反應,速率常數大小順序為:甘氨酸氯胺>NH2Cl>NHCl2>尿素氯胺;速率常數的數據進一步驗證了圖1的結果。

表4 氯胺生成動力學擬合參數 (25±1℃, pH=6.5±0.2)Tab.4 Kinetic parameters of chloramines formation
3 結 語
(1)在常溫和近中性的水中,氯與氨、甘氨酸和尿素均可生成氯胺;其中,NH2Cl、甘氨酸氯胺和尿素氯胺生成的較佳氯氮質量比為5∶1、反應時間為30 min、溫度≤25 ℃,氯氮質量比大于或小于5∶1,這些氯胺生成量均會降低;常溫下溫度對無機氯胺的生成量基本無影響,但溫度的升高對甘氨酸氯胺和尿素氯胺生成不利。氯氮比和pH可影響氯與氨生成無機氯胺的種類,氯氮比小于6∶1或pH>5以NH2Cl為主,氯氮比在7∶1~8∶1或pH值在3.5~5之間以NHCl2為主,pH≤3主要生成三氯胺。另外,pH>5和pH<4分別有利于甘氨酸氯胺和尿素氯胺的生成。
(2)氯胺生成反應速率方程符合v=kCα1Cβ2的形式(R2>0.99);在25 ℃、pH為6.5、氯氮質量比為5∶1的水中,生成NHCl、甘氨酸氯胺和尿素氯胺的各反應物級數均接近1,生成NHCl2的各反應物級數分別為1.68和0.52,因此氯胺生成反應的總級數接近于2級;氯胺生成速率常數大小順序為:甘氨酸氯胺>NH2Cl>NHCl2>尿素氯胺。
□
[1] 環境保護部. 2014中國環境狀況公報[R]. 北京: 中華人民共和國環境保護部, 2015.
[2] 曲久輝. 飲用水安全保障技術原理[M]. 北京: 科學出版社, 2007.
[3] Donnermair M M, Blatchley E R. Disinfection efficacy of organic chloramines[J]. Water Research, 2003,37(4):1 557-1 570.
[4] 徐 華,楊艷玲. 有機氮類化合物對氯消毒影響研究[J]. 北京工業大學學報, 2012,38(4):624-627.
[5] Lee W, Westerhoff P. Formation of organic chloramines during water disinfection-chlorination versus chloramination[J]. Water Research, 2009,43(8):2 233-2 239.
[6] 謝 興, 胡洪營. 污水氯消毒過程中有機氯胺的生成及其影響[J]. 中國給水排水,2007,23(24):20-23.
[7] Kemper J M,Walse S S,Mitch W A. Quaternary amines as nitrosamine precursors: a role for consumer products[J]. Environmental Science and Technology, 2010,44(4):1 224-1 231.
[8] 查曉松, 劉 燕, 張 強, 等. 氯化消毒氨基酸過程中消毒副產物生成的研究進展[J]. 環境工程,2013,31(S1):1-4.
[9] 榮 蓉,徐 斌,林 琳, 等. 微污染黃浦江水溶解性有機氮的分子組成特性分析[J]. 中國給水排水,2013,29(1):1-5.
[10] 吳雅麗, 許 海, 楊桂軍, 等. 太湖水體氮素污染狀況研究進展[J]. 湖泊科學, 2014,26(1):19-28.
[11] 韓曉霞, 朱廣偉,許 海,等. 太湖夏季水體中尿素的來源探析[J]. 環境科學, 2014,35(7):2 547-2 556.
[12] Hong H C, Wong M H, Liang Y. Amino acids as precursors of trihalomethane and haloacetic acid formation during chlorination[J]. Archives of Environmental Contamination and Toxicology, 2009,56(4):638-645.
[13] 許偉民, 程長平. 甘氨酸的生產與應用[J]. 發酵科技通訊,2007,36(3):36-38.
[14] HJ 535-2009,水質 氨氮的測定 納氏試劑比色法[S].
[15] HJ 585-2010,水質 游離氯和總氯的測定 N,N-二甲基-1,4-苯二胺滴定法[S].
[16] 方 華, 呂錫武, 朱曉超, 等. 黃浦江原水中有機物組成與特性[J]. 東南大學學報(自然科學版), 2007,37(3):495-499.
[17] 王義偉, 崔玉瑾, 張鐵財. 原水氨氮含量對氯投加量的影響研究[J]. 城鎮供水, 2012,(4):91-93.
[18] 張躍軍, 李瀟瀟. 微污染原水強化處理技術研究進展[J]. 精細化工, 2011,28(1):1-9.
[19] 吳文成, 任露陸. 珠江廣州段上覆水及間隙水中氮的分布特征[J]. 環境科學與技術, 2013,36(7):39-43.
[20] 張翰林. 黃浦江上游地區稻田水中溶解性有機氮碳的環境行為研究[D]. 上海:上海交通大學,2012.
[21] Laat J D, Feng W, Freyfer D A, et al. Concentration levels of urea in swimming pool water and reactivity of chlorine with urea[J]. Water Research, 2011,45(3):1 139-1 146.
[22] USEPA. Alternative disinfectants and oxidants guidance manual[M]. Washington D C: EPA’s Office of Water, 1999.
[23] Hawkins C L, Pattison D I, Davies M J. Hypochlorite-induced oxidation of amino acids, peptides and proteins[J]. Amino Acids, 2003,25(3-4):259-274.
[24] Tao H, Xu F, Chen W, et al. The effects of glycine on breakpoint chlorination and chlorine dosage control methods for chlorination and chloramination processes in drinking water[J]. Water, Air, & Soil Pollution, 2013, 224(10):1 686.
[25] Mehrsheikha A, Bleekea M, Brosillonb S, et al. Investigation of the mechanism of chlorination of glyphosate and glycine in water[J]. Water Research, 2006,40(16):3 003-3 014.
[27] 陳鎮超, 楊衛娟,周俊虎,等. 尿素催化水解特性實驗研究[J]. 中國電機工程學報, 2011,31(35):41-46.

