阿特拉津引起卵泡發育不良的分子機制
牛 潼,索 琪,劉 劍,趙本正,李俊瑋,林丹萍,譚文溪*,李 娜
(1.吉林大學臨床醫學院,吉林 長春130021;2.吉林大學第二醫院;3.吉林大學護理學院;4.長春中醫藥大學)
?
阿特拉津引起卵泡發育不良的分子機制
牛潼1,索琪2,劉劍2,趙本正1,李俊瑋1,林丹萍3,譚文溪2*,李娜4*
(1.吉林大學臨床醫學院,吉林 長春130021;2.吉林大學第二醫院;3.吉林大學護理學院;4.長春中醫藥大學)
摘要:目的觀察阿特拉津(ATR)處理后大鼠卵巢組織中ATM、P-ATM、CHEK1、P-CHEK1、P53及P-P53的含量,探討ATR引起卵泡發育不良的可能機制。方法以玉米油溶解ATR,將32只雌性Wistar大鼠隨機分為0 mg·kg-1、5 mg·kg-1、25 mg·kg-1和125 mg·kg-1ATR劑量組,灌胃給予相應劑量ATR,1次/d,共28 d,于第29 d處死動物取卵巢組織提取總蛋白,Western blot方法檢測卵巢組織蛋白中DNA損傷通路相關蛋白的表達及磷酸化水平。結果與對照組比較,ATR處理組大鼠卵巢組織中ATM水平顯著下降,其中以25 mg·kg-1組下降最為明顯(P<0.01);P-ATM水平呈劑量依賴性顯著升高(P<0.05)。與對照組比較,25 mg·kg-1和125 mg·kg-1ATR組大鼠卵巢組織中CHEK1水平下調(P<0.05),以125 mg·kg-1組水平最低;25 mg·kg-1和125 mg·kg-1組P-CHEK1水平明顯增高(P<0.05),以125 mg·kg-1組最為顯著。與對照組比較,ATR處理后各組大鼠卵巢組織中P53水平明顯降低(P<0.01或P<0.05),該效應具有劑量依賴性;25 mg·kg-1和125 mg·kg-1組P-P53水平增高(P<0.05),以25 mg·kg-1組升高最為明顯。結論ATR可通過激活ATM信號通路,活化其下游的P53及CHEK檢驗點,從而阻礙細胞周期,并導致閉鎖卵泡的發生。
關鍵詞:阿特拉津;卵巢;細胞周期;ATM信號通路
(ChinJLabDiagn,2016,20:0194)
阿特拉津(atrazine,ATR)又名莠去津,化學名稱2-氯-4-乙胺基-6-異丙胺基-1,3,5-三嗪,是全球應用最為廣泛,使用量最大的除草劑之一。ATR屬于低毒性除草劑,但可在環境中長久存在,對土壤、水體等自然媒介造成嚴重污染[1,2],并在動物體內蓄積,導致多系統生物毒性,故引起人們越來越多的重視。有研究[3-7]表明,ATR的生物學毒性主要見于神經系統、內分泌系統、免疫系統以及生殖系統。我們在前期研究[8]中發現,ATR可引起卵巢組織中大型閉鎖卵泡增加,并且氧化應激反應增強。但是氧化應激損傷導致卵泡發育不良的分子機制尚不明確。本研究通過檢測ATR處理后大鼠卵巢組織中ATM、P-ATM、CHEK1、P-CHEK1、P53及P-P53的水平,探討ATR導致的氧化應激引起卵泡發育不良的可能機制。
1材料與方法
1.1實驗動物與試劑4周齡雌性Wistar大鼠32只,購于吉林大學白求恩醫學院實驗動物中心,飼養于恒定溫度(22-25℃)、恒定濕度(40%-50%)環境中,標準飼料和水自由食用。ATR購于美國 Sigma 公司,純度為 98.99%,以玉米油溶解,4℃保存備用。ATM、P-ATM、CHEK1、P-CHEK1、P53及P-P53 兔抗鼠單克隆抗體購自美國Proteintech Group公司。
1.2動物分組及給藥將32只雌性Wistar大鼠隨機分為0 mg·kg-1、5 mg·kg-1、25 mg·kg-1和125 mg·kg-1劑量組,每組8只。以玉米油溶解ATR,每日灌胃給予相應劑量,連續28日,觀察大鼠一般狀態、飲食及活動情況,每4 d稱量大鼠體重并根據體重調整給藥量。
1.3組織標本的取材處理實驗動物連續給藥28天,于第29天麻醉狀態下腹主動脈取血處死動物,快速取出卵巢組織并凍存于-80℃冰箱,用于提取總蛋白。
1.4Western blot方法檢測DNA損傷通路相關蛋白的表達提取組織蛋白后,采用Western blot方法檢測卵巢組織蛋白中ATM、P-ATM、CHEK1、P-CHEK1、P53和P-P53的含量。以β-actin為內參照,計算相對光密度值。光密度=(目的條帶光強度×平均光密度)/ (同一樣品β-actin條帶光強度×平均光密度),相對光密度=實驗組光密度/對照組光密度,即以0 mg·kg-1組的表達為1,計算其他組與0 mg·kg-1組相比增加或減少的倍數。

2結果
2.1大鼠卵巢組織蛋白中ATM和P-ATM水平與對照組比較,ATR處理組大鼠卵巢組織中ATM水平顯著下降(P<0.05),以25mg·kg-1ATR組下降最為明顯(P<0.01)。與對照組比較,經ATR處理后,各組大鼠卵巢組織中P-ATM水平顯著上升(P<0.05)(見圖1)。
2.2大鼠卵巢組織蛋白中CHEK1和P-CHEK1水平與對照組比較,5mg·kg-1ATR組大鼠卵巢組織中CHEK1水平未見明顯差異,25mg·kg-1和125mg·kg-1ATR組大鼠卵巢組織中CHEK1水平降低(P<0.05),以125mg·kg-1ATR組中CHEK1水平最低;與對照組比較,25mg·kg-1和125mg·kg-1ATR組大鼠卵巢組織中P-CHEK1水平明顯增高(P<0.05),且125mg·kg-1ATRP-CHEK1水平最高。見圖2。
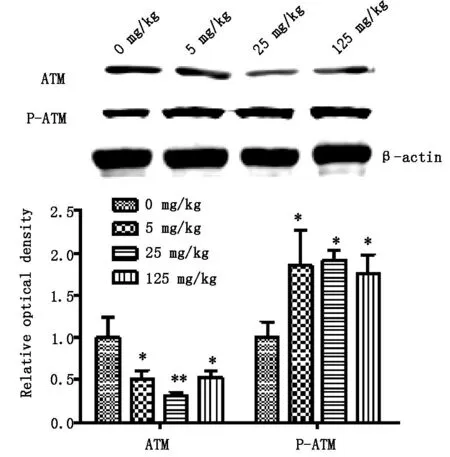
與對照組比較*P<0.05,**P<0.01
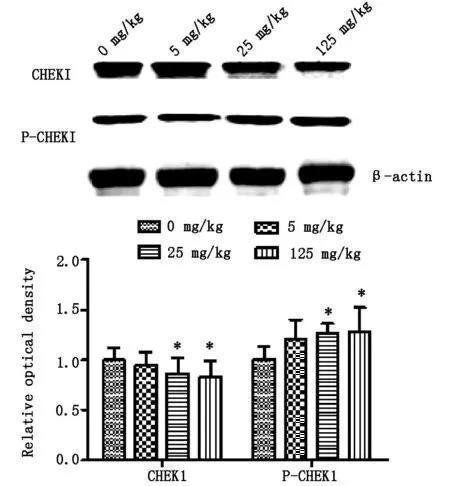
*與對照組比較P<0.05
2.3大鼠卵巢組織蛋白中P53和P-P53水平與對照組比較,經ATR處理的各組大鼠卵巢組織蛋白中P53水平明顯降低(P<0.01或P<0.05),且隨著ATR劑量增高,P53水平逐步降低;與對照組比較,5mg·kg-1和25mg·kg-1ATR組大鼠卵巢組織中P-P53水平增高(P<0.05),且25mg·kg-1ATR組升高最為明顯。
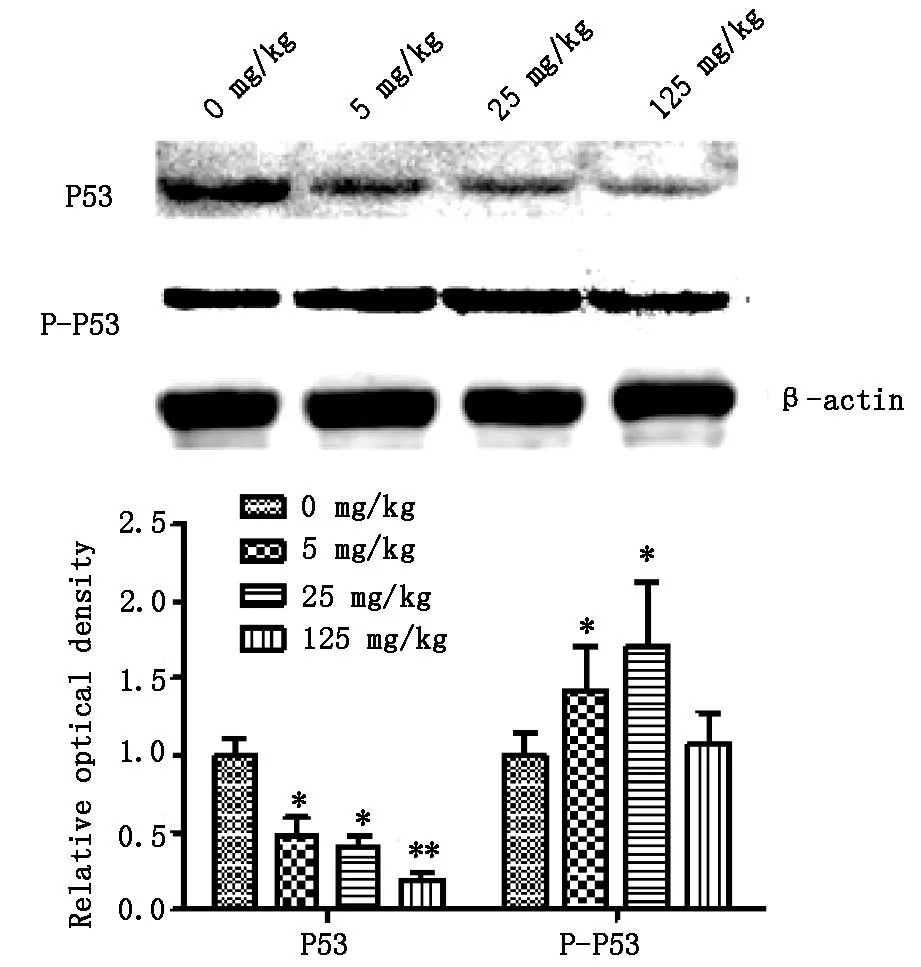
與對照組比較*P<0.05,**P<0.01
3討論
作為一種使用量大、在環境中殘留期長的除草劑,ATR的生物毒性已引起越來越多的關注。研究[3,7,9]表明,ATR可導致動物生殖系統功能紊亂,進而導致動物的繁殖發生異常,但其具體機制尚不明確。我們在前期研究[10]中發現,ATR可引起卵巢組織中大型閉鎖卵泡增加,并且卵巢組織中活性氧產生增多。由此我們猜測,活性氧的產生可能導致細胞內發生DNA損傷,進而引起DNA損傷應激,并激活細胞周期檢查點,引起細胞周期阻滯,從而導致閉鎖卵泡的發生。
細胞周期分為間期與分裂期兩個階段,間期又可分為DNA合成前期(G1期)、DNA合成期(S期)與DNA合成后期(G2期)。在細胞周期中,G1/S、G2/M期的調控點是細胞內外信號經過傳遞、整合匯集到細胞核,對細胞增殖進行調控的關鍵點[11]。正常情況下,當細胞受損時,可通過激活調控點,導致G1期和G2期延長,使細胞有充分的時間完成復制前和有絲分裂前的修復,以保證細胞的存活,當損傷超出細胞的修復能力時,則促使細胞凋亡[12]。
在細胞周期進程中,P53蛋白可作為轉錄因子或與其他轉錄因子結合,直接或間接影響細胞周期相關基因的轉錄,使細胞阻滯于G1或G2期[13]。P53可被細胞內多種有害因素所激活,形成磷酸化P53(P-P53),而DNA損傷是P53激活的主要刺激因素之一[14]。本研究結果表明,經ATR處理后,大鼠卵巢組織中P53含量明顯下降,而P-P53含量顯著增高,提示ATR可能通過磷酸化激活P53,導致細胞周期阻滯,并進而產生閉鎖卵泡導致卵泡發育不良。
研究表明,CHEK1可誘導P53的磷酸化[15]。CHEK1是與DNA損傷應激密切相關的重要檢查點蛋白,并可通過磷酸化CDC25影響CDK的激活,最終使細胞周期發生阻滯。本研究發現,經ATR處理的大鼠卵巢組織中,CHEK1含量隨ATR劑量的增高而呈下降趨勢,而P-CHEK1的表達則呈隨劑量的變化明顯增高。該結果提示,ATR可誘導CHEK1磷酸化激活,一方面通過CDC25途徑使細胞周期發生阻滯,另一方面可激活P53,并通過P53途徑使細胞周期發生阻滯。
P53的磷酸化以及CHEK1的磷酸化可通過ATM途徑實現。ATM基因屬于PI-3K激酶家族成員,其編碼的蛋白具有調控DNA修復過程和調整細胞周期關卡的功能。本研究發現,經ATR處理的大鼠卵巢組織,ATM含量隨ATR劑量的增高而呈下降趨勢,而P-ATM含量則明顯增高。近年來的研究[16-21]表明,ATR可引起氧化應激反應進而引起DNA損傷,而ATM是DNA損傷應答的關鍵調控者。因此我們推測,閉鎖卵泡的產生可能與ATM磷酸化程度增高有關。
通過以上研究,我們推測ATR對大鼠生殖系統產生損傷的可能機制是,ATR誘導細胞內產生大量的ROS,ROS導致DNA損傷,激活ATM進行DNA修復,ATM引起CHEK1和P53磷酸化,同時CHEK1可對P53的磷酸化起到一定的誘導作用。而CHEK1和P53的磷酸化通過誘導細胞周期阻滯,導致閉鎖卵泡的產生,卵巢閉鎖卵泡比例增加通過影響卵泡的成熟及排卵,進而影響生殖功能。該機制尚有待于進一步的研究進行驗證。
參考文獻:
[1]萬年升,顧繼東,段舜山.阿特拉津生態毒性與生物降解的研究[J].環境科學學報,2006,4:552.
[2]KonstantinouIK,HelaDG,AlbanisTA.Thestatusofpesticidepollutioninsurfacewaters(riversandlakes)ofGreece.PartI.Reviewonoccurrenceandlevels[J].EnvironPollut,2006,141(3):555.
[3]GoodmanM,MandelJS,DesessoJM,etal.AtrazineandPregnancyOutcomes:ASystematicReviewofEpidemiologicEvidence[J].BirthDefectsResearchPartB:DevelopmentalandReproductiveToxicology,2014,101(3):215.
[4]SobolewskiM,ConradK,AllenJL,etal.Sex-specificenhancedbehavioraltoxicityinducedbymaternalexposuretoamixtureoflowdoseendocrine-disruptingchemicals[J].NeuroToxicology,2014,45:121.
[5]FraitesMJ,CooperRL,BuckalewA,etal.CharacterizationoftheHypothalamic-Pituitary-AdrenalAxisResponsetoAtrazineandMetabolitesintheFemaleRat[J].ToxicologicalSciences,2009,112(1):88.
[6]WhalenMM,LoganathanBG,YamashitaN,etal.Immunomodulationofhumannaturalkillercellcytotoxicfunctionbytriazineandcarbamatepesticides[J].Chemico-BiologicalInteractions,2003,145(3):311.
[7]AgopianAJ,CaiY,LangloisPH,etal.MaternalResidentialAtrazineExposureandRiskforChoanalAtresiaandStenosisinOffspring[J].TheJournalofPediatrics,2013,162(3):581.
[8]譚文溪,劉劍,上官夢原,等.除草劑阿特拉津對健康雌性小鼠血清性激素水平的影響及其意義[J].吉林大學學報(醫學版),2013,6:1169.
[9]SimpkinsJW,SwenbergJA,WeissN,etal.Atrazineandbreastcancer:aframeworkassessmentofthetoxicologicalandepidemiologicalevidence[J].ToxicolSci,2011,123(2):441.
[10]ZhaoF,LiK,ZhaoL,etal.EffectofNrf2onratovariantissuesagainstatrazine-inducedanti-oxidativeresponse[J].IntJClinExpPathol,2014,7(6):2780.
[11]MckayJA,DouglasJJ,RossVG,etal.Analysisofkeycell-cyclecheckpointproteinsincolorectaltumours[J].JPathol,2002,196(4):386.
[12]柳友清,邢輝,韓曉兵,等.順鉑誘導宮頸癌SiHa細胞周期阻滯及凋亡的研究[J].中華腫瘤防治雜志,2006,4:248.
[13]趙麗晶,許多,程宏,等.20(s)-原人參二醇對體外培養Siha細胞caspase-3表達激活的影響[J].吉林大學學報(醫學版),2011,1:26.
[14]LadelfaMF,PecheLY,ToledoMF,etal.Tumor-specificMAGEproteinsasregulatorsofp53function[J].CancerLett,2012,325(1):11.
[15]馬曉宇.Chk1和p53在腫瘤細胞S期DNA損傷檢查點中的復雜關系研究[D].中國科學技術大學,2012,114.
[16]AbarikwuSO,PantAB,FarombiEO.4-Hydroxynonenalinducesmitochondrial-mediatedapoptosisandoxidativestressinSH-SY5Yhumanneuronalcells[J].BasicClinPharmacolToxicol,2012,110(5):441.
[17]AbarikwuSO,AdesiyanAC,OyelojaTO,etal.Changesinspermcharacteristicsandinductionofoxidativestressinthetestisandepididymisofexperimentalratsbyaherbicide,atrazine[J].ArchEnvironContamToxicol,2010,58(3):874.
[18]AbarikwuSO,AdedaraIA,FarombiEO.Influenceofquercetinonhaematologicalindicesandbiomarkersofoxidativestressintheserumofratsexposedtoatrazine[J].AfrJMedMedSci,2010,39Suppl:81.
[19]ZhuL,DongX,XieH,etal.DNAdamageandeffectsonglutathione-S-transferaseactivityinducedbyatrazineexposureinzebrafish(Daniorerio) [J].EnvironToxicol,2011,26(5):480.
[20]WangJH,ZhuLS,MengY,etal.ThecombinedstresseffectsofatrazineandcadmiumontheearthwormEiseniafetida[J].EnvironToxicolChem,2012,31(9):2035.
[21]SantosTG,MartinezCB.AtrazinepromotesbiochemicalchangesandDNAdamageinaNeotropicalfishspecies[J].Chemosphere,2012,89(9):1118.
The molecular mechanism of follicular dysplasia caused by atrazineNIUTong,SUOQi,LIUJian,etal.(ClinicalCollageofJilinUniversity,Changchun130021,China)
Abstract:ObjectiveTo observe the expressions of ATM,P-ATM,CHEK1,P-CHEK1,P53 and P-P53 in ovarian tissues of rats treated by atrazine (ATR),and to evaluate the possible mechanisms of ATR on follicular maldevelopment.Methods32 female Wistar rats were randomly divided into 4 groups (8/group),treated by a daily gavage of 0,5,25 and 125mg·kg-1atrazine dissolved in corn oil for 28 consecutive days,and sacrificed under anesthesia in day 29.The ovaries were collected to isolate the total protein.Western blot were employed to detect the expressions of ATM,P-ATM,CHEK1,P-CHEK1,P53 and P-P53.ResultsThe expressions of ATM were significantly decreased(P<0.05 orP<0.01) in ATR groups,especially in 25 mg·kg-1ATR group(P<0.01),compared with the control group.While which of P-ATM were significantly increased in dose-dependent manner (P<0.05) in ATR groups.In 25 mg·kg-1and 125 mg·kg-1ATR groups,the expressions of CHEK1 were decreased (P<0.05) and which of P-CHEK1 were increased (P<0.05) compared with the control group,especially in 125 mg·kg-1ATR group.Compared with the control group,the expressions of P53 were decreased in dose-dependent manner (P<0.05) in ATR groups; the expressions of P-P53 were increased (P<0.05) in 25 mg·kg-1and 125 mg·kg-1ATR groups,especially in 25 mg·kg-1ATR group.ConclusionATR may active P53 and CHEK1 inspection points by trigger ATM signal pathway,so as to block the cell cycle,and cause atretic follicles.
Key words:atrazine;ovarian tissue protein;cell cycle;ATM signal pathway
(收稿日期:2015-09-16)
文獻標識碼:A
中圖分類號:Q816
文章編號:1007-4287(2016)02-0194-04
*通訊作者
基金項目:吉林省財政廳科研基金資助課題(2012845)

