突變型 P53 表達對惡性腦膠質瘤替莫唑胺同期放化療療效的影響
劉桂超 胡學鋒 黃國森 林 力 黃澤黎 梁少波 蘇建淳
?
突變型 P53 表達對惡性腦膠質瘤替莫唑胺同期放化療療效的影響
劉桂超胡學鋒黃國森林力黃澤黎梁少波蘇建淳
作者單位:528000 廣東省佛山市第一人民醫院腫瘤中心
【摘要】目的探討突變型 P53 表達對惡性腦膠質瘤替莫唑胺(泰道膠囊)同期放化療療效的影響。方法收集經手術、放療和替莫唑胺聯合治療的33例惡性腦膠質瘤患者,根據P53表達情況分成高表達組(17例)和低表達組(16例)。結果患者性別、年齡、Karnofsky生活狀態(KPS)評分及腫瘤切除情況在兩組患者間無統計學差異,突變型P53低表達組患者的腫瘤無進展生存率明顯高于高表達組(P=0.036),兩組患者的總生存時間比較無統計學差異(P=0.107)。結論突變型P53表達情況可能會影響惡性腦膠質瘤患者替莫唑胺同期放化療的預后。
【關鍵詞】膠質瘤;放射療法;替莫唑胺
(ThePracticalJournalofCancer,2016,31:187~190)
腦膠質瘤是目前中樞神經系統發病率最高的腫瘤,占顱內腫瘤發病率的40%~60%[1]。惡性腦膠質瘤定義是指按照世界衛生組織(World Health Organization,WHO)分級分為Ⅲ和Ⅳ級的腦膠質瘤。惡性腦膠質瘤目前的主要治療手段為:手術治療、化學藥物治療和放射治療。近年來多個試驗均證實術后采用替莫唑胺(temozolomide,TMZ)同期放化療,并序貫6周期TMZ輔助化療的治療模式可顯著改善惡性腦膠質瘤患者的生存[2-4]。
P53基因的突變使腫瘤細胞在缺乏正常P53基因控制的情況下,出現腫瘤細胞的無性繁殖,最終導致腫瘤的惡性轉變[5]。本文擬探討在惡性腦膠質瘤術后行口服TMZ同期放化療,突變型P53表達情況是否會影響患者的預后。
1材料與方法
1.1 納入標準
初診入院行手術治療的腦膠質瘤患者,術后病理分級為WHO Ⅲ級或Ⅳ級。年齡18~70歲,性別不限,預計生存期>6個月,KPS評分≥40分,心肝腎功能正常,外周白細胞計數≥4.0×109/L,血小板計數≥100×109/L,心電圖基本正常,無明確的放化療禁忌癥。所有患者治療前填寫知情同意書,手術前和放療前均已行顱腦MRI檢查(平掃+增強)。
1.2 分組
收集2013年1月至2014年12月在佛山市第一人民醫院腫瘤中心就診的惡性腦膠質瘤患者,所有患者的術后病理標本均行突變型P53免疫組化檢測,采用DAB染色后光鏡下觀察結果,將該檢測方法觀察到陽性細胞率>10%放入突變型P53高表達組,將觀察到陽性細胞率<10%放入為突變型P53低表達組。
1.3 放射治療
所有入組的患者在術后2~4周內開始行放療前CT定位并制定放療計劃。患者采用仰臥舒適位,下墊頭枕,頭部覆蓋U型的熱塑面罩行體位固定,面罩制定完畢后冷卻半小時以上。然后患者在飛利浦大孔徑螺旋CT模擬機下行平掃+增強CT定位掃描,掃描的范圍為顱頂上20.0 mm至下頜下緣,層厚3.0 mm,層距3.0 mm。獲得的CT掃描圖像傳輸至Pinnacle靶區勾畫系統進行靶區勾畫。靶區勾畫的原則為:臨床腫瘤靶體積(gross tumor volume,gTV)為顱腦MR及CT顯示的術后殘留腫瘤病灶,如無腫瘤殘留病灶則無須勾畫;高危臨床靶體積(clinical target volume 1,CTV1)為GTV或術腔的基礎上外擴10.0 mm形成;低危臨床靶體積(clinical target volume 2,CTV2)為GTV或術腔的基礎上外擴20.0~30.0 mm形成(其中膠質瘤Ⅲ級外擴20.0~ 25.0 mm,膠質瘤Ⅳ級外擴25.0~ 30.0 mm)。GTV、CTV1、CTV2外擴3.0 mm形成各自的計劃靶體積(planning target volume,PTV),分別定義為PGTV、PTV1、PTV2。分別給予的處方劑量為:PGTV 64~68 Gy/27~28次,PTV1 60~62 Gy/27~28次,PTV2 50~52 Gy/27~28次。靶區勾畫完成后需要提交科室內部集體討論,討論并修改后由物理師進行放療計劃的制定,制定放療計劃的系統為瓦里安的Eclipse。放療計劃制定完畢后由醫生和物理師共同確認通過后實施治療。
1.4 化學治療
調強放療期間口服TMZ(泰道,美國默沙東制藥有限公司)同期化療,同期化療方案:放療第1天開始睡前口服TMZ 75 mg/(m2·d),必要時給予護胃及止嘔藥物聯合口服。放療結束后4周開始進行6個周期的TMZ輔助化療,具體方案為:每日睡前口服TMZ 150 mg/m2,連續口服5天,休息23天,每28天為1個周期,根據患者耐受情況可以將TMZ的劑量調整至最高200 mg/m2。
1.5 不良反應、療效評價及隨訪方法
放療的不良反應按RTOG急性放射損傷分級標準進行評價,化療的不良反應采用NCI-CTC4.0進行評估。治療結束后每3個月復查一次顱腦平掃+增強MR。以無進展生存率 (progression-free survival,PFS)及總生存率(overall survival,OS)作為患者的生存觀察指標。無進展生存時間為手術當天至患者出現顱內病灶進展或復發時間間隔;總生存時間為手術當天起至患者死亡或最后一次隨訪的時間間隔。
1.6 統計學分析
所得的數據采用SPSS 13.0統計軟件包進行統計學處理,兩組患者的年齡、性別、腫瘤切除情況等對比分析采用卡方檢驗,無病生存率及總生存率采用 Kaplan-Meier法計算,并經Log-rank法檢驗,以P<0.05為差異有統計學意義。
2結果
共收集符合入組條件的患者33例,其中男性15例,女性18例,患者年齡20 ~ 68歲,中位年齡37歲。病理分級:Ⅲ級15例,Ⅳ級18例。突變型P53高表達組患者17例,其中Ⅲ級8例,Ⅳ級9例;突變型P53低表達組患者共有16例,其中Ⅲ級7例,Ⅳ級9例。兩組患者均完成了同期放化療,兩組各有2例患者因血液學及胃腸道等不良反應未完成6個周期的輔助化療。兩組患者的臨床資料比較差別無統計學意義(P>0.05),具有可比性,詳見表1。
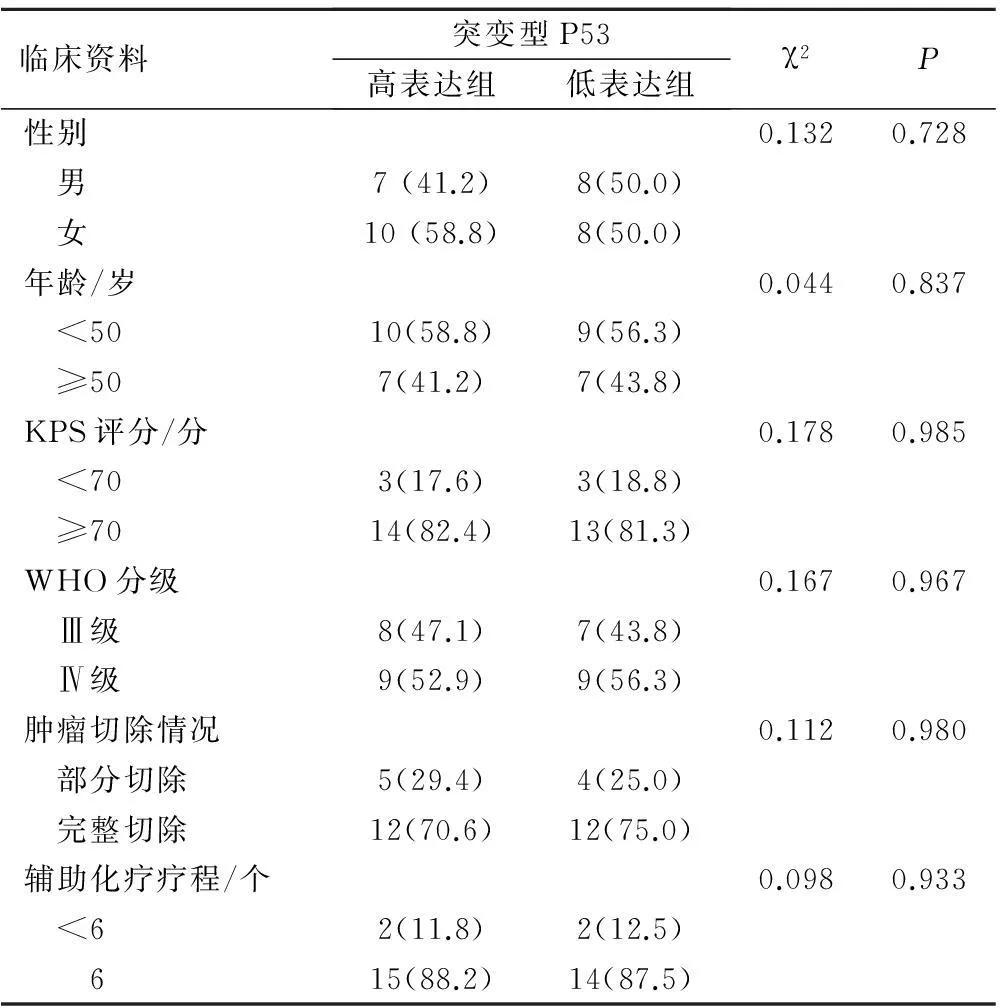
表1 兩組患者臨床資料比較(例,%)
隨訪時間為7.2~31.5個月(中位19.3個月),至隨訪結束,共有10例患者死亡,均為死于顱內病灶進展導致的腦疝,共19患者經影像學證實有顱內病灶進展。其中突變型P53高表達組有7例死亡,顱內病灶進展13例;而突變型P53低表達組有3例死亡,6例出現顱內病灶進展。生存分析顯示兩組腫瘤無進展生存率比較有統計學差異(P=0.036),見圖1,但兩組總生存率比較無統計學差異(P=0.107),見圖2。
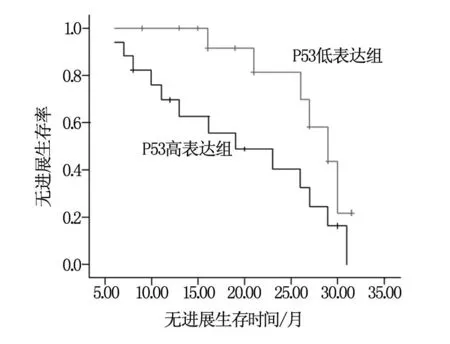
圖1 兩組患者無進展生存率比較
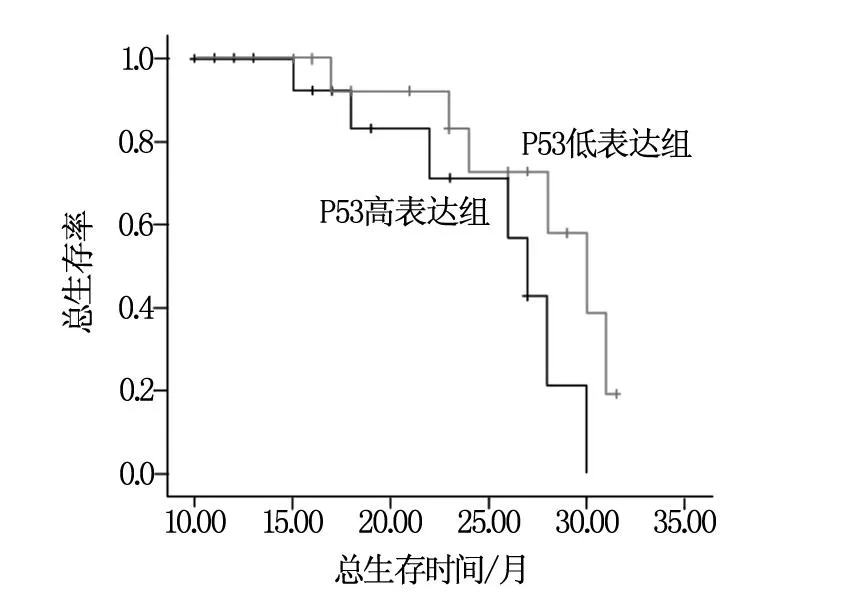
圖2 兩組患者總生存率比較
3討論
根據 WHO分級系統,腦膠質瘤分為WHO Ⅰ~ Ⅳ級,其中WHO Ⅲ級和WHO Ⅳ級屬于惡性腦膠質瘤。惡性腦膠質瘤包括WHO分級為Ⅲ級的間變性星形細胞瘤(anaplastic astrocytomas,AA) 、間變性少突膠質瘤(anaplastic oligodendrogliomas,AO)、間變性少突星形細胞瘤(anaplastic oligoastrocytomas,AOA);WHO分級為Ⅳ級的多形性膠質母細胞瘤(glioblastoma multiforme,GBM)。上述4種中惡性腦膠質瘤以AA和GBM最為常見,占惡性腦膠質瘤的80%以上[6]。惡性腦膠質瘤具有浸潤性生長、容易局部復發和出現顱內甚至脊髓播散轉移的特點。惡性腦膠質瘤對有神經髓鞘纖維的親和力較高,因此能沿著神經髓鞘纖維向更遠的范圍侵襲,并且惡性腦膠質瘤多伴有明顯的瘤周水腫,最終導致腫瘤組織與周圍正常的腦組織分界不清。惡性腦膠質瘤的手術治療是整個綜合治療過程的重要環節,可以在切除腫瘤的同時得到病理診斷。神經顯微外科技術的發展能最大限度的切除腫瘤組織,但由于惡性腦膠質瘤浸潤性生長的特點,以及重要神經的中樞需要盡可能多的保留原因,比較難切除所有的腫瘤細胞。因此惡性腦膠質瘤單純手術治療效果差,手術后腫瘤復發率高,術后的輔助放化療可以提高惡性腦膠質瘤患者的預后。
1998年Huncharek等[7]對9項臨床研究的綜合分析結果表明,放療期間聯合化療對于惡性腦膠質瘤的患者并沒有帶來明顯的生存獲益。2001年英國醫學研究理事會的腦瘤工作組(Medical Research Council Brain Tumor Working Party)[8]進行了一項674例惡性腦膠質瘤的隨機對照研究,339例患者行單純放療、335例患者行放療+PCV方案(甲基芐肼、環已亞硝脲和長春新堿) 同期化療,最終結果顯示兩組患者的生存率并沒有差異。但是2002年GMT(Glioma Meta-analysis Trialists)工作組[9]綜合分析了12項臨床研究得出的結論是:惡性腦膠質瘤患者采用同期化療,能夠增加6%的1年生存率和提高2個月的中位生存期。
TMZ是1種新型的含有咪唑四嗪(imidazotetrazine)環的烷化劑類抗腫瘤藥物,TMZ是1種小分子脂溶性物質易于通過人的血腦屏障,在體內具有較好的組織分布性,生物利用度接近100%,因此能用于中樞神經系統惡性腫瘤的治療。TMZ能與腫瘤細胞的核酸、蛋白質以及肽親核區發生作用,作用于腫瘤細胞分裂的每個時期,屬于細胞周期非特異性藥物,因此具有廣譜抗腫瘤活性。2005年進行的一項惡性腦膠質瘤多中心、隨機對照的Ⅲ期臨床研究表明,采用TMZ聯合同期放化療組的患者,無論是2年生存率、中位生存期及無進展生存期均明顯優于單純放療組的患者,差異均有統計學意義[2]。2012年進行的一項隨機也表明TMZ的療效明顯優于傳統化療藥物[10]。有學者針對國內外5個大中心的隨機對照研究結果(共896例患者)進行了薈萃分析[11],結果表明放療聯合TMZ的治療方案可以提高惡性腦膠質瘤患者的18個月和24個月的總生存率,改善患者的6、12、18、24個月的無進展生存期。雖然TMZ目前的標準輔助化療方案為6個療程,臨床上仍有不少學者嘗試大于6個療程的長周期化療方案,并且發現其療效優于標準方案,并且不良反應發生率也無明顯增加[12-13]。也有學者嘗試采用TMZ給藥大于5天的密集輔助化療方案取得了一定的療效[14]。
P53基因是目前研究的最為廣泛深入的腫瘤基因之一。P53基因全長約為160 000~20 000 bp,位于人17號染色體短臂(17p13.1),正常的P53基因能夠維持細胞的遺傳穩定性,因為當細胞的內基因受到損傷時,正常的P53基因所產生的P53蛋白會誘導該細胞進入凋亡程序,但當P53基因出現等位缺失或突變時,受損傷的細胞就會存活下來,導致了細胞遺傳基因的不穩定性,存活下來的細胞核內基因擴增、細胞染色體倍體發生改變,最終的結果是促進腫瘤的發生和發展。目前報道的突變型P53基因表達與腦膠質瘤的預后的關系的文獻較多,但由于所選擇病例的不同,尚未形成統一意見[15-17]。部分研究認為突變型P53基因表達與腦膠質瘤預后無顯著的統計學關系;部分研究結果則提示突變型P53基因表達的患者生存期較短,預后較差;也有少數結果認為突變型P53基因表達提示生存期較長。國內天壇醫院2008年進行了一項病例數為30例的前瞻性臨床對照研究表明應用術后單純放療+序貫TMZ輔助化療的膠質母細胞瘤患者中,16例患者呈突變型P53高表達,14例患者呈突變型P53低表達,研究結果顯示突變型P53低表達組患者的無進展生存時間明顯長于高表達組(P<0.05),但兩組患者的總生存時間無統計學差異[16]。本研究與天壇醫院的研究的不同點在于放療期間聯合TMZ同期化療,但最終結果同樣提示突變型P53低表達組患者的無進展生存率優于高表達組(P=0.036)。因此本研究表明,突變型P53表達情況可能會影響惡性腦膠質瘤患者治療的預后,總生存率差異無統計學意義可能與樣本量較小有關,后續還需擴大樣本量和延長隨訪時間來進一步證實。
參考文獻
[1]Ostrom QT,Gittleman H,Liao P,et al.CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2007-2011〔J〕.Neuro Oncol,2014,16 (Suppl 4):iv1-63.
[2]Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma〔J〕.N Engl J Med,2005,352(10):987-996.
[3]Scoccianti S,Magrini SM,Ricardi U,et al.Radiotherapy a-
nd temozolomide in anaplastic astrocytoma:a retrospective multicenter study by the Central Nervous System Study Group of AIRO (Italian Association of Radiation Oncology)〔J〕.Neuro Oncol,2012,14(6):798-807.
[4]Zhang L,Wu X,Xu T,et al.Chemotherapy plus radiotherapy versus radiotherapy alone in patients with anaplastic glioma:a systematic review and meta-analysis〔J〕.J Cancer Res Clin Oncol,2013,139(5):719-726.
[5]Hechler D,Nitsch R,Hendrix S.Green-fluorescent-protein-expressing mice as models for the study of axonal growth and regeneration in vitro〔J〕.Brain Res Rev,2006,52(1):160-169.
[6]Omuro A,DeAngelis LM.Glioblastoma and other malignant gliomas,a clinical review〔J〕.JAMA,2013,310(17):1842-1850.
[7]Huncharek M,Muscat J,Geschwind JF.Multi-drug versus single agent chemotherapy for high grade astrocytoma;results of a metaanalysis〔J〕.Anticancer Res,1998,18(6B):4693-4697.
[8]Medical Research Council Brain Tumor Working Party.R-
andomized trial of procarbazine,lomustine,and vincristine in the adjuvant treatment of high-grade astrocytoma:a Medical Research Council trial〔J〕.J Clin Oncol,2001,19(2):509-518.
[9]Glioma Meta-analysis Trialists (GMT) Group.Chemotherapy in adult high-grade glioma:a systematic review and meta-analysis of individual patient data from 12 randomised trials〔J〕.Lancet,2002,359(9311):1011-1018.
[10]武新虎,朱錫旭,沈澤天,等.替莫唑胺與福莫司汀治療惡性腦膠質瘤的臨床觀察〔J〕.現代腫瘤醫學,2012,20(6):1165-1168.
[11]王小虎,郭麗云,馬彬,等.放療聯合替莫唑胺治療多形性成膠質細胞瘤的meta分析〔J〕.腫瘤,2010,30(12):1056-1064.
[12]Roldán Urgoiti GB,Singh AD,Easaw JC.Extended adjuvant temozolomide for treatment of newly diagnosed glioblastoma multiforme〔J〕.J Neurooncol,2012,108(1):173-177.
[13]Mannas JP,Lightner DD,Defrates SR,et al.Long-term tre-
atment with temozolomide in ma-lignant glioma〔J〕.J Clin Neurosci,2014,21(1):121-123.
[14]Nagane M.Dose-dense temozolomide:Is it still promising〔J〕.Neurol Med Chir (Tokyo),2015,55(1):38-49.
[15]Stark AM,Hugo HH,Witzel P,et al.Age-related expression of p53,Mdm2,EGFR and Msh2 in glioblastoma multiforme〔J〕.Zentralbl Neurochir,2003,64(1):30-36.
[16]李守巍,陳寶師,崔云,等.P53表達對膠質母細胞瘤替莫唑胺療效的影響〔J〕.中華神經外科雜志,2008,24(5):363-365.
[17]Martha L,Simmons,Kathleen R,et al.Analysis of complex relationships between age,p53,epidermal growth factor receptor,and survival in glioblastoma patient〔J〕.Cancer Res,2001,61(3):1122-1128.
(編輯:吳小紅)
Expression of Mutant P53 Status on Efficacy of Temozolomide Combined with
Radiotherapy for Malignant Glioma
LIUGuichao,HUXuefeng,HUANGGuosen,etal.CancerCenter,theFirstPeople'sHospitalofFoshanCity,Foshan,528000
【Abstract】ObjectiveTo explore the impact of P53 status to response of temozolomide combined with radiotherapy on malignant glioma patients.MethodsGioblastomas were treated with surgical resection,radiotherapy and temozolomide capsule chemotherapy.They were divided into high mutant P53 expression group (17 cases) and low mutant P53 expression group (16 cases).ResultsThere had no statistically significant difference in age,gender,KPS score or extent of resection existed between the 2 groups.Patients with low mutant P53 expression had much better progression-free survival time than those with high mutant P53 expression.There had no statistical significance in overall survival time between the 2 groups.ConclusionThe P53 status may affect the prognosis of temozolomide combined with radiotherapy for malignant glioma.
【Key words】Glioma;Radiotherapy;Temozolomide
(收稿日期2015-11-09修回日期 2015-12-12)
中圖分類號:R739.41
文獻標識碼:A
文章編號:1001-5930(2016)02-0187-04
DOI:10.3969/j.issn.1001-5930.2016.02.004
基金項目:佛山市醫學類科技攻關項目(編號:201308057)

