牛乳κ-酪蛋白活性多肽及其改造肽的合成和生物活性
王小青,趙紅玲,高 楊,宮聞婧,尹志峰,王良友
(1.承德醫學院 河北省中藥研究與開發重點實驗室,河北 承德 067000;
2.承德天創生物制品有限公司,河北 承德 067000)
?
牛乳κ-酪蛋白活性多肽及其改造肽的合成和生物活性
王小青1,趙紅玲1,高楊1,宮聞婧2,尹志峰1,王良友1
(1.承德醫學院 河北省中藥研究與開發重點實驗室,河北 承德 067000;
2.承德天創生物制品有限公司,河北 承德 067000)
摘要:為獲得抗凝血活性更強的多肽,對牛乳κ-酪蛋白(κ-CN)的十一肽(f106-116)進行設計合成并改造,采用Fmoc固相合成策略,以Wang樹脂為載體,Fmoc保護氨基酸為原料,HOBT/DIC為縮合劑,TFA/苯甲硫醚/EDT/苯甲醚裂解體系脫除保護基,經RP-HPLC純化后得到了純度>95%的9種多肽,經ESI-MS確證其結構。將所有的合成肽進行凝血酶時間(TT)、活化部分凝血活酶時間(APTT)以及凝血酶原時間(PT)活性測定,結果表明,各改造肽抗凝活性皆低于十一肽,增強牛乳κ-CN的十一肽片段的疏水性,其TT活性增強。
關鍵詞:牛乳κ-酪蛋白活性多肽;固相合成;抗凝活性
近年來研究發現,食源性抗血栓肽主要來源于牛乳κ-酪蛋白(κ-CN)的水解產物[1],其中κ-CN十一肽MAIPPKKNQDK(f106-116)可抑制ADP誘導的血小板凝集及人血纖維蛋白原與血小板表面上特異受體的結合而具有抗血栓活性[2]。ditSollier等[3]發現五肽KNQDK(f112-116)對ADP誘導的血小板凝集的抑制作用較強,而MAIPPKK(f106-112)和NQDK(f113-116)抑制血小板功能的作用較弱,可能是由于其缺少N端的Lys殘基。在激光損傷引發的動脈粥樣硬化模型中檢測到κ-CN十一肽和五肽在體內都具有潛在的抗血栓活性。Jolles等[4]從牛乳κ-CN的胰蛋白酶水解液中分離出短肽MAIPP(f106-110),可抑制人血纖維蛋白原結合到血小板表面的特異受體位點。Teschemacher等[5]證實片段KDQDK在豚鼠體內具有顯著的抗血栓活性。
作者采用Fmoc固相合成策略合成了十一肽、五肽(KDQDK、KNQDK)、PKKNQDK、PPKKNQDK、IPPKKNQDK等6條短肽,并將Pro4替換成Phe4,設計合成了FPKKNQDK、IFPKKNQDK等2條改造肽。同時,D殘基取代的肽可以有效地耐受蛋白酶降解作用[6],合成了(D)FPKKNQDK。對合成的十一肽及各改造肽進行凝血酶時間(TT)、活化部分凝血活酶時間(APTT)和凝血酶原時間(PT)活性檢測,擬為生物活性多肽藥物的研發提供參考。
1實驗
1.1 材料、試劑與儀器
固相合成載體Wang樹脂(替代度為1.17mmol·g-1),天津南開合成科技有限公司;肽鏈中所有保護氨基酸,成都誠諾新技術有限公司;羥基苯并三氮唑(HOBT)、N,N′-二異丙基碳二亞胺(DIC),蘇州中科天馬肽工程中心有限公司;冰乙醚、三氟乙酸(TFA),天津風船化學試劑科技有限公司;哌啶、苯甲硫醚、間甲酚、苯甲醚,上海晶純試劑有限公司;1,2-乙二硫醇(EDT),Sigma-Aldrich;N,N′-二甲基甲酰胺(DMF)、乙腈,天津科密歐化學試劑有限公司;二氯甲烷(DCM),天津博迪化工股份有限公司;超純水,自制;雄性昆明小鼠[體重(20±2g),SCXK(京)2009-0004],北京華阜康生物科技有限公司;APTT、PT、TT試劑盒,美德太平洋科技有限公司。
XMTD-6000型恒溫水浴鍋,余姚上通溫控儀器廠;Newstyle型反相高效半制備液相色譜儀,蘇州漢邦科技有限公司;Ultimate3000/MSQ型戴安液相色譜-質譜聯用儀,美國戴安公司;CHRIST型凍干機,北京博勵行儀器有限公司;高速大容量離心機,上海安亭科學儀器廠;Agilent1200型高效液相色譜儀,安捷倫科技有限公司。
1.2 方法
1.2.1牛乳κ-CN活性肽及其改造肽的合成、純化及鑒定
在洗凈并干燥的反應柱中加入Wang樹脂,加DMF通氮氣溶脹30min,充分溶脹后抽掉DMF。稱取4倍于樹脂量的Fmoc-Lys(Boc)-OH、4倍于樹脂量的DMAP∶HOBT∶DIC(0.1∶1.2∶1.2,物質的量比),溶于DMF,冰浴活化5min,加入反應柱中反應2h,茚三酮檢測合格后,抽干,分別用DMF與DCM洗滌樹脂,并進行替代度檢測,加入20~40倍的醋酸酐與吡啶1∶1(物質的量比)混合液封閉14h。加入適量的DBLK溶液(20%哌啶DMF溶液)脫Fmoc保護基2次,時間分別為5min和7min,茚三酮檢測合格后,用DMF和DCM分別洗滌樹脂,抽干溶劑。按照上述方法延伸肽鏈直至連接完整條肽鏈。沖洗樹脂,加甲醇收縮2次(5min·次-1),減壓干燥至恒重,得干燥肽樹脂。
稱取干燥至恒重的肽樹脂200.0mg,置于PE管中,加入裂解液TFA∶苯甲硫醚∶EDT∶苯甲醚(9∶0.5∶0.3∶0.2,體積比)2mL,冰浴反應30min,逐漸升至室溫,于室溫下反應1h。過濾,用少許TFA洗滌樹脂,將濾液傾入20mL無水冰乙醚中,析出白色固體,0 ℃靜置沉降20min。4 000r·min-1離心4min,棄去上清液,重復5次,真空干燥至恒重,得粗肽。
將粗肽用無氧水溶解,經半制備型RP-HPLC純化得到純度大于95%的多肽:半制備柱HederaODS-2反相硅膠柱(10mm×250mm,10 μm);檢測波長215nm;采用乙腈/0.1%TFA水分離體系,流速8mL·min-1,乙腈25%~55%,洗脫時間30min。純化后多肽經高效液相色譜分析,色譜柱KromasilC18(4.6mm×250mm,5 μm),以乙腈/水為分析體系(0.1%TFA), 乙腈5%~95%,流速1mL·min-1,20min梯度洗脫。純化后多肽的分子量經ESI-MS分析確證。
牛乳κ-CN十一肽改造肽的合成、純化及鑒定方法同上。
1.2.2TT、APTT及PT活性測定
1)空白血漿制備
小鼠眼眶靜脈叢取血,按體積比9∶1加入含0.109 mol·L-1的枸櫞酸鈉抗凝劑,輕輕混合均勻。3 000 r·min-1離心15 min,制備乏血小板血漿(即空白血漿),備用。
2)待測樣品制備
精密稱取純化后的多肽樣品,超純水溶解成2 mg·mL-1溶液,(37±0.1) ℃水浴中預溫,備用。
3)TT活性測定
按照試劑盒說明,TT試劑加入復溶液復溶,用前顛倒混勻。取200μL空白血漿,加入預溫的10μL多肽樣品在37 ℃下預溫3 min,加入200μL TT試劑并記錄凝固時間,重復2次取平均值。
4)APTT活性測定
按照試劑盒說明,取100μL空白血漿,加入10μL多肽樣品、100μL APTT試劑,37 ℃下預溫5 min,再加入已預溫至37 ℃的CaCl2溶液100μL,記錄凝固時間,重復2次取平均值。
5)PT活性測定
按照試劑盒說明,取100μL空白血漿,加入10μL多肽樣品在37 ℃下預溫3 min,再加入已預溫至37 ℃的PT試劑200μL,記錄凝固時間,重復2次取平均值。
2結果與討論
2.1 合成肽的氨基酸順序及相對分子質量(表1)
表1合成肽的氨基酸順序及相對分子質量
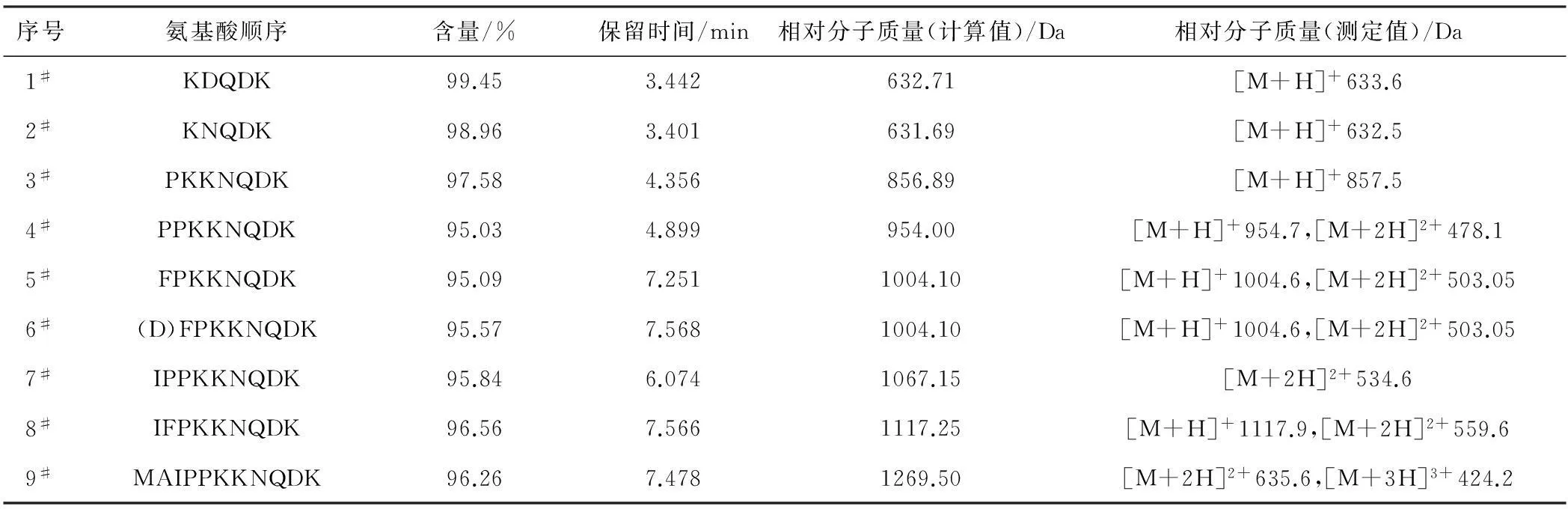
Tab.1 Amino acid sequence and relative molecular mass of the synthetic peptide
由表1可知,所合成的9個多肽化合物經RP-HPLC純化后,各產物的HPLC純度均大于95%。由ESI-MS結果可知,各多肽的[M+H]+峰測定值與計算值一致,[M+2H]2+與多肽帶兩個單位正電荷保持一致,確證了各個化合物的分子結構。
2.2 TT、APTT及PT活性的測定結果(表2)
表2TT、APTT 及PT活性的測定結果

Tab.2 The results of TT, APTT and PT activities
注:n=3;**P<0.05;***P<0.01。
由表2可知,短肽1#、2#和9#三條合成肽的TT活性與水相比有極顯著性差異;短肽3#的TT活性與水相比有極顯著性差異;短肽4#和7#的TT活性與水相比有顯著性差異;而由疏水性強的Phe4代替疏水性次之的Pro4的短肽5#和8#的TT活性增強,與水相比有極顯著性差異。同時各改造肽的TT活性皆低于十一肽及五肽。
短肽1#、2#、5#和6#的APTT活性與水相比有極顯著性差異;短肽7#的APTT活性與水相比有顯著性差異;田壘等[7]分別以Leu、Phe、Tyr及Ser改造多肽,增強整個分子的疏水性,從而提高了GⅢb/Ⅲa受體與該分子的疏水鍵強度,使得APTT活性增強。短肽5#、6#為Phe或D-Phe替換Pro的改造肽,增強了整個分子的疏水性,因而APTT活性增強。
十一肽、五肽以及其各改造肽與水相比,PT活性在統計學上沒有顯著性差異。
3結論
牛乳κ-酪蛋白五肽具有明顯的TT活性和APTT活性,十一肽具有明顯的TT活性,改造肽的抗凝活性皆低于十一肽,改造肽分子疏水性增強,其APTT活性增強。PT活性測定結果表明,牛乳κ-酪蛋白十一肽及其改造肽不是通過外源性途徑抗血液凝聚。
參考文獻:
[1]BEUCHER S,LEVENEZ F,YVON M,et al.Effects of gastric digestive products from casein on CCK release by intestinal cells in rat[J].The Journal of Nutritional Biochemistry,1994,5(12):578-584.
[2]JOLLES P,CAEN J P.Parallels between milk clotting and blood clotting:Opportunities for milk-derived products[J].Trends in Food Science & Technology,1991,2(1):42-43.
[3]dit SOLLIER C B,DROUET L,PIGNAUD G,et al.Effect ofκ-casein split peptides on platelet aggregation and on thrombus formation in the guinea-pig[J].Thrombosis Research,1996,81(4):427-437.
[4]JOLLES P,LOUCHEUX-LEFEBVRE M H,HENSCHEN A.Structural relatedness ofκ-casein and fibrinogenγ-chain[J].Journal of Molecular Evolution,1978,11(4):271-277.
[5]TESCHEMACHER H,KOCH G,BRANTL V.Milk protein-derived opioid receptor ligands[J].Biopolymers,1997,43(2):99-117.
[6]王德心.活性多肽與藥物開發[M].北京:中國醫藥科技出版社,2008:77-80.
[7]田壘,霍建麗,王衛國,等.新的抗凝血三肽及其改造物的合成和生物活性[J].西北藥學雜志,2009,24(3):191-194.
Synthesis and Bioactivity of Milkκ-Casein Active Peptides and Transformation Peptides
WANG Xiao-qing1,ZHAO Hong-ling1,GAO Yang1,GONG Wen-jing2,YIN Zhi-feng1,WANG Liang-you1
(1.HebeiKeyLaboratoryofResearchandDevelopmentforTraditionalChineseMedicine,ChengdeMedical
College,Chengde067000,China;2.ChengdeTianchuangBiologicalProductsCorporation,Chengde067000,China)
Abstract:In order to obtain peptides with higher anticoagulant activity,eleven peptide(f106-116) from milk κ-casein(κ-CN) and its transformations were successfully synthesized according to its peptide sequence using Wang resin as a solid supporter with Fmoc-amino acids as raw materials and HOBT/DIC as condensing agent.The peptide was cleaved from the resin with the reagent of TFA/thioanisole/EDT/anisole.After purified by RP-HPLC,9 peptides with the purity above 95% were obtained and confirmed by an ESI-MS.The TT,APTT and PT activities of all synthetic peptides were measured.The anticoagulant activity of transformation peptide was lower than that of eleven peptide,whilst the activity of TT was enhanced with the increase of hydrophobicity of eleven peptide from milk κ-CN.
Keywords:milk κ-casein active peptides;solid-phase synthesis;anticoagulant activity
中圖分類號:Q 516O 623.736
文獻標識碼:A
文章編號:1672-5425(2016)01-0030-03
作者簡介:王小青(1984-),女,河北承德人,助理研究員,研究方向:生物活性多肽藥物的研發,E-mail:wangxqsmart@163.com;通訊作者:王良友,副教授。
收稿日期:2015-10-23
基金項目:河北省海外高層次人才“百人計劃”資助項目(E201200002)
doi:10.3969/j.issn.1672-5425.2016.01.007

