氫質子磁共振波譜聯合彌散加權成像在鑒別腦膠質瘤術后復發及放射性損傷中的應用價值▲
劉鐵軍 鄭英杰
(廣西柳州市人民醫院放射科,柳州市 郵編,E-mail:lzryltjmr@126.com)
臨床創新
氫質子磁共振波譜聯合彌散加權成像在鑒別腦膠質瘤術后復發及放射性損傷中的應用價值▲
劉鐵軍 鄭英杰
(廣西柳州市人民醫院放射科,柳州市 郵編,E-mail:lzryltjmr@126.com)
目的 探討氫質子磁共振波譜(1H-MRS)聯合彌散加權成像(DWI)在鑒別腦膠質瘤術后復發及放射性損傷中的應用價值。方法 選取25例腦膠質瘤術后復發(復發組)及15例放射性腦損傷患者(放射性壞死組),均行1H-MRS和DWI檢查,收集患者治療后首次出現實質強化區的膽堿(Cho)/肌酐(Cr)、Cho/N-乙酰天門冬氨酸(NAA)、NAA/Cr比值,以及相應區域的表觀彌散系數(ADC)值。并應用受試者工作特征(ROC)曲線評價以上4個參數鑒別腦膠質瘤術后復發及放射性損傷的效能。結果 放射性壞死組的ADC值顯著高于復發組(P<0.05),而Cho/Cr和Cho/NAA值顯著低于復發組(P<0.05);兩組NAA/Cr比較,差異無統計學意義(P>0.05)。ROC曲線結果顯示,Cho/Cr值曲線下面積為0.935,診斷界值為2.24(P<0.05),敏感性及特異性分別為93.3%、86.4%;Cho/NAA曲線下面積為0.874,診斷界值為1.975(P<0.05),敏感性及特異性分別為100.0%、78.0%;NAA/Cr曲線下面積為0.618,診斷界值為0.625(P>0.05);ADC曲線下面積為0.974,診斷界值為9.895×10-4 mm2/s(P<0.05),敏感性及特異性分別為86.7%、100.0%。結論1H-MRS和DWI的多個參數能夠有效鑒別膠質瘤復發與放射性損傷,對臨床治療方案的制訂具有重要參考價值。
腦膠質瘤;氫質子磁共振波譜成像;彌散加權成像;術后;復發;放射性性腦損傷
腦膠質瘤作為顱內最常見的原發性腫瘤,其生長方式為沿白質纖維束浸潤性生長,且惡性程度越高浸潤越明顯,因此手術難以完全徹底切除腫瘤,通常需要在術后輔助以放射治療以延長患者的生存期。但在臨床工作中,放射性損傷已經成為放射治療的嚴重并發癥,并且放射性性腦損傷影像學特征與膠質瘤復發類似。對放射性腦損傷與膠質瘤復發進行鑒別對臨床制定下一步治療方案有重要參考價值,因此這成為臨床關注和研究的熱點[1]。本文旨在通過氫質子磁共振波譜(1H-proton magnetic resonance spectroscopy,1H-MRS)結合彌散加權成像(diffusion-weighted imaging,DWI),評價兩種磁共振技術在鑒別腦膠質瘤復發及放射性腦損傷中的應用價值,為快速準確地鑒別放射性腦損傷和膠質瘤復發提供有效的影像學參數。
1 資料與方法
1.1 臨床資料 選取2013年1月至2015年12月我院收治的40例腦膠質瘤術后復發或放射性腦損傷患者,年齡(43±7.8)歲,其中膠質瘤復發(復發組)25例,放射性腦損傷(放射性損傷組)15例。納入標準:(1)所有患者均經常規放射治療;(2)均經手術病理或隨訪(隨訪時間>6個月)證實為腦膠質瘤復發或放射性腦損傷,常規MRI掃描首次發現強化灶以后立刻進行DWI和1H-MRS掃描。排除標準:(1)放射治療后時間短于半年;(2)病變部位特殊,病灶接近顱頂及顱底骨質,易造成磁場不均勻,影響檢查結果準確性;(3)患者有起搏器置入及其他磁共振檢查的禁忌證[2]。放射性腦損傷的診斷標準:手術病理未見腫瘤細胞;或影像學定期隨診病灶無變化或病灶縮小,水腫減輕;臨床表現逐漸好轉。腫瘤復發的診斷標準:手術病理找到腫瘤細胞或影像學定期隨診病灶進行性增大;臨床表現逐漸惡化。
1.2 檢查方法 使用Philips Achieva 3.0T TX/GE Singa HDe 1.5T磁共振成像系統、8通道相控陣線圈進行掃描。檢查序列包括常規T1加權成像(T1-weighted image,T1WI)、T2加權成像(T2-weighted image,T2WI)、DWI和1H-MRS。具體成像參數:T1WI,層厚7 mm,層間距2 mm,視野(field of vision,FOV )24 cm×24 cm,矩陣192×256,激勵次數(number of excitations,NEX)=2,T1加權液體衰減反轉恢復(T1-weighted fluid-attenuated inversion recovery,T1-FLAIR)序列,重復時間(repetition time,TR)/重復時間(echo time,TE)=2 100 ms/9.0 ms,反轉時間(invert time,TI)=750 ms,成像時間90 s;T2WI,層厚7 mm,層間距2 mm,FOV 24 cm×24 cm,矩陣192×256,NEX=2,快速自旋回波(turbo spin echo,TSE)/快速自旋回波(fast spin echo,FSE)序列,TR/TE=3 000 ms/95 ms,成像時間110 s;DWI:采用自旋回波(spin echo,SE)平面成像技術,3個垂直平面彌散梯度,b值取0、1 000 s/mm,TR/TE=8 000 ms/120 ms,層厚/間隔6 mm/1 mm,成像時間約60 s。在常規增強完成后行1H-MRS掃描,采用3D/2D點分解頻譜分析法(point resolve spectroscopy,PRESS)序列,反轉角90°,FOV 12 cm×12 cm,體素10 mm×10 mm,TR 1 000 ms,信號平均次數(number of signal averaged,NSA)=1,用時6 min 10 s,體素放置區盡量避開囊變、壞死等部位。
1.3 數據處理 應用MR Extended Workspace(EWS)工作站后處理軟件進行1H-MRS和DWI分析。(1)1H-MRS分析方法為:將MRS原始圖像導入工作站,軟件自動完成信號平均、基線校正、相位循環、代謝物識別及峰值計算,分別獲得實質強化區域的膽堿(choline,Cho)/肌酸(creatine,Cr)、CHo/N-乙酰天門冬氨酸(N-acetyl aspartate,NAA)和NAA/Cr值。(2)DWI分析方法為:將DWI圖像導入工作站,自動計算出表觀彌散系數(apparent diffusion coefficient,ADC)圖,ADC值的實質強化區測量應盡量與1H-MRS體素放置區保持一致,本研究中經3次測量,取標準差最小的一組數據的平均值。實質強化區的確定需結合T1增強圖像,并由兩位有10年以上臨床經驗的醫生共同確定,選取實質強化區最大層面,并盡量避開囊變、壞死、出血等區域。
1.4 統計學分析 應用SPSS19.0軟件進行統計學分析,計量資料以(x±s)表示,所有數據均進行正態性檢驗,對于滿足正態分布的數據采用獨立樣本t檢驗,不滿足的采用Mann-Whitney U檢驗。本文中所有數據均滿足正態分布,采用獨立樣本t檢驗。應用受試者工作特征(receiver operating characteristic,ROC)曲線求得曲線下面積、診斷界值及診斷敏感性、特異性。以P<0.05為差異有統計學意義。
2 結 果
2.1 腦膠質瘤術后復發及放射性腦損傷區的1H-MRS及DWI表現 腫瘤復發者Cho波較放射性腦損傷者明顯升高,并且在b=1 000的DWI圖中,復發組的信號也高于放射性損傷組,見圖1和圖2。放射性壞死組的ADC值顯著高于復發組(P<0.05),而Cho/Cr和Cho/NAA值顯著低于復發組(P<0.05);兩組NAA/Cr比較,差異無統計學意義(P>0.05),見表1。

圖1 腦膠質瘤術后復發的1H-MRS及DWI表現
注:患者女,41歲,腦質瘤放射治療結束3個月后隨訪發現復發。圖A為MRI T1增強圖像顯示,左側額顳葉明顯不均勻強化病灶;圖B 為DWI圖示,左側額顳葉病灶區呈高信號,提示彌散受限;圖C、D為MRS圖顯示,提示病灶區病灶區Cho升高,NAA、Cr明顯減低,Cho/NAA、Cho/Cr比值升高,提示腫瘤復發。
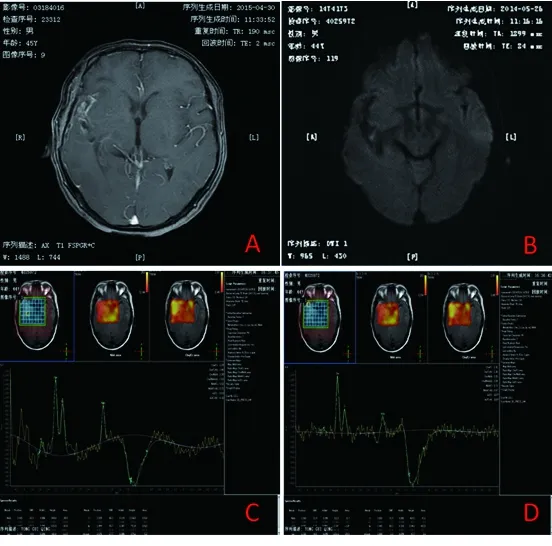
圖2 腦膠質瘤放射性腦損傷患者的1H-MRS及DWI表現
注:患者男,45歲,腦質瘤放射治療結束隨訪1年以上,病情穩定。圖A為MRI T1增強圖,右側額、顳葉可見中度強化不均勻強化病灶;圖B為DWI圖,右側額、顳葉病灶區呈等信號改變,未見彌散受壓;圖C、D為MRS圖,提示病灶區Cho輕度減低,NAA、Cr明顯減低,Cho/NAA、Cho/Cr比值稍升高,提示放射性腦損傷改變。
2.21H-MRS和DWI參數鑒別腦膠質瘤術后復發及放射性腦損傷的ROC曲線分析 ADC、Cho/Cr和Cho/NAA三者在對應的診斷閾值下,敏感性和特異性都較好,而NAA/Cr的ROC曲線分析無統計學意義,見表2。
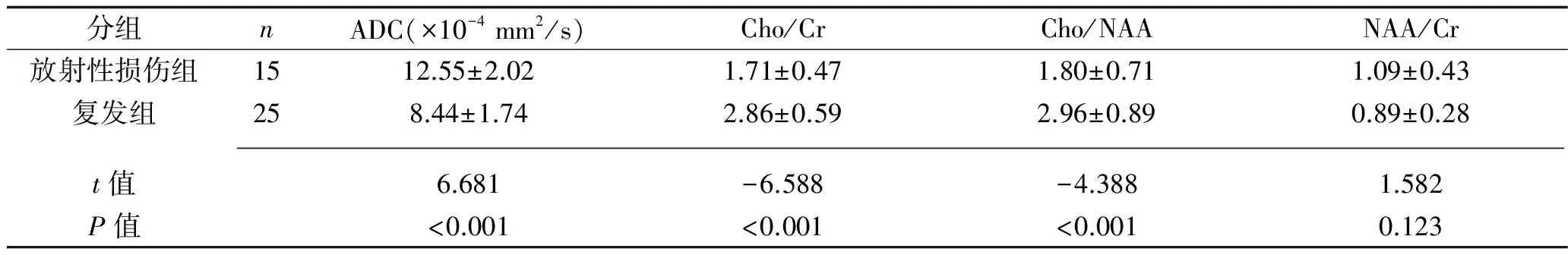
表1 兩組1H-MRS及DWI參數比較(x±s)
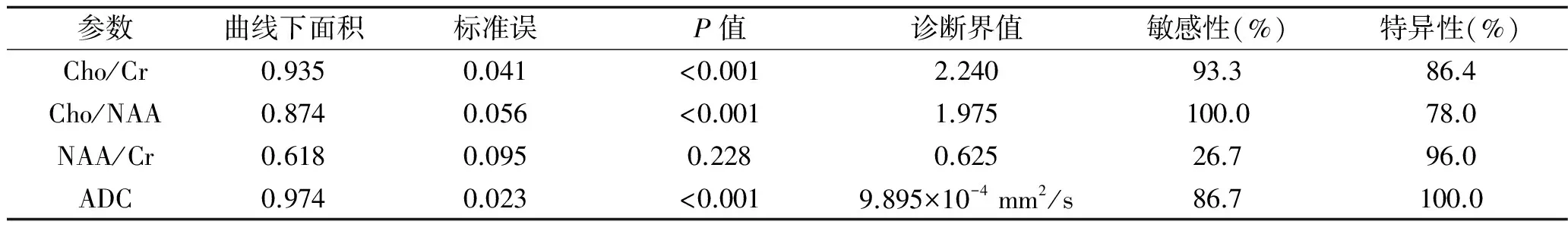
表2 1H-MRS及DWI參數的ROC曲線分析
3 討 論
3.11H-MRS在鑒別腦膠質瘤復發及放射性腦損傷中的價值 膠質瘤具有彌漫生長特性,是臨床當中最難以治愈、復發率最高的腫瘤。患者一方面需要通過手術后結合放射治療來延長生存期,另一方面也必須忍受放射治療引起的組織損傷。因此,在臨床工作中有效鑒別膠質瘤術后復發及放射性腦損傷有助于判斷治療效果,進而為臨床醫生制訂治療方案提供參考。常規MRI平掃及增強檢查是最常用的磁共振檢查技術,但腦膠質瘤術后復發及放射性腦損傷在磁共振增強檢查時示均顯示病灶區域強化,因此二者的鑒別診斷非常困難[3-4]。
1H-MRS是目前唯一無創的、可反映活體組織病理生理及生化變化的技術,可檢測常規MRI不能顯示的組織代謝情況。MRS反映腦組織代謝的化合物主要有NAA、Cho、Cr等。由于腫瘤細胞增殖旺盛、細胞代謝加快,細胞膜及細胞器的崩解可釋放游離的膽堿,1H-MRS表現為Cho峰升高;腫瘤細胞呈浸潤性生長,神經細胞遭到破壞,故其NAA峰降低[5]。故在腦膠質瘤復發患者中,其1H-MRS典型表現為NAA顯著降低,Cr稍下降,Cho不同程度升高,Cho/Cr、Cho/NAA均升高[6-7],而NAA/Cr的值比較難以預測。放射性腦損傷是放療后的并發癥,其病理生理學基礎尚未完全清楚,與患者治療過程中的照射劑量、照射視野大小及照射頻率、生存時間有關。當發生放射性壞死時,若在初期掃描,由于存在細胞破壞與炎性修復,可以造成Cho升高和NAA峰減低,但由于這時的細胞增殖處于正常范圍內,其升高和降低程度遠不如復發腫瘤細胞。當掃描發生在放射性損傷末期時,除脂質成分以外,其他代謝物表現水平均較低,因此1H-MRS表現為NAA、Cho、Cr都處于較低水平[8-9]。因此本文采用了Cho/Cr、Cho/NAA和NAA/Cr這3個參數,結果顯示放射性壞死組的ADC值顯著高于復發組(P<0.05),Cho/Cr和Cho/NAA值顯著低于復發組(P<0.05),而兩組NAA/Cr比較,差異無統計學意義(P>0.05),符合以上的規律;此外,ROC曲線分析結果顯示只有Cho/Cr和Cho/NAA具有統計學意義,且診斷效能較高。孟明柱等[10]的研究也發現,Cho/Cr、Cho/NAA的比值可以比較直觀地評價顱內膠質瘤復發與放射性腦損傷,與本文的研究結論相似。NAA/Cr值并無統計學意義,可能有以下兩方面的原因:一方面病例數較少;另一方面Cr的值同膠質瘤級別相關,本文中并未考慮該影響因素。
3.2 DWI在鑒別腦膠質瘤復發及放射性腦損傷中的價值 DWI是目前唯一一種能夠直接在活體組織上測量水分子擴散運動與成像的方法,可通過DWI間接了解細胞的密度、功能狀態及微觀結構的改變,因此可通過ADC值的測量來定量研究水分子擴散運動的大小[11]。在腫瘤組織中,細胞排列越緊密,密度越大,細胞間隙相對越狹窄,細胞內水分子擴散就越受到限制,故低級別膠質瘤的DWI表現為等或低信號,ADC值相對增高,而高級別膠質瘤的DWI表現為高信號,ADC值較低[12]。而在放射性損傷中,組織細胞壞死、液化等致使細胞密度減少,細胞間隙增大,水分子彌散運動能力活躍導致ADC值升高,而對于復發病例,由于腫瘤組織細胞密度高、細胞外間隙小,水分子彌散運動能力下降,致使ADC值減低[13]。本文結果也顯示,放射性壞死組的ADC值顯著高于復發組(P<0.05)。Asao等[14]發現復發組織ADC 值低于放射損傷組織。雖然由于機器的差異,各個實驗求解出來的具體ADC值有差異,但是卻具有相同的趨勢,本研究的研究結果與以上研究結果相似。此外,ROC曲線分析結果顯示,ADC鑒別腦膠質瘤復發及放射性腦損傷的敏感性和特異性都較高。因此,對于放療后出現異常強化的病灶,ADC值的測量有助于判定病灶內是否存在腫瘤細胞密集區,對于評估放射治療效果有一定價值。
3.3 多種技術聯合應用在膠質瘤復發與放射性腦損傷鑒別中的意義 由于膠質瘤的生長特性及腫瘤內成分復雜,術后所致的局部損傷、膠質增生、伽瑪刀治療后所致的損傷以及腫瘤不同轉歸造成腫瘤成分混雜等原因,單純利用一種磁共振成像技術對病變進行分析有一定的局限性。通過對DWI和H-MRS的多參數定量分析,能顯著改善復發與損傷的鑒別診斷準確率,對臨床制訂治療方案具有重要參考價值。
[1] 戴勤弼,沈光建,耿明英,等.星形膠質細胞瘤伽瑪刀治療的療效與影響因素[J].中國微侵襲神經外科雜志,2004,9(12):531-532.
[2] 付學海,石 梅,肖 鋒,等.分次伽瑪刀治療腦膠質瘤的近期療效分析[J].現代腫瘤醫學,2010,18(11):2 130-2 132.
[3] 楊 丹,岳曉琳,張 晶,等.腦膠質瘤復發與放射性腦損傷的鑒別診斷[J].實用腫瘤學雜志,2010,24(2):120-122.
[4] 余光宏,許百男,陳曉雷.氫質子磁共振波譜在膠質瘤診斷與分級中的應用進展[J].華南國防醫學雜志,2010,24(3):233-236.
[5] Ando K,Ishikura R,Nagami Y,et al.Usefulness of Cho/Cr ratio in proton MR spectroscopy for differentiating residual/recurrent glioma from non-neoplastic lesions[J].Nihon Igaku Hoshasen Gakkai Zasshi,2004,64(3):121-126.
[6] 王 莉,孫立新,于學文,等.中國磁共振波譜診斷膠質瘤術后復發與放射性腦損傷[J].中國醫學影像學雜志,2014,22(7):535-539.
[7] Server A,Josefsen R,Kulle B,et al.Proton magnetic resonance spectroscopy in the distinction of high-grade cerebral gliomas from single metastatic brain tumors[J].Acta Radiol,2010,51(3):316-325.
[8] Calvar JA,Meli FJ,Romero C,et al.Characterization of brain tumors by MRS,DWI and Ki-67 labeling index[J].J Neurooncol,2005,72(3):273-280.
[9] 王 巖.早期放射性腦損傷MRI研究進展[J].中國醫學影像學雜志,2012,20(4):315-316.
[10]孟名柱,周勝利,苗重昌,等.DWI聯合1H-MRS多參數分析鑒別膠質瘤術后復發與放射性腦損傷[J].中國醫學影像技術,2011,27(5):905-909.
[11]張秀明,戴 峰,喬 偉,等.磁共振功能成像在鑒別腦膠質瘤術后復發與放射性損傷中的應用[J].中國醫學影像學雜志,2013,(3):161-165.
[12]Pozza F,Colombo F,Chierego G,et al.Low-grade astrocytomas:treatment with unconventionally fractionated external beam stereotactic radiation therapy[J].Radiology,1989,171(2):565-569.
[13]葛光治,楊 藝,張 強.多模態磁共振技術在膠質瘤復發與放射性腦損傷鑒別診斷中的應用價值[J].解放軍醫學雜志,2015,40(11):921-926.
[14]Asao C,Korogi Y,Kitajima M,et al.Diffusion-weighted imaging of radiation-induced brain injury for differentiation from tumor recurrence[J].AJNR Am J Neuroradiol,2005,26(6):1 455-1 460.
廣西醫藥衛生科研課題(Z2013648)
劉鐵軍(1969~),男,碩士,副主任醫師,研究方向:神經及頭頸影像學診斷。
R 739.41
A
0253-4304(2016)05-0711-04
10.11675/j.issn.0253-4304.2016.05.33
2016-01-14
2016-04-05)

