番茄紅素在紅葡萄柚汁模擬體系中降解機制研究
徐 媛,潘思軼
(1.江漢大學生命科學學院,湖北武漢 430100;2.華中農業大學食品科學與技術學院,湖北武漢 430070)
?
番茄紅素在紅葡萄柚汁模擬體系中降解機制研究
徐 媛1,潘思軼2,*
(1.江漢大學生命科學學院,湖北武漢 430100;2.華中農業大學食品科學與技術學院,湖北武漢 430070)
為探討紅葡萄柚中番茄紅素的降解機制,本文通過構建紅葡萄柚模擬體系對番茄紅素進行降解動力學研究。結果表明抗壞血酸和糖類能顯著促進番茄紅素的熱降解,而β-胡蘿卜素卻能延緩番茄紅素的降解,且這種保護作用比前兩者促進作用更有優勢。β-胡蘿卜素和抗壞血酸均能降低溫度對番茄紅素降解速率的影響,而糖類對番茄紅素的促降解作用卻與溫度密切相關。與其他模擬體系不同,有糖存在的模擬體系中的番茄紅素熱降解并不符合一級反應動力學。糖類對番茄紅素的促降解作用影響依次為:葡萄糖<蔗糖<果糖。紅葡萄柚中主要內源因子在不同體系中對番茄紅素降解協同表現出促進或保護作用,研究結果為紅葡萄柚及番茄紅素功能食品的研發提供了理論依據。
番茄紅素,紅葡萄柚,模擬體系,降解機制
紅葡萄柚色澤艷麗,香氣獨特,果汁酸甜適度,營養豐富,其加工果汁在國內外市場具有較大市場競爭力。番茄紅素(Lycopene,LYC)因其高度不飽和長鏈結構而具有獨特的抗癌抗氧化、提高免疫力等生理活性[1-2],作為典型的因番茄紅素呈色的水果[3],紅葡萄柚在其貯藏和加工中極易因番茄紅素的氧化降解而發生色澤與品質變化,并直接影響產品生理活性功能。紅葡萄柚番茄紅素的穩定性是紅葡萄柚汁加工過程中亟待解決的重要問題,尤其是熱處理對其影響極大。因此對于消費者和商家而言,如何防止番茄紅素降解具有重要意義。
紅葡萄柚中主要營養成分,如抗壞血酸、糖類、金屬離子及其他類胡蘿卜素類物質等內源因子,在番茄紅素降解中存在重要影響。部分研究報道抗壞血酸的存在能顯著降低番茄紅素氧化速率,從而對番茄紅素具有較好保護作用[4];而其他學者認為,抗壞血酸可能對番茄紅素具有促氧化作用[5-6],這可能是由于抗壞血酸還原活性氧而生產大量羥基自由基,從而使番茄紅素發生降解。部分報道糖類通過降低體系中溶解氧和水活從而減緩番茄紅素的氧化降解[7-8],而糖的降解代謝產物呋喃型化合物等表現出明顯的番茄紅素促降解作用[9]。類胡蘿卜素類作為天然色素及抗氧化劑的一種,可增強番茄紅素的穩定性,并起到增色作用,因此可通過添加類胡蘿卜素類物質防止番茄紅素的降解。雖然部分學者對番茄紅素降解做了研究[10-11],然而紅葡萄柚體系中內源因子及其協同作用對番茄紅素降解的影響未有報道。同時對番茄紅素穩定性的相關研究中,也并沒有考慮抗壞血酸、糖類、金屬離子、類胡蘿卜素及溫度等對番茄紅素降解的協同影響。
因此,本文通過構建模擬體系研究各內源因子及其相互作用對番茄紅素穩定性的影響,通過建立不同模擬體系熱降解動力學研究抗壞血酸、糖及β-胡蘿卜素在紅葡萄柚番茄紅素熱降解中的綜合作用,探討在紅葡萄柚各內源因子存在情況下番茄紅素的降解情況,更有利于我們以較接近現實的體系了解番茄紅素的降解機制,同時為紅葡萄柚汁加工提供理論依據,并對其他富含番茄紅素的果蔬類加工提供理論參考。
1 材料與方法
1.1 材料與儀器
紅葡萄柚 浙江省農業科學研究所“Star Ruby”品種。將紅葡萄柚手工去皮去籽后,用組織研磨機均質處理得到的葡萄柚汁。灌裝后密封并置于-20 ℃下冷凍保存備用。丙酮(分析純)、石油醚(60~90 ℃)(分析純) 上海上海振興化工一廠;L-抗壞血酸、果糖、蔗糖、葡萄糖、檸檬酸均為分析純 購于國藥集團化學試劑有限公司;二丁基羥基甲苯(butylated hydoxy toluene,BHT)(分析純) 國藥集團化學試劑有限公司;甲醇(色譜純) 美國Fisher Chemicals公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)(色譜純) 美國Fisher Chemicals公司;番茄紅素≥90% 美國Sigma Aldrich公司。
HR2168研磨機 PHILIPS;RE52-99型旋轉蒸發器 上海亞榮生化儀器廠;UV-1700 SPC型紫外可見分光光度計 日本SHIMADZU公司;UitraScan XE型色度儀 美國HunterLab公司;Waters高效液相色譜儀(配有2996 型二極管陣列檢測器) 美國Waters公司;液相色譜保護柱(C18,50 mm×4.6 mm i.d.) 菲羅門科學儀器有限公司;液相色譜柱(YMC C30 3 μm,150 mm×4.6 mm i.d.) 日本YMC公司。
1.2 實驗方法
1.2.1 紅葡萄柚汁中類胡蘿卜素的分析測定 準確稱取10.00 g紅葡萄柚樣品,以石油醚∶丙酮∶乙醇=2∶1∶1(v/v/v)為提取溶劑,溶液中加入0.01%的BHT以防止類胡蘿卜素的氧化,劇烈震蕩后,5000 r/min下冷凍離心15 min,收集上層有機相于棕色瓶中,整個過程避光進行。重復操作直至紅葡萄柚汁變為無色,合并提取液后用無水Na2SO4干燥,過濾后將濾液于30 ℃下真空旋轉蒸發至干,并用流動相復溶(MTBE∶甲醇=1∶1 v/v),并定容至10 mL,置于-20 ℃貯藏。
樣品過0.22 μm的濾膜后,使用高效液相色譜儀進行分析。色譜柱:YMC C30(150 mm×4.6 mm i.d.);流動相:A:甲醇∶乙腈(75∶25,v/v);B:MTBE;進樣量10 μL;洗脫條件:0 min 90% A,10% B;15 min 50% A,50% B;25 min 20% A,80% B;30 min 90% A,10% B;45 min 100% A,0% B。柱溫維持30 ℃,流速為0.8 mL/min,檢測波長450 nm[12]。按該色譜條件制作標曲并計算相應含量。
1.2.2 紅葡萄柚中糖和抗壞血酸的含量測定 采用HPLC法測定紅葡萄柚中糖的含量。準確稱取10.00 g紅葡萄柚樣品,水浴超聲波提取并離心超濾,濾液過Sep-pak C18固相萃取小柱,收集濾液用0.45 μm濾膜抽濾,取10 μL濾液進樣分析。色譜條件如下:色譜柱:Agilent Zorbax carbohydrate 分析柱(4.6 mm×250 mm,5 μm);柱溫:(25±2) ℃;檢測器:示差折光檢測器,流動相:乙腈/水,80/20(v/v);流速:1 mL/min;進樣體積:10 μL。以葡萄糖、果糖、蔗糖做標曲,計算含量。
同樣采用HPLC法測定紅葡萄柚汁中抗壞血酸含量。準確稱取10.00 g紅葡萄柚樣品,用0.1%草酸溶液定容后用0.45 μm的濾膜過濾。色譜條件如下:色譜柱:sinochrom ODS-BP(4.6 mm×250 mm,5 μm);流動相:0.1%草酸溶液;流速:0.8 mL/min;進樣體積:10 μL。HPLC分析制作標準曲線。根據標準曲線計算紅葡萄柚中VC含量。
1.2.3 紅葡萄柚中番茄紅素的提取與純化 稱取100 g凍藏紅葡萄柚汁,在提取溫度30 ℃下,以液料比3.5∶1(mL/g)加入石油醚浸提3.8 h后過濾[12],將濾液進行旋轉蒸發濃縮,該濃縮液即為番茄紅素和β-胡蘿卜素體系;將濃縮液用硅膠柱(200 mm×16 mm ID,100~200目)進行柱層析分離,采用石油醚∶丙酮=9∶1(v/v)為洗脫液[13],收集紅色番茄紅素部分,將此組分濃縮蒸干后用石油醚復溶進行二次柱層析,方法同前,即得去除其他類胡蘿卜素的純化的番茄紅素溶液。
1.2.4 紅葡萄柚汁模擬體系建立及熱處理 采用pH與紅葡萄柚汁相同的檸檬酸-檸檬酸鈉緩沖溶液,將番茄紅素和β-胡蘿卜素體系、純化番茄紅素溶解于有機溶劑(石油醚∶丙酮∶95%乙醇=2∶1∶1 v/v/v),根據紅葡萄柚中各組分含量,分別添加L-抗壞血酸和不同糖類構建模擬體系,保持所有模擬體系中番茄紅素濃度一致。取各樣品10 mL于具塞試管中,根據紅葡萄柚加工溫度,分別設定在70、80、90 ℃條件下對各模擬體系進行熱處理,每隔1 h取樣檢測番茄紅素含量。
1.2.5 番茄紅素含量測定 采用分光光度法測定提取液中番茄紅素含量[14]。
1.3 熱降解動力學模型
多數研究表明番茄紅素熱降解遵循一級反應動力學模型[15],假設模擬體系中番茄紅素的熱降解也符合一級降解動力學,其降解速率常數k和半衰期t1/2可通過以下公式計算得出:
Arrhenius方程可用來表達番茄紅素降解過程的溫度依賴性。活化能Ea和頻率常數K0可從一級反應降解速率常數的對數ln(k)和絕對溫度的倒數(1/T)線性回歸后求出。
表1 紅葡萄柚類胡蘿卜素的色譜、光譜和Q值及其含量
Table 1 Chromatographic,UV-Vis,Q value and contents of the carotenoids in red grapefruit

峰aRt(min)b鑒定光譜(nm)c光譜/(nm)dQ值本次文獻[17]含量(mg/kg)1435β-胡蘿卜素4524784534771147±004291715-cis-番茄紅素362437460492362446470506061075304±002396513-cis-番茄紅素360440465496362446470500055055242±005410849-cis-番茄紅素360440465496362446470500012012197±00352541番茄紅素4464735034424765062341±003
注:a峰的編號見圖1;b保留時間;c PDA檢測的化合物光譜數據;d文獻中相應化合物光譜數據[17]。
1.4 數據分析
各熱處理后樣品含量及色澤測定均重復三次并求平均值。所有數據通過SPSS 18.0軟件進行Duncan差異分析及方差分析。
2 結果與分析
2.1 紅葡萄柚中類胡蘿卜素成分分析
紅葡萄柚中類胡蘿卜素的高效液相色譜圖如圖1所示,主要有5種天然的類胡蘿卜素,以峰1和峰5為主。根據保留時間、吸收光譜和Q值數據(順式吸收峰362 nm處吸收強度與最大吸收峰的吸收強度比值),結合文獻[16-17],發現紅葡萄柚汁中主要類胡蘿卜素為β-胡蘿卜素,15-順式番茄紅素,13-順式番茄紅素,9-順式番茄紅素和全反式番茄紅素。各類胡蘿卜素色譜、光譜數據及其含量見表1。

圖1 紅葡萄柚中類胡蘿卜素高效液相色譜圖Fig.1 HPLC analysis for carotenoids from red grapefruit
由表1可知紅葡萄柚中類胡蘿卜素主要以β-胡蘿卜素和全反式番茄紅素為主,其含量分別為(11.47±0.04) mg/kg和(23.41±0.03) mg/kg,其中番茄紅素以全反式結構為主。當番茄紅素從反式向順式轉變時,其特征吸收光譜會隨之變化,在紫外區362 nm處會出現一個順式峰;與全反式相比,順式異構體主體吸收峰的最大吸收波長也會發生輕微紫移,峰高也相應降低。
2.2 紅葡萄柚汁模擬體系的構建
酚酞變色范圍是pH 8.2~10.0。當pH>8.2時為紅色的醌式結構,酚酞的醌式或醌式酸鹽,在堿性介質中很不穩定,它會慢慢地轉化成無色羧酸鹽式。酚酞試劑滴入濃堿液時,酚酞開始變紅,很快紅色退去變成無色,當遇到氫離子后即變回紅色[2],在pH<8.2的溶液里為無色的內酯式結構。通過溶液中酚酞顏色突變時計算機顯示溶液的pH了解中和反應接近完成。
通過HPLC方法首先測定紅葡萄柚中L-抗壞血酸,糖和其他類胡蘿卜素的含量。HPLC分析顯示,紅葡萄柚汁中含有的糖為葡萄糖,果糖和蔗糖。番茄紅素,L-抗壞血酸,糖及β-胡蘿卜素的含量如表2所示。根據此測定結果,分別設計含有L-抗壞血酸、各單糖及總糖、β-胡蘿卜素的模擬體系并進行配制,11組模擬體系具體構成如表3所示。
表2 紅葡萄柚中番茄紅素,L-抗壞血酸,糖及其他類胡蘿卜素的含量
Table 2 The concentrations of lycopene,L-AA,sugars and carotenoid in red grapefruit juice
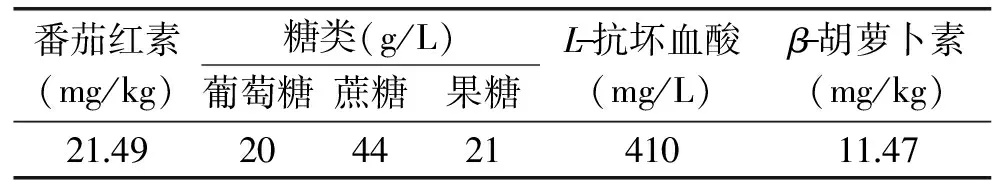
番茄紅素(mg/kg)糖類(g/L)葡萄糖蔗糖果糖L-抗壞血酸(mg/L)β-胡蘿卜素(mg/kg)21492044214101147
2.3 模擬體系中抗壞血酸對番茄紅素降解的影響
根據模擬體系設置添加抗壞血酸量,研究不同熱處理溫度下抗壞血酸對番茄紅素降解的影響。各溫度下番茄紅素及添加抗壞血酸番茄紅素體系(LYC-AA)的熱降解如圖2所示,結果表明在所設定溫度下抗壞血酸均能顯著促進番茄紅素的降解(p<0.05),且不同溫度下ln(C/C0)與時間t之間線性關系良好,表明該模擬體系中LYC的降解符合一級反應動力學,各熱降解動力學參數如表4所示。

圖2 不同溫度下LYC和LYC-AA體系中番茄紅素的熱降解Fig.2 Degradation of lycopene in LYC system and LYC-AA system at different temperature
實驗結果表明,與LYC體系相比,當體系中添加抗壞血酸后番茄紅素的降解速率是隨著溫度變化而改變的。然而這種作用并不是因為隨著溫度升高抗壞血酸能增進番茄紅素的降解,實際上通過數據分析可知,LYC-AA與LYC兩個體系中番茄紅素降解速率之比是隨著溫度升高而減小的,70 ℃時兩體系k值之比為5.9,而90 ℃其比值則降為2.4(表4)。由此可知,雖然抗壞血酸能促進番茄紅素降解,但溫度對其促進作用并不顯著。從表4可知,LYC體系番茄紅素90 ℃下k值為70 ℃的4.47倍,而LYC-AA體系中90 ℃下番茄紅素降解速率為70 ℃時的1.81倍,該結果表明溫度和抗壞血酸在番茄紅素降解過程中并不是增效作用。
表3 模擬體系中番茄紅素(LYC),抗壞血酸(AA),糖(Sugars)和β-胡蘿卜素的添加量
Table 3 Fortified content of lycopene(LYC),ascorbic acid(AA),sugars andβ-carotene in various model systems
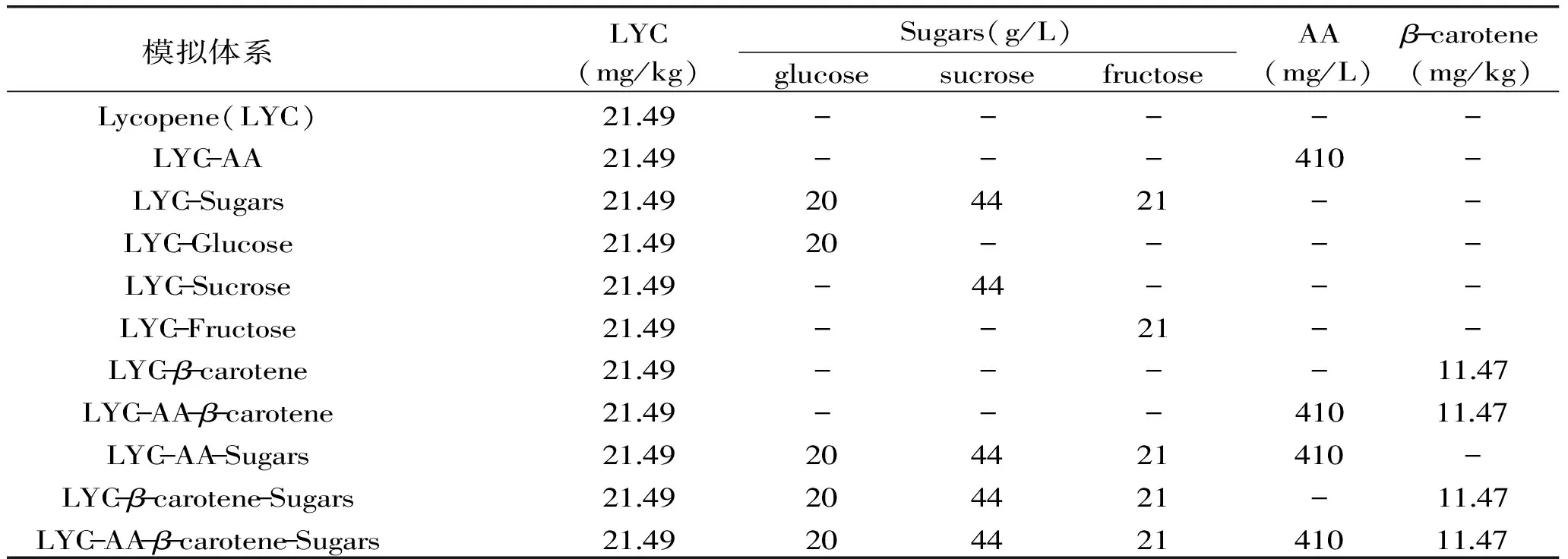
模擬體系LYC(mg/kg)Sugars(g/L)glucosesucrosefructoseAA(mg/L)β-carotene(mg/kg)Lycopene(LYC)2149-----LYC-AA2149---410-LYC-Sugars2149204421--LYC-Glucose214920----LYC-Sucrose2149-44---LYC-Fructose2149--21--LYC-β-carotene2149----1147LYC-AA-β-carotene2149---4101147LYC-AA-Sugars2149204421410-LYC-β-carotene-Sugars2149204421-1147LYC-AA-β-carotene-Sugars21492044214101147

圖3 不同溫度下LYC體系和LYC-β-carotene體系中番茄紅素的降解Fig.3 Degradation of lycopene in LYC system and LYC-β-carotene system at different temperature
注:含有Sugars體系的為添加葡萄糖、果糖及蔗糖三種內源糖的復合體系。
2.4 模擬體系中β-胡蘿卜素對番茄紅素降解的影響
圖3反應了不同溫度下模擬體系中β-胡蘿卜素對番茄紅素降解的影響。結果表明:各體系在70、80、90 ℃下ln(C/C0)與時間t之間線性關系良好,模擬體系中LYC的降解符合一級反應動力學;由圖3可知,LYC-β-carotene體系中番茄紅素的降解曲線均位于LYC體系降解曲線上方,表明LYC-β-carotene體系熱降解進程較慢,各體系中熱降解動力學參數如表4所示。
表4 不同溫度下模擬體系及紅葡萄柚汁中番茄紅素降解參數
Table 4 Kinetic parameters of lycopene degradation in model systems and red grapefruit juice at different temperatures

模擬體系溫度(℃)k(1/h)at1/2(h)Ea(kJ/mol)aK0(1/h)Lycopene(LYC)7000433(09942)1608000811(09912)85774(09880)254E+109001936(09924)36LYC-AA7002568(09956)278003621(09948)19308(09945)127E+04900465(0996)15LYC-β-carotene7000379(09966)1838000701(09970)99612(09919)776E+079001234(09903)56LYC-AA-β-carotene7000413(09888)1688000759(09939)91706(09883)225E+099001617(09968)43LYC-AA-Sugars7003058(09965)438004218(09949)14287(0994)72E+039005317(09969)08LYC-β-carotene-Sugars7000381(09964)1828000764(09934)91721(09997)36E+099001533(09954)45LYC-AA-β-carotene-Sugars7000825(09918)848001195(09895)58448(09902)52E+059001960(09913)35紅葡萄柚汁7000663(09901)1058001134(09950)61586(09979)546E+079002057(09941)34
注:a表示括號內標注的為相關系數(R2);表4中所有模擬體系的熱降解均遵從一級動力學,但是LYC-Sugars,LYC-Glucose,LYC-Sucrose,LYC-Fructose四個體系的熱降解不符合一級動力學,故不包括在表4中,下面有關于這四個體系的降解動力學分析。
由表4可知,LYC-β-carotene體系中番茄紅素降解速率在不同溫度下均小于LYC體系,表明β-胡蘿卜素對番茄紅素的降解具有保護作用,這主要是由于β-胡蘿卜素等類胡蘿卜素本身具有較強的抗氧化性,因此溫度對其具有競爭氧化作用,從而減少熱能對番茄紅素的影響以達到保護番茄紅素穩定性的作用。
對實驗結果分析可知LYC與LYC-β-carotene兩者體系的番茄紅素降解速率在70 ℃下比值為1.14,而在90 ℃時則為1.57(表4),然而這并不表示β-胡蘿卜素對番茄紅素的保護作用隨著溫度的升高而增強,對比兩個體系Ea值可以得知,這主要是由于LYC-β-carotene體系具有較低活化能,因此該體系中番茄紅素的降解對溫度依賴性較小。
2.5 模擬體系中糖類對番茄紅素降解的影響
當向模擬體系中分別添加葡萄糖、蔗糖和果糖后,在不同溫度下進行熱處理,研究各糖類對番茄紅素降解的影響,以ln(C/C0)對t作圖,結果發現含有這些糖的模擬體系下番茄紅素的降解均不符合一級降解動力學,LYC-Sugars,LYC-Glucose,LYC-Sucrose,LYC-Fructose四個體系中不同溫度下的降解反應速率并不恒定,且隨著反應時間的延長番茄紅素的降解呈現加速趨勢。
從圖4可以看出,不同模擬體系中糖對番茄紅素的降解具有雙重作用,即在熱降解初期糖類對番茄紅素的降解具有保護作用,圖4中不同溫度熱處理初始階段1 h內,四條降解曲線均位于直線之上,表明在此時間段中四個含糖模擬體系的降解速率均小于番茄紅素自身熱降解;但隨著熱處理的延長,1 h后四條曲線均降到直線之下,表明隨后四個含糖模擬體系的降解速率又遠大于LYC體系的自身降解,糖在此時對番茄紅素表現出明顯的促降解作用,90 ℃下這種情況最為顯著。

圖4 添加不同糖的模擬體系中番茄紅素的降解Fig.4 Degradation of lycopene in different model systems fortified with various sugars
以90 ℃為例(圖4C),在反應初始階段1 h內,添加葡萄糖、果糖、蔗糖及總糖后的模擬體系中番茄紅素的熱降解速率比LYC體系中慢,這可能是由于糖能夠降低體系中的溶解氧和水活作用而使番茄紅素更為穩定。但加熱1 h后,添加糖類的體系中番茄紅素的降解速率明顯快于LYC體系,這主要是由于糖在加熱過程中生成的熱降解產物,如呋喃型化合物等,參與了番茄紅素的降解反應,促進了番茄紅素的熱降解。
由實驗可知,在所有添加糖的體系中番茄紅素lnC/C0的變化隨著溫度的升高呈線性增大。這可能是由于在較低溫度下糖的熱降解產物形成速率較慢,所以番茄紅素降解速率就較慢。當高溫長時加熱時,糖形成熱降解產物的速率加快且超過其降低水活的作用時,番茄紅素熱降解也隨之加速。并且,在反應2.5 h之后,LYC-Sugars體系在70 ℃和80 ℃情況下番茄紅素剩余量分別為68.61%和55.47%,90 ℃下僅為22.26%。由此可知90 ℃下糖的熱降解產物形成速率遠遠快于80 ℃和70 ℃。因此,在紅葡萄柚生產加工過程中應盡量避免高溫條件下進行長時間熱處理。
此外,研究結果表明各種糖對番茄紅素降解的促氧化作用依次為:葡萄糖<蔗糖<果糖。導致這種現象的原因,可能是由于果糖比葡萄糖更容易形成呋喃型化合物如糠醛等,呋喃型化合物具有極強的親電反應能力,能攻擊番茄紅素電子云使其發生氧化降解。而蔗糖是雙糖,需水解為葡萄糖和果糖才能形成糠醛,因此它所引起的番茄紅素降解速率介于果糖和葡萄糖之間。
2.6 模擬體系中抗壞血酸及β-胡蘿卜素對番茄紅素降解的影響
抗壞血酸及β-胡蘿卜素對番茄紅素熱降解的影響如圖5所示,LYC-AA-β-carotene體系中番茄紅素的熱降解也符合一級反應動力學,其降解動力學參數見表4。
90 ℃下,LYC-AA-β-carotene體系中番茄紅素的熱降解速率是LYC-β-carotene體系中的1.31倍,但LYC體系卻是LYC-AA-β-caratene體系的1.20倍,LYC-AA體系是LYC-AA-β-carotene的2.88倍。以上結果表明β-胡蘿卜素能阻止抗壞血酸與番茄紅素的氧化降解,且當β-胡蘿卜素與抗壞血酸共同作用時,β-胡蘿卜素對番茄紅素的保護作用在番茄紅素降解過程中為主導作用。

圖5 添加抗壞血酸以及β-胡蘿卜素的模擬體系中番茄紅素的降解Fig.5 Degradation of lycopene in model systems fortified with AA and β-carotene to the same level of red grapefruit juice
2.7 模擬體系中糖及β-胡蘿卜素對番茄紅素降解的影響
如圖6所示,在添加了β-胡蘿卜素之后,可以觀察到其對糖催化的番茄紅素熱降解具有明顯保護作用。由表4數據分析可知LYC-β-carotene-Sugars體系中番茄紅素的降解速率k要小于LYC體系,說明當β-胡蘿卜素與糖類物質共存時,β-胡蘿卜素對番茄紅素的保護作用遠大于糖類對番茄紅素的促降解作用,其保護作用占主導地位。β-胡蘿卜素可能通過以下三種方式阻止番茄紅素的熱降解:第一,與番茄紅素共同競爭糖的熱降解產物;第二,β-胡蘿卜素阻止了糖的熱降解進程;第三,β-胡蘿卜素作為抗氧化劑阻止番茄紅素的熱降解。

圖6 添加糖以及β-胡蘿卜素的模擬體系中番茄紅素的降解 Fig.6 Degradation of lycopene in model systems fortified with AA and β-carotene to the same level of red grapefruit juice
2.8 模擬體系中抗壞血酸及糖對番茄紅素降解的影響
抗壞血酸及糖類作用對番茄紅素降解的影響如圖7所示。在實驗溫度下,除90 ℃加熱后期外,抗壞血酸具有比糖更顯著的番茄紅素促降解作用。這可能是由于在70 ℃和80 ℃下糖自身的熱降解較慢,而抗壞血酸卻降解較快,因此使抗壞血酸引起的番茄紅素降解速率大于糖體系中降解速率;但當溫度上升至90 ℃后,糖的熱降解顯著加快,而抗壞血酸體系中番茄紅素熱降解Ea較小,其番茄紅素熱降解對溫度敏感性較差,因此溫度升高使抗壞血酸引起的番茄紅素降解速率變化不大,從而導致90 ℃下糖對番茄紅素的降解作用大于抗壞血酸。

圖7 添加糖以及抗壞血酸的模擬體系中花色苷的降解Fig.7 Degradation of anthocyanins in model systems fortified with AA and flavonoids to the same level of blood orange juice
而當體系中同時添加抗壞血酸和糖類時,兩者對番茄紅素的熱降解起到非常明顯的增效作用(圖7)。這主要是由于抗壞血酸和糖類對番茄紅素的穩定性均為負作用,且二者的降解產物會促進番茄紅素的降解,因此促降解的疊加效果明顯;但是在90 ℃時的反應后期,抗壞血酸和糖對番茄紅素的降解作用并沒有單獨糖的降解作用明顯,這可能是高溫長時加熱致使糖生成的熱降解產物濃度上升,從而會影響抗壞血酸和糖類之間對番茄紅素降解的增效作用。
2.9 模擬體系中抗壞血酸,β-胡蘿卜素及糖對番茄紅素降解的影響
當抗壞血酸,β-胡蘿卜素和糖同時添加到模擬體系中時,該體系中番茄紅素降解速率比LYC-AA-β-carotene體系要快,而比LYC-AA-Sugars體系慢(表4)。這與前面的實驗結論相一致:抗壞血酸和糖能共同促進番茄紅素的熱降解,但β-胡蘿卜素則對番茄紅素的降解具有保護作用。
此外,除90 ℃外,紅葡萄柚汁和LYC-AA-β-carotene-Sugars體系中番茄紅素的降解速率明顯大于LYC體系(圖8)。這表明當體系中共同存在抗壞血酸和糖時,β-胡蘿卜素對番茄紅素的降解保護作用會被抵消。然而,在90 ℃下熱處理時,LYC體系、紅葡萄柚汁和LYC-AA-β-carotene-Sugars體系中番茄紅素的降解速率并無顯著性差異(p>0.05)(表4)。這表明當溫度上升至90 ℃時LYC體系中番茄紅素的降解速率明顯加快,而相比之下,LYC-AA-β-carotene-Sugars體系和紅葡萄柚汁體系具有較低活化能,溫度對這兩個體系中番茄紅素降解速率的影響比LYC體系小(圖8C)。由表4可知,在70 ℃,80 ℃下紅葡萄柚汁和LYC-AA-β-carotene-Sugars體系中番茄紅素的熱降解有些微差異,這很可能是由于紅葡萄柚汁中的一些其他成分,如氨基酸、金屬離子、蛋白質等對番茄紅素的降解作用所造成的。

圖8 紅葡萄柚汁及模擬體系中番茄紅素的降解Fig.8 Degradation of lycopene in red grapefruit juice and model systems
3 結論與討論
本研究通過模擬體系構建,揭示了紅葡萄柚中主要內源因子對紅葡萄柚番茄紅素降解的協同作用。其中抗壞血酸和糖類能顯著促進番茄紅素的熱降解,且抗壞血酸具有比糖更顯著的番茄紅素促降解作用,當體系中同時存在抗壞血酸和糖類時,番茄紅素的熱降解表現為明顯的增效作用;而β-胡蘿卜素卻對番茄紅素具有保護作用,且當與抗壞血酸或糖類共存時,這種保護作用在番茄紅素降解中占主導地位,其原因可能是β-胡蘿卜素作為抗氧化劑能阻止番茄紅素的熱降解和糖的熱降解,并與番茄紅素共同競爭糖的熱降解產物如呋喃型化合物。β-胡蘿卜素和抗壞血酸均能降低溫度對番茄紅素降解速率的影響,而糖類對番茄紅素的促降解作用卻隨著溫度升高而顯著增加。
此外,研究表明除單獨添加各糖類的模擬體系外,其余各模擬體系中LYC熱降解均屬于一級反應動力學,然而設定溫度下糖存在模擬體系中的番茄紅素熱降解并不符合一級降解動力學,其熱降解隨著溫度升高呈加速趨勢,為復合動力學反應。實驗表明糖類和抗壞血酸對番茄紅素熱降解的影響機制并不相同,糖類對番茄紅素熱降解具有雙重作用,在降解初期糖能夠降低體系中的溶解氧和水活而使番茄紅素更為穩定;持續熱處理后糖類產生熱降解產物如呋喃型化合物等具有較強的親電反應能力,能攻擊番茄紅素電子云而使其發生氧化降解;根據生成呋喃型化合物的難易程度,糖類對番茄紅素的促降解作用影響依次為:葡萄糖<蔗糖<果糖。抗壞血酸對番茄紅素的促降解作用可能是由于抗壞血酸可作為氧分子的催化劑從而產生自由基,這類自由基會攻擊番茄紅素共軛雙鍵的電子云,從而引起番茄紅素降解。
由于目前食品加工業尤其是果汁生產過程中,生產人員習慣添加抗壞血酸作為抗氧化劑以增加產品的營養品質,保護產品所含的生物活性成分不被氧化,并抑制酶促或非酶褐變所導致的色澤損失。抗壞血酸作為重要的抗氧化劑已有大量研究成果,然而目前國內外已有部分研究發現抗壞血酸具有抗氧化和促氧化的雙向作用[18-19],其促氧化機理可能是與過渡旋離子有關,同時與其在體系內清除活性氧時發生還原反應產生自由基有關[20]。本研究表明,并不是所有的食品體系均能添加抗壞血酸作為抗氧化劑,且在所有含有番茄紅素等類胡蘿卜素的食品中不易添加抗壞血酸,否則不但不能起到抗氧化作用,反而會促進番茄紅素降解而導致產品的品質損失。
[1]Mele′ndez-Mart′nez A J,Vicario I M,Heredia F J. Analysis of carotenoids in orange juice[J]. Journal of Food Composition and Analysis,2007,20(1):638-649.
[2]Collins J K,Perkins V P. Lycopene from plants to human[J]. Hortscience,2006,41(1):1135-1144.
[3]Pupin A M,Dennis M J,Toledo M C F. HPLC analysis of carotenoids in orange juice[J]. Food chemistry,1999,64(2):269-275.
[4]Moberger L,Larsson K,Buchheim W,et al. A study of fat oxidation in a microemulsion system[J]. Journal of Dispersion Science and Technology,1987,8(3):207-215.
[5]Iacobucci G A,Sweeny J G. The chemistry of anthocyanins and related flavylium salts[J]. Tetrahedron,1983,39(1):3005-3038.
[6]Kapsokefalou M,Miller D D. Iron loading and large doses of intravenous ascorbic acid promote lipid peroxidation in whole serum in guinea pigs[J]. British Journal of Nutrition,2001,85(6):681-687.
[7]De Ancos B,Cano M P,Hernandez A,et al. Effects of microwave heating on pigment composition and colour of fruit purees[J]. Journal of the Science of Food and Agriculture,1999,79(5):663-670.
[8]Mcclements D J,Decker E A. Lipid Oxidation in Oil-in-Water Emulsions:Impact of Molecular Environment on Chemical Reactions in Heterogeneous Food Systems[J]. Journal of FoodScience,2006,65(8):1270-1282.
[9]Granados J Q,Mir M V,Serrana H L,et al. The influence of added caramel on furanic aldehyde content of matured brandies[J]. Food chemistry,1996,56(4):415-419.
[10]Lee M T,Chen B H. Stability of lycopene during heating and illumination in a model system[J]. Food Chemistry,2002,78:425-443.
[11]Lavell V,Torresani M C. Modeling the stability of lycopene-rich by-products of tomato processing[J]. Food chemistry,2011,125(2):529-535.
[12]Lee H,Castle W. High-performance liquid chromatography for the characterization of carotenoids in the new sweet orange(Earlygold)grown in Florida,USA[J]. Journal of Chromatography A,2001,913(1):371-377.
[13]徐媛,王魯峰,徐曉云,等. 響應曲面法優化紅葡萄柚番茄紅素的提取工藝[J]. 食品科學,2010,31(22):255-259.
[14]張連富,丁霄霖. 番茄紅素簡便測定方法的建立[J]. 食品與發酵工業,2001,27(3):51-55.
[15]Scheibner M,Hülsdau B,Zelena K,et al. Novel peroxidases of Marasmius scorodonius degradeβ-carotene[J]. Applied microbiology and biotechnology,2008,77(6):1241-1250.
[16]Lin C,Chen B. Determination of carotenoids in tomato juice by liquid chromatography[J]. Journal of Chromatography A,2003,1012(1):103-109.
[17]Lee M,Chen B. Separation of lycopene and its cis isomers by liquid chromatography[J]. Chromatographia,2001,54(9):613-617.
[18]Diaz-Arrastla R,Hashemi E. Znic and ascorbic acid coordinately promote lipid peroxidation in brain membranes[J]. Journal of Molecular Neuroscience,2000,14(1):167-173.
[19]湯蓉,湯強,黃開勛. 維生素C的促氧化作用[J]. 生命的化學,2004,24(3):197-199.
[20]陳國烽,王亞軍. 維生素C在新陳代謝中的生理功能[J]. 中國食物與營養,2014,20(1):71-74.
Degradation mechanism of lycopene
in the model systems of red grapefruit juice
XU Yuan1,PAN Si-yi2,*
(1.College of Life Sciences,JiangHan University,Wuhan 430100,China;2.College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
To evaluate the degradation mechanism of lycopene from red grapefruit,degradation kinetics of lycopene were investigated by constructing model systems of intrinsic factors in red grapefruit juice. The results indicated that lycopene degradation was significantly accelerated by ascorbic acid and sugars. However,β-carotene had a protective effect on the degradation of lycopene,which was more important comparing to the negative effect of ascorbic acid or sugars in the degradation of lycopene. Lycopene degradation was promoted by sugars which was closely related to temperature,and the degradation of lycopene in the presence of sugars followed complex reaction kinetics at comparatively higher temperature. The stimulative effects of sugars on lycopene degradation were according to the following descending order:glucose lycopene;red grapefruit;model systems;degradation mechanism 2016-06-06 徐媛(1986-),女,博士,講師,研究方向:食品科學,E-mail:xuyuan0804@163.com。 *通訊作者:潘思軼(1965-),男,博士,教授,研究方向:食品科學,E-mail:pansiyispkx@163.com。 國家自然科學基金(31571847)。 TS202.3 A 1002-0306(2016)23-0053-09 10.13386/j.issn1002-0306.2016.23.002

